岛叶,也称脑岛,在精神疾病、慢性疼痛患者的头颅MRI中,可见岛叶灰质发生改变。由此可以推测,岛叶的功能可能与情绪控制[1]以及内脏自主神经调节有关[2]。但目前临床上尚无统一的岛叶形态学评估标准,故难以准确判断岛叶是否发生了疾病相关的结构改变。本研究通过对不同年龄段人群岛叶MRI图像进行测量,试图建立正常人岛叶形态范围值,旨在为临床影像诊断提供参考。
1 资料与方法
1.1 一般资料 选取2017年1月—2018年7月在河北医科大学第二医院参与MRI扫描的健康志愿者75例,均为右利手。所有志愿者均通过临床检查,无精神、神经类疾患,无MRI检查禁忌证。按照最新人类年龄划分标准,将志愿者划分为:青年组(20~40岁)18例,平均年龄(31.22±5.41)岁;中年组(41~65岁)31例,平均年龄(51.52±6.36)岁;老年组(66~87岁)26例,平均年龄(74.57±6.33)岁。检查前告知志愿者检查中注意事项,志愿者详细阅读并签署知情同意书。检查前对所有志愿者进行培训,包括告知该项检查对身体无害无辐射,检查全程要保持体位不可移动,检查期间噪音较大会配备耳塞保护听力,不必惊慌,如有需求可以举手示意。
本研究符合伦理要求,经医院伦理委员会批准。
1.2 扫描设备 志愿者均应用Signal Excite HD 3.0T磁共振(GE healthcare, Fairfield, CT, USA)及头颅8通道正交线圈进行MRI检查。志愿者均进行横断、冠状、矢状位T1WI扫描。扫描时,志愿者采取仰卧位,身体长轴与检查床长轴一致,未成年及颈部较短者嘱咐其放低肩胛骨,以减少不相关部位重叠对图像造成的影响,使志愿者头颅进入头线圈。扫描基线为OM线,横断面以AC-PC平面为定位,冠状面、矢状面均垂直于AC-PC平面。
1.3 扫描参数 扫描均采用T1加权三维时间飞跃扰相稳态梯度回波序列(3D-TOF-SPGR),脉冲重复间隔时间为450 ms,回波时间为25 ms,层厚0.05 cm,层间距0.6 mm。翻转角60 °,矩阵320×224,扫描视野20 cm×20 cm。
1.4 测量工具 采用3D-Slicer 软件(公司名称:The Slicer Community,软件版本4.8.1)进行测量。为保证相同观察条件,减少视觉误差,规定统一在相同灰度的条件下进行测量。用3D-slicer三维重建功能对扫描图像重建,并用ruler对图像进行测量分析。
1.5 图像测量 由3名放射科医生进行测量,3名医生均未被告知志愿者年龄。用3D-slicer进行3D图像重建。统一规定选取矢状面中岛叶形态最大、最清晰的层面作为测量层面。岛叶中最明显脑沟为中央沟,识别中央沟后,向头侧依次出现三脑沟,分别为中央前沟、岛短沟、岛横沟;中央沟向背侧走形为岛中央后沟。根据脑沟即可判断脑回,横回位于最头端,且是唯一水平走形脑回,若图像未出现岛横沟则可判定为无横回;岛横沟与岛短沟间为短前回;岛短沟与中央前沟间为短中回;中央前沟与中央沟间为短后回;中央沟与中央后沟间为长前回;岛中央后沟至背侧为长后回。各结构解剖见图1。用校正后的ruler工具,对左侧岛叶灰质宽度、白质宽度、岛沟深度、宽度进行线性测量[3-4],线性测量简便易行,结果可靠,已被多数学者接受运用。针对每个测量,每名医生均对同一测量点测量3次,取3次测量值的平均值,将3名医生所测数据进行汇总,取汇总数据的最大值,这样可以将由于肉眼测量精细结构所造成的人为误差降到最小。并将所得结果写入数据库,同时计算灰质、白质宽度比值。灰质宽度为岛叶边界至岛叶灰质白质交界线的垂直距离;白质宽度为一侧灰质白质交界线至对侧灰质白质交界线的垂直距离;灰质、白质宽度比值为灰质宽度除以白质宽度所得值;岛沟宽度为岛叶向内褶皱处两相邻边界的垂直距离;岛沟深度为褶皱凹陷最深处至褶皱消失2点间直线距离。测量标示点见图2~4。
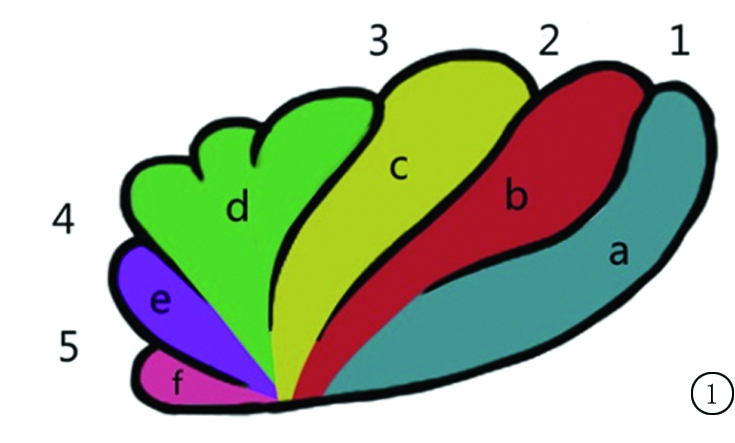
图1 左侧岛叶解剖模式图
1.岛中央后沟;2.岛中央沟;3.岛中央前沟;4.岛短沟;5.岛横沟;a.长后回;b.长前回;c.短后回;d.短中回;e.短前回;f.横回
Figure 1 Left anatomical pattern of the insular lobel

图2 岛叶灰质测量标示图
A.横回灰质宽度;B.短前回灰质宽度;C.短中回灰质宽度;D.短后回灰质宽度;E.长前回灰质宽度;F.长后回灰质宽度
Figure 2 Gray matter width surveying plot of the insular lobel

图3 岛叶白质宽度测量标示图
a.横回白质宽度;b.短前回白质宽度;c.短中回白质宽度;d.短后回白质宽度;e.长前回白质宽度;f.长后回白质宽度
Figure 3 White matter width surveying plot of the insular lobel

图4 岛叶岛沟测量标示图
1.横沟深度;2.横沟宽度;3.岛短沟深度;4.岛短沟宽度;5.岛中央前沟深度;6.岛中央前沟宽度;7.岛中央沟深度;8.岛中央沟宽度;9.岛中央后沟深度;10.岛中央后沟宽度
Figure 4 Insular sulcus surveying plot
1.6 统计学方法 应用SAS 9.0统计软件分析数据。正态分布的计量资料比较分别采用F检验和SNK-q检验;偏态分布的计量资料以中位数(四分位间距)[M(QR)]表示,比较采用非参数秩和检验。P<0.05为差异有统计学意义。
2 结 果
2.1 各年龄组岛叶横回相关参数 75例志愿者扫描图像无明显变形及伪影,不影响观察及测量。75例志愿者中23例可见横回;75例志愿者中49例可见长后回,其余未见长后回。见表1,2。
表1 横回形态参数
Table 1 Morphological paramaters of transverse gyrus

组别可见例数可见比值青年组60.333中年组80.258老年组90.346总计230.307
表2 长后回形态参数
Table 2 Morphological paramatters of long posterior gyrus

组别可见例数可见比值青年组110.611中年组220.710老年组160.615总计490.653
2.2 各年龄组脑回相关形态学参数比较 各年龄组脑回相关形态学参数差异无统计学意义(P>0.05),见表3。
2.3 各年龄组脑沟相关形态学参数比较 各年龄组横沟长度差异有统计学意义(P<0.05),而各年龄组其余相关脑沟形态学参数差异无统计学意义(P>0.05)。见表4。
表3 各年龄组脑回相关形态学参数比较
Table 3 Relevant morphological parameters of gyrus in different age groups [M(QR)]
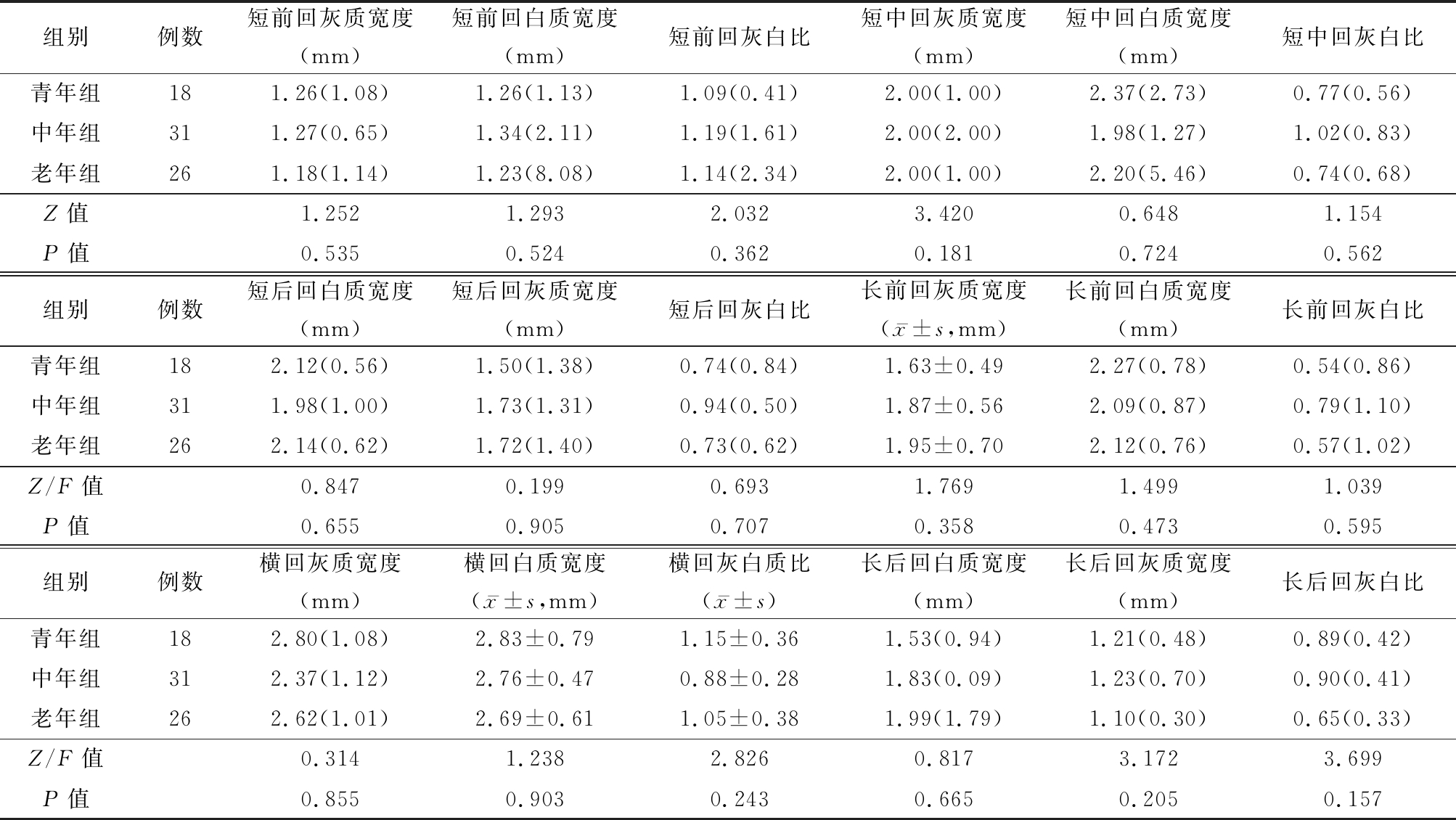
组别例数短前回灰质宽度(mm)短前回白质宽度(mm)短前回灰白比短中回灰质宽度(mm)短中回白质宽度(mm)短中回灰白比青年组181.26(1.08)1.26(1.13)1.09(0.41)2.00(1.00)2.37(2.73)0.77(0.56)中年组311.27(0.65)1.34(2.11)1.19(1.61)2.00(2.00)1.98(1.27)1.02(0.83)老年组261.18(1.14)1.23(8.08)1.14(2.34)2.00(1.00)2.20(5.46)0.74(0.68)Z值1.2521.2932.0323.4200.6481.154P值0.5350.5240.3620.1810.7240.562组别例数短后回白质宽度(mm)短后回灰质宽度(mm)短后回灰白比长前回灰质宽度(x-±s,mm)长前回白质宽度(mm)长前回灰白比青年组182.12(0.56)1.50(1.38)0.74(0.84)1.63±0.492.27(0.78)0.54(0.86)中年组311.98(1.00)1.73(1.31)0.94(0.50)1.87±0.562.09(0.87)0.79(1.10)老年组262.14(0.62)1.72(1.40)0.73(0.62)1.95±0.702.12(0.76)0.57(1.02)Z/F值0.8470.1990.6931.7691.4991.039P值0.6550.9050.7070.3580.4730.595组别例数横回灰质宽度(mm)横回白质宽度(x-±s,mm)横回灰白质比(x-±s)长后回白质宽度(mm)长后回灰质宽度(mm)长后回灰白比青年组182.80(1.08)2.83±0.791.15±0.361.53(0.94)1.21(0.48)0.89(0.42)中年组312.37(1.12)2.76±0.470.88±0.281.83(0.09)1.23(0.70)0.90(0.41)老年组262.62(1.01)2.69±0.611.05±0.381.99(1.79)1.10(0.30)0.65(0.33)Z/F值0.3141.2382.8260.8173.1723.699P值0.8550.9030.2430.6650.2050.157
表4 各年龄组脑沟相关形态学参数比较
Table 4 Relevant morphological parameters of sulcus in different age groups [M(QR),mm]
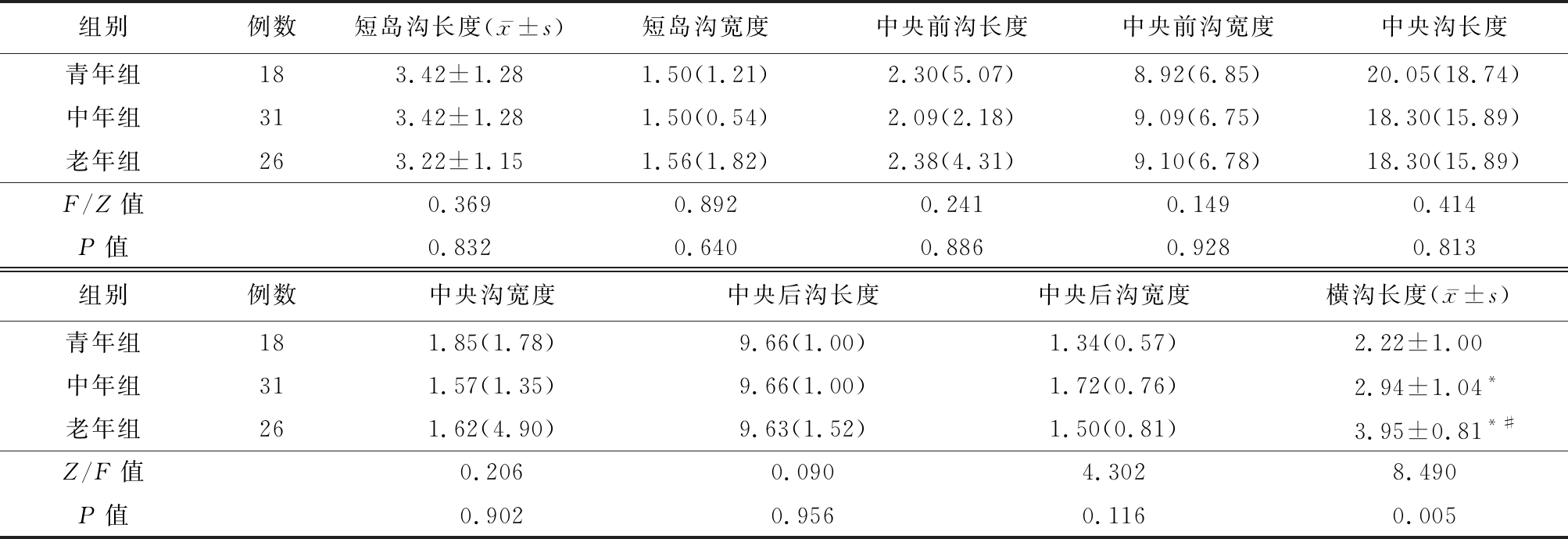
组别例数短岛沟长度(x-±s)短岛沟宽度中央前沟长度中央前沟宽度中央沟长度青年组183.42±1.281.50(1.21)2.30(5.07)8.92(6.85)20.05(18.74)中年组313.42±1.281.50(0.54)2.09(2.18)9.09(6.75)18.30(15.89)老年组263.22±1.151.56(1.82)2.38(4.31)9.10(6.78)18.30(15.89)F/Z值0.3690.8920.2410.1490.414P值0.8320.6400.8860.9280.813组别例数中央沟宽度中央后沟长度中央后沟宽度横沟长度(x-±s)青年组181.85(1.78)9.66(1.00)1.34(0.57)2.22±1.00中年组311.57(1.35)9.66(1.00)1.72(0.76)2.94±1.04*老年组261.62(4.90)9.63(1.52)1.50(0.81)3.95±0.81*#Z/F值0.2060.0904.3028.490P值0.9020.9560.1160.005
*P值<0.05与青年组比较 #P值0.05与中年组比较(SNK-q检验)
3 讨 论
3.1 岛叶的结构 岛叶一般呈三角形岛带状,位于外侧沟深面,被额顶颞叶所覆盖。岛叶中央沟将岛叶分为前岛、后岛。前岛包括横回(仅部分人可见)、短前回、短中回、短后回;后岛包括长前回、长后回(仅部分人可见)。但目前国内外对岛叶形态学亚分区及岛叶灰质白质的测量研究还比较少。本研究主要通过利用高分辨率MRI测量大脑左侧岛叶形态学结构,以得到正常中国人优势大脑半球岛叶形态学数据,从而为临床疾病诊断、手术入路、岛叶功能研究提供参考。
3.2 岛叶的功能 岛叶的功能相当复杂,影像学研究表明,前岛、后岛可以作为岛叶功能分区,前岛主要参与疼痛、情感认知和共情,后岛主要与疼痛识别功能有关[5]。近年来有研究表明,岛叶有4个网络结构区域分别与运动感觉、社会情感、认知和嗅、味觉相关,其中运动感觉主要激活岛叶中后部,社会情感主要激活岛叶前部腹侧区域,味觉与嗅觉刺激主要激活岛叶中央区域,而认知任务完成的过程激活岛叶前部背侧区域;在岛叶的背侧有一个功能重叠区域,能够将自身感觉的瞬间图像、环境和动机、社会交往进行综合,从而形成一个有知觉的自我;单纯的感觉信息首先在岛叶后部进行加工处理,经过整合感觉与认知评价,最终在岛叶前部完成整合[6]。Goerilich等[7]研究表明,岛叶体积大小与精神疾患严重程度相关。Stephani等[8]通过电刺激发现,岛叶中央区功能与自主神经调节有关。
3.3 岛叶横回及长后回变异情况 有研究显示,在瞬态受体电位通道超家族的非特异性阳离子通道trpm2、trpm7表达下,大鼠大脑神经元发育期受到影响[9]。由此推测,人类大脑在分化也受到各类基因调控。大脑在发育过程中还受环境因素影响[10]。因此,受到各种复杂因素影响,大脑结构也会有各种分化差异。本研究测量75例健康中国人左侧岛叶,岛叶的分化出现了个体差异,岛横回仅见于部分志愿者,与Faillenot等[11]研究相符;横回在人群中的结果与Jaya等[12]测量结果相符。本研究结果显示,正常人左侧岛叶横回白质平均宽度为(2.73±0.10) mm,横回灰质白质比为1.02±0.35,均符合正态分布,与年龄无直接关系(P>0.05);横沟的长度随年龄增长而增加,差异有统计学意义(P<0.05)。这可能与岛叶横回随年龄增加边界细胞构筑改变[13],进而发生功能改变有关。本研究还发现,75例健康中国人左侧岛叶,长后回的分化出现了个体差异,长后回仅见于部分志愿者。
3.4 岛叶形态学参数及年龄的影响 本研究得到了正常人左侧岛叶各脑回的形态学参数,其中除了横沟长度,其余参数与年龄均无直接关系。这是因为,在人胚脑发育过程中,端脑套层细胞分化为神经细胞,并迁移至脑表面形成大脑皮质,而边缘层细胞则分化为大脑白质,越早产生的细胞位置越深,故岛叶皮质属于古老皮质。大脑发育过程中,胚胎第4周,神经管出现3个膨大脑泡,其中前脑泡在第5周形成左右端脑,继而大脑半球向前、上、后3个方向不均匀扩展,使两半球下外侧面凹陷,形成脑岛区。因此,脑岛区属于发育较早的脑区。Anderson等[14]对岛叶神经元形态研究表明,岛叶的神经元比高级集合的皮层神经元细胞在形态上更尖,更短。脑岛代表的是一种特殊的异质性皮层,这种特殊皮层,从胎儿生命的第6周开始发育,之后分化为岛叶的皮质区域。岛叶作为最先分化和发育的皮质,出生前已比较成熟,出生后个体形态学随年龄而发生的变异较小。本研究结果显示岛叶灰质宽度在各年龄组差异无统计学意义,也印证了这样的观点,即进化发育越早,越低级,越邻近低级中枢的结构,其个体空间变异与年龄相关性越小。另外,有人提出使用手语的聋哑人,其左后岛叶叶灰质显著增加[15]。Mueller等[16]对成年社交焦虑障碍患者灰质体积的研究发现,患者岛叶灰质体积显著增加。还有研究表明,述情障碍患者岛叶灰质体积及功能有所减少[7]。Scottd等[17]研究提示,岛叶腹前核、腹中核的体积缩小与厌恶情绪识别下降有相关性。表明人出生后岛叶皮质的形态学参数差异代表着岛叶多感觉功能,而与出生后年龄无关,此类参数不能作为岛叶发育评估指标。
一般认为,脑沟增宽是由于脑萎缩,脑萎缩分为生理性萎缩和病理性萎缩[18]。随年龄增长,脑细胞数量和体积的减少,继而表现为脑沟增宽[19]。因此,部分脑沟的宽度在影像学上可以用作评估大脑发育及萎缩程度。本研究结果显示岛叶脑沟宽度在各年龄组间差异无统计学意义。这可能是由于岛叶脑沟处于大脑深部,深部神经元出生前即发生髓鞘化,不同构筑细胞由于功能差异被脑沟分隔开,脑沟代表的是岛叶功能分区,而与年龄并无直接关系,故岛叶脑沟不可以作为影像学诊断脑萎缩的指标。这一点也进一步说明了岛叶是属于中间皮质的旁边缘结构部分之一,解剖和功能上介于旧皮质与新皮质之间,在大脑的演化中属于较低级的部分。
[1] Uchida R,DelBen C,Busatto G,et al. Regional gray matter abnormalities in panic disorder:a voxel-based morphometric study[J]. Psychiat Res,2008,163(1):21-29.
[2] De Raedt S,De Vos A,De Keyser J,et al. Autonomic dysfunction in acute ischemic stroke:an underexplored therapeutic area[J]. J Neuro Sci,2015,348(1/2):24-34.
[3] 童宣霞.临床上常用脑萎缩评定方法及其进展[J].国际神经病学神经外科学杂志,2015,42(5):459-462.
[4] Yokoo T,Serai A,Pirasteh M,等.MR成像肝质子密度脂肪分数测量的线性、偏倚和精度:Meta分析[J].国际医学放射学杂志,2018,41(2):225-226.
[5] Mohr PN,Bielg L,Heekeren HR,et al. Neural processing of risk[J]. J Neurosci,2010,19(19):6613-6619.
[6] Kurth F,Zilles K,Fox PT,et al.A link between the systems:functional differentiation and integration within the human insula revealed by meta-analysis[J]. Brain Struct Funct,2010,214(5/6):519-534.
[7] Goerlich D,Keven S,Bruce L,et al. Distinct associations of insula and cingulate volume with the cognitive and affective dimensions of alexithymia[J].Neuropsychologia,2014,292(53):284-292.
[8] Stephani C,Fernandez B,Vaca G,et al. Functional neuroanatomy of the insular lobe[J]. Brain Struct Funct,2011,216(2):137-149.
[9] Melanie R,Jonathan C,Naghmeh L,et al. mRNA expression of transient receptor potential melastatin (TRPM) channels 2 and 7 in perinatal brain development[J]. Int J Dev Neuro Sci,2018,69(2):23-31.
[10] 田慧.胎儿期环境因素对脑发育的影响[J].世界最新医学信息摘,2018,18(82):291-296.
[11] Faillenot L,Rolf A,Maud F,et al. Macroanatomy and 3D probabilistic atlas of the human insula[J]. Neuroimage,2017,150:88-98.
[12] Jaya K,Vandana P,Sonia B,et al. Morphological and morphometric study of insular cortex in human cadaveric brains[J]. Ori Res Art,2018,42(5):2394-2426.
[13] Lemieux L,Hammers A,Mackinnon T,et al. Automatic segmentation of the brain and intracranial cerebrospinal fluid T1-weighted volume MRI scans of the head[J]. Medical,2010,214(49):872-884.
[14] Anderson K,Bones B,Robinson B,et al. The morphology of supragranular pyramidal neurons in the human insular cortex:a quantitative Golgi study[J].Cerebral Cortex,2009,19(9):67-69.
[15] Wang S,Liu J,Tian L,et al. Increased insular cortical thickness associated with symptom severity in male youths with internet gaming disorder:a surface-based morphometric study[J]. Front Psychiatry,2018,9(12):37-56.
[16] Mueller SC,Aouidad A,Gorodetsky E,et al. Gray matter volume in adolescent anxiety:an impact of the brain-derivedneurotrophic factor val met polymorphism[J]. J Am Acad Child Adolesc Psychiatry,2013,52(2):184-195.
[17] Scottd M,Hiroi L,Lufrd R,et al. Deconstructing craving:dissociable cortical control of cue reactivity in nicotine addiction[J]. Biol Psychiatry,2011,11(11):1052-1059.
[18] 龙慧.脑萎缩伴随精神障碍的老年患者的头颅CT检查影像学征象分析[J].影像研究与医学应用,2018,2(20):53-54.
[19] 窦霞,马雪鹏.成人脑白质病的影像诊断分析[J].世界最新医学信息文摘,2016,16(27):158.