心肌缺血再灌注损伤(myocardial ischemia-reperfusion injury,MIRI)指心肌缺血重新恢复血液灌注后使心肌超微结构、功能、代谢和电生理进一步受损,造成心肌细胞不可逆转的损害,其主要临床表现包括心肌酶学改变、血压突然下降、心律失常等[1-2]。MIRI的发生受到多种因素的影响,其中心肌细胞自身分子调控机制是心肌细胞在缺血再灌注反应过程中的重要一环,与患者心肌损伤程度及预后密切相关,是预防和治疗MIRI的重要环节,但是目前对MIRI起始和进展阶段的分子调控机制还不明确,严重制约着其应用[3]。因此,充分了解MIRI发生的分子机制,可以为MIRI的预防及治疗找到新的途径。c-Jun氨基末端激酶(c-Jun N-terminal kinases,JNKs)是有丝分裂激活蛋白激酶家族的重要成员,包括由3个基因编码的异形体:JNK1、JNK2和JNK3。其中JNK1和JNK2存在于机体所有细胞和组织中,JNK3主要存在于心脏、大脑和睾丸中,当机体受到外界异常刺激时被激活,如紫外线辐射、氧化应激、热和渗透冲击等[4-5]。有研究发现JNKs家族在大脑和心肌再灌注损伤中异常表达,且与疾病的发展密切相关[4,6]。本研究选取心肌缺血再灌注损伤患者75例,检测其外周血中JNK3 mRNA的表达量,比较不同临床病理组外周血中JNK3 mRNA的高表达率,报告如下。
1 资料与方法
1.1 一般资料 选取2015年2月—2017年12月于河北省沧州市中心医院和河北省石家庄市第一医院因创伤和心肌梗死接受治疗的心肌缺血再灌注损伤患者75例,获取患者外周血液样本。以年龄分为≥50岁组和<50岁组;以是否发生再灌注性心律失常分为心律失常和无心律失常组;以心肌酶学任意1项高出心肌缺血时1倍以上分为异常升高组和无升高组。比较不同性别、年龄、再灌注性心律失常、心肌酶学升高组JNK3 mRNA的表达情况。
1.2 方法 采用实时荧光定量聚合酶链反应(polymerase chain reaction,PCR)法分析心肌缺血再灌注损伤患者外周静脉血中JNK3 mRNA的表达。抽取外周静脉血5 mL,离心分离血清,取血清200 μL加入Trizol充分进行裂解,得到血清总RNA。然后应用含有异丙醇、焦碳酸二乙酯水及氯仿的乙醇配制液和硅胶膜对RNA进行分离及纯化,检测RNA的紫外吸收值确定RNA的纯度和浓度。应用Primer5.0软件进行JNK3的引物设计,并通过Blast软件进行引物正确性验证。所得RT-PCR扩增引物序列:5′-GATGACTCCGTATGTG-GTG-3′and 5′-GCTGGCTTTAAGTTTATTGT-3′;内参GAPDH序列:5′-CAAGGTCATCCATG-ACAACTTTG-3′and 5′-GTCCACCACCCTGTT-GCTGTAG-3′;PCR反应条件:预变性95 ℃ 30 s,扩增95 ℃ 5 s、60 ℃ 30 s,45个循环,收集30 s末荧光信号。PCR实验基因表达值按照以下方式计算:△Ct=Ct待测基因-Ct参照基因,基因相对表达值=2-△Ct。
1.3 统计学方法 应用SPSS 13.0统计软件分析数据。计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
年龄<50岁组JNK3 mRNA高表达率高于年龄≥50岁组,再灌注性心律失常组JNK3 mRNA高表达率高于无心律失常组,心肌酶学异常升高组JNK3 mRNA高表达率高于无高异常升高组,差异均有统计学意义(P<0.05);不同性别间JNK3 mRNA高表达率差异无统计学意义(P>0.05)。见表1。
表1 不同临床病理因素心肌缺血再灌注损伤患者JNK3 mRNA高表达率比较
Table 1 Comparison of the high expression rate of JNK3 mRNA in patients with myocardial ischemia-reperfusion injury from different clinical and pathological factors (例数,%)
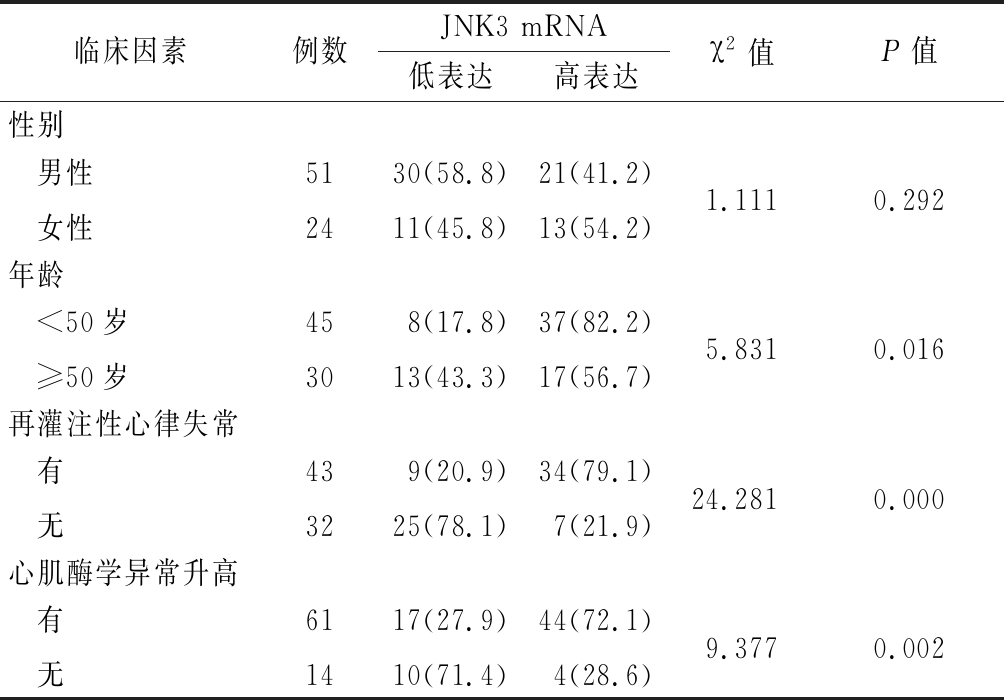
临床因素例数JNK3 mRNA低表达高表达χ2值P值性别 男性 女性512430(58.8)11(45.8)21(41.2)13(54.2)1.1110.292年龄 <50岁 ≥50岁45308(17.8)13(43.3)37(82.2)17(56.7)5.8310.016再灌注性心律失常 有 无43329(20.9)25(78.1)34(79.1)7(21.9)24.2810.000心肌酶学异常升高 有 无611417(27.9)10(71.4)44(72.1)4(28.6)9.3770.002
3 讨 论
机体所有组织器官的正常形态结构、功能及代谢,均需要充足的血液灌注加以维持,当机体某个器官的血液灌注相对或绝对不足时,其生理功能及代谢就会出现紊乱,严重时甚至会出现形态结构的损害。当这种缺血性损伤出现在机体重要器官时,将会给整个机体带来严重的损害。心脏作为机体重要器官之一,其缺血性疾病已经成为了威胁人类生命健康的重要疾病之一。
在治疗心脏缺血性疾病的过程中,迅速恢复心肌血液灌注是最首要的任务,恢复心肌血液灌注后可迅速改善心肌的缺氧状态,从而阻止心肌缺血性损伤的进一步加重,并促进受损心肌细胞功能的恢复。大量临床证据表明,在多数情况下心肌恢复再灌注后患者可以获得较好的临床效果。但随着人们对心肌再灌注认识的逐渐深入,发现在急性心肌梗死患者中,恢复心脏正常血液灌注后患者病情并未缓解,有些患者甚至出现恶性心律失常及心肌酶学异常升高,已经成为了急性心肌梗死患者致死的重要因素。这种致命的再灌注损伤可导致心肌细胞大量死亡,释放出可激活自身免疫系统的可溶性因子,形成非收缩性纤维化瘢痕,导致心肌发生严重的功能障碍,从而使患者病情恶化及预后不良[7-8]。因此,深入了解心肌缺血再灌注损伤的发病机制,寻找有效治疗手段对心肌缺血再灌注损伤患者有着重要的意义。
现阶段有关心肌缺血再灌注损伤的研究取得了巨大的进展。在心肌和脑这样的高耗氧组织中Sirt3表达明显高于其他组织器官,考虑Sirt3为心肌和脑组织的保护性机制。进一步建立心肌缺血再灌注损伤动物模型进行验证,发现在受损的心肌细胞中Sirt3表达明显降低,3-溴-4,5-二羟基苯甲醛可以通过激活Akt/PGC1α/Sirt3途径增加心肌细胞中Sirt3表达量,并减少心肌细胞的凋亡[9]。表明Sirt3在心肌细胞中作为保护性基因存在,在心肌细胞损伤过程中其表达受到抑制,使损伤加重。TLR4(Toll-like receptor 4)是TLR家族中新近发现的重要成员,可以通过识别和结合多个内源性、外源性配体发挥免疫防御和免疫调节作用,核因子κB是一种作用广泛转录因子,可以结合许多基因的启动子和增强子,从而参与多种细胞的生物过程,如炎症、免疫反应、造血、细胞增殖和凋亡。研究发现,TLR4可以激活转录因子核因子κB,使其转移到细胞核中,作用于肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)和白细胞介素6等炎症基因,使其信号通路激活,从而加重心肌细胞炎症损伤,诱导心肌细胞凋亡,TLR4是心肌细胞损伤过程中重要的促进因素,其过表达提示心肌损伤预后不良[3]。甲酰肽受体(formyl peptide receptor 1,FPR1) 是G蛋白偶联模式识别受体家族的成员之一,主要存在于哺乳动物的吞噬细胞中,是组织炎症损伤的主要诱因,FPR1在心肌缺血再灌注损伤的心肌细胞中异常高表达,其可通过激活MAPK信号通路发挥作用。在大鼠的心肌细胞中抑制 FPR1基因表达,可明显降低大鼠心肌缺血再灌注损伤的程度、降低大鼠心肌缺血再灌注损伤时心肌的纤维化、减少大鼠心肌缺血再灌注损伤时心肌的梗死面积、抑制大鼠心肌缺血再灌注损伤时心肌细胞的凋亡[10]。表明FPR1过表达促进了心肌缺血再灌注损伤的进程,可能是心肌缺血再灌注损伤发生的重要因素之一;磷脂酰肌醇 3-激酶(phosphoinositide 3-kinase,PI3K)/蛋白激酶B (protein kinase B,PKB) 途径在细胞的生长、增殖和新陈代谢过程中发挥着重要作用。在心肌缺血再灌注损伤过程中PI3K/PKB信号通路可以被激活,使细胞自噬的关键调节器雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)磷酸化,磷酸化的mTOR可以通过减少心肌细胞自噬减轻心肌细胞在缺血再灌注过程中的损伤。研究结果表明,PI3K/PKB信号通路被激活后可以有效减轻缺血再灌注对心肌的损伤[11];核因子E2相关因子2(nuclear factor E2-related factor 2,Nrf2)是细胞抗氧化反应中调节细胞氧化还原反应的主转录因子,其可以被凯尔赫样环氧氯丙烷相关蛋白1负向调节,在心肌缺血再灌注损伤过程中此信号通路的激活可以抑制组蛋白赖氨酸甲基转移酶7表达,从而减轻心肌细胞的损伤[12-14]。转录因子Nrf2在心肌缺血再灌注过程中可以被激活,对心肌细胞进行保护,但其被激活后是否可以避免心肌缺血再灌注损伤的发生需要进一步研究证实。近年来LncRNA 的功能逐渐被人们所重视,随着对其功能的研究逐渐深入,发现LncRNA在细胞的增殖、凋亡等生理活动中发挥着重要作用。长链非编码RNA-AK139328(LncRNA AK139328)可以通过负向调控miR-204-3p表达在心肌缺血再灌注损伤过程中发挥重要作用。在心肌缺血再灌注损伤过程中可以通过抑制LncRNA AK139328增加miR-204-3p表达,从而抑制心肌细胞自噬,减轻心肌细胞的损伤[15]。以上研究结果表明,在心肌缺血再灌注损伤发生发展过程中受到多种分子途径的影响,为心肌缺血再灌注损伤的诊断及治疗提供了一定的分子生物学基础。但是目前针对心肌缺血再灌注损伤仍不能确定一个能够有效治疗、预防及评估预后的分子靶标。
JNKs属于有丝分裂激活蛋白激酶家族成员,其包括由3个基因编码的10个异形体。JNKs在炎症调节、细胞凋亡等过程中起着重要作用。JNKs可以通过双磷酸化JNK上酪氨酸和苏氨酸位点激活,从而参与胚胎时期心肌的发育、代谢调节过程,同时JNKs在机体免疫功能调节、基因表达、细胞存活等过程中发挥着重要作用[4]。JNKs在多种疾病的进展过程中表达异常升高,并且与疾病预后不良密切相关,如动脉粥样硬化、大脑缺血再灌注损伤、老年痴呆症、中风和帕金森症等[6]。同时在组织器官缺血再灌注损伤的发生过程中也观察到了JNKs家族成员的异常表达,其表达水平与组织器官缺血再灌损伤程度相关,说明JNKs家族异常表达与组织器官缺血再灌注损伤的发生发展有着密切关系[4,6]。
针对目前的研究现状,本研究通过实验筛选与心肌缺血再灌注损伤密切相关的分子标志物,最终发现在心肌缺血再灌注损伤的患者中JNK3 mRNA表达上调,并且观察到在心肌缺血再灌注损伤中JNK3 mRNA过表达可明显增加患者再灌注性心律失常的发生率和促进患者心肌酶的异常升高。
本研究通过因创伤和心肌梗死接受治疗的心肌缺血再灌注损伤患者为研究对象,对患者血清JNK3 mRNA表达进行检测,检测结果结合患者再灌注性心律失常的发生率及心肌酶变化情况进行综合分析,结果证实JNK3过表达可以促进心肌缺血再灌注损伤的发展,JNK3 mRNA表达水平与患者病情轻重及预后密切相关。 那么,是否可以通过JNK3这个分子靶点对心肌缺血再灌注损伤进行预防和治疗?这将是下一步的研究目标。目前这些研究结果可以部分解释心肌缺血再灌注损伤过程中的分子机制,并为心肌缺血再灌注损伤的预防和治疗提供一定的线索。
[1] 孟利敏,谭雪敏,张翼.柑橘素抗心肌缺血/再灌注损伤研究进展[J].河北医科大学学报,2017,38(12):1470-1475.
[2] Zhang P,Liu X,Huang G,et al. Barbaloin pretreatment attenuates myocardial ischemia-reperfusion injury via activation of AMPK[J]. Biochem Biophys Res Commun,2017,490(4):1215-1220.
[3] Yuan L,Dai X,Fu H,et al. Vaspin protects rats against myocardial ischemia/reperfusion injury(MIRI) through the TLR4/NF-κB signaling pathway[J]. Eur J Pharmacol,2018,835:132-139.
[4] Shvedova M,Anfinogenova Y,Atochina-Vasserman EN,et al. c-Jun N-Terminal Kinases(JNKs) in myocardial and cerebral ischemia/reperfusion injury[J]. Front Pharmacol,2018,9:715.
[5] Luo F,Shi J,Shi Q,et al. Mitogen-activated protein kinases and hypoxic/ischemic nephropathy[J]. Cell Physiol Biochem,2016,39(3):1051-1067.
[6] Yao B,Wang S,Xiao P,et al. MAPK signaling pathways in eye wounds:multifunction and cooperation[J]. Exp Cell Res,2017,359(1):10-16.
[7] Lefort C,Benoist L,Chadet S,et al. Stimulation of P2Y11 receptor modulates cardiac fibroblasts secretome toward immunomodulatory and protective roles after Hypoxia/Reoxygenation injury[J]. J Mol Cell Cardiol,2018,121:212-222.
[8] Boag SE,Das R,Shmeleva EV,et al. T lymphocytes and fractalkine contribute to myocardial ischemia/reperfusion injury in patients[J]. J Clin Invest,2015,125(8):3063-3076.
[9] Qin SG,Tian HY,Wei J,et al. 3-Bromo-4,5-dihydroxybenzaldehyde protects against myocardial ischemia and reperfusion injury through the Akt-PGC1α-Sirt3 pathway[J]. Front Pharmacol,2018,9:722.
[10] Zhou QL,Teng F,Zhang YS,et al. FPR1 gene silencing suppresses cardiomyocyte apoptosis and ventricular remodeling in rats with ischemia/reperfusion injury through the inhibition of MAPK signaling pathway[J]. Exp Cell Res,2018,370(2):506-518.
[11] Li X,Hu X,Wang J,et al. Inhibition of autophagy via activation of PI3K/Akt/mTOR pathway contributes to the protection of hesperidin against myocardial ischemia/reperfusion injury[J]. Int J Mol Med,2018,42(4):1917-1924.
[12] Dang Y,Ma X,Li Y,et al. Inhibition of SETD7 protects cardiomyocytes against hypoxia/reoxygenation-induced injury through regulating Keap1/Nrf2 signaling[J]. Biomed Pharmacother,2018,106:842-849.
[13] Oudhoff MJ,Braam MJS,Freeman SA,et al. SETD7 controls intestinal regeneration and tumorigenesis by regulating Wnt/β-catenin and hippo/YAP signaling[J]. Dev Cell,2016,37(1):47-57.
[14] Chen Y,Yang S,Hu J,et al. Increased expression of SETD7 promotes cell proliferation by regulating cell cycle and indicates poor prognosis in hepatocellular carcinoma[J]. PLoS One,2016,11(5):e0154939.
[15] Yu SY,Dong B,Fang ZF,et al. Knockdown of lncRNA AK139328 alleviates myocardial ischaemia/reperfusion injury in diabetic mice via modulating miR-204-3p and inhibiting autophagy[J]. J Cell Mol Med,2018,22(10):4886-4898.