目前肺癌以高发病率和高病死率居恶性肿瘤之首[1]。研究发现,肺癌的发生发展与肿瘤细胞逃避机体免疫监视有关。在生理状态下免疫系统能够清除早中期肿瘤细胞及突变细胞。多项研究表明,自然杀伤(natural killer,NK)细胞在杀伤肿瘤细胞的过程中起到了主要作用。因此,肿瘤患者外周血中NK细胞数量及受体的表达也会发生变化。 NK细胞表面具有两类功能相反的受体即可激发NK细胞产生杀伤作用的杀伤细胞活化性受体,包括NKG2D和自然细胞毒性受体(natural cytotoxicity receptor,NCR),NCR包括NKp30、NKp44、NKp46,抑制NK细胞杀伤功能的杀伤细胞抑制性受体包括CD158a、CD158b、CD158e。肿瘤细胞通过改变NK细胞受体或配体的表达,从而影响抑制受体与活化受体间的平衡,抑制活化受体的表达,促进抑制受体的表达[2],削弱NK细胞对肿瘤细胞的免疫监视及清除作用。本研究通过检测非小细胞肺癌治疗前后及健康组外周血中NK细胞受体,了解非小细胞肺癌Ⅰ~ⅢA期和ⅢB~Ⅳ期NK受体表达的差异性,以及化疗后NK细胞表达,并进行化疗后疗效评价。
1 资料与方法
1.1 一般资料 选取2018年5月—2019年3月河北省胸科医院收治的非小细胞肺癌患者50例,根据分期分为Ⅰ~ⅢA期组25例和ⅢB~Ⅳ期组25例。Ⅰ~ⅢA期组男性12例,女性13例,年龄47~81岁,平均(65±11)岁;鳞癌10例,腺癌15例。ⅢB~Ⅳ期组男性12例,女性13例,年龄47~83岁,平均(64±10)岁;鳞癌10例,腺癌15例。入选标准:①符合原发性非小细胞肺癌的诊断标准;②经病理学及免疫组织化学确诊,且EGFR检测敏感基因阴性;③治疗前抽取患者外周血进行NK细胞表达水平检测;④美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)体力状态评分0~2分;⑤无其他严重的呼吸系统疾病。排除标准:①合并急慢性感染;②合并自身免疫性疾病;③转移性肺癌或伴有其他肿瘤;④ECOG体力状态评分>3分。另选择同期健康体检者10例作为对照组,男性5例,女性5例,年龄38~70岁,平均(55±13)岁。
1.2 主要试剂和仪器 CD3-FITC、CD56-ECD、CD16-PC5、NKG2D-PE、NKp30-PC5、NKp44-PC5、NKp46-PE、CD158a-PE、CD158b-PE、CD158e-PE抗体及流式细胞仪(型号:Epics XL)均购自美国贝克曼库尔特公司。
1.3 方法
1.3.1 样本采集 采集入选者清晨空腹静脉血20 mL,采用EDTA-K2试管,2 h内送至实验室进行检测。
1.3.2 流式细胞术检测NK细胞受体表达 分别在流式上样管中加入CD3-FITC 20 μL、CD56-ECD 10 μL、CD16-PC5 10 μL、NKG2D-PE 20 μL、NKp30-PC5 10 μL、NKp44-PC5 10 μL、NKp46-PE 20 μL、CD158a-PE 20 μL、CD158b-PE 20 μL、CD158e-PE 20 μL,每管加入全血100 μL,振荡充分混匀后,常温避光孵育15 min,加入溶血素500 μL,混匀后静置10 min,加入等量PBC,静置10 min,上流式细胞仪进行检测。
1.3.3 化疗方案 腺癌:培美曲塞 0.8 g/m2(第1天)+顺铂75 mg/m2(第2~4天)。鳞癌:紫杉醇脂质体 135~175 mg/m2(第1天)+顺铂 75 mg/m2(第2~4天)。
1.3.4 疗效评价 应用2个周期化疗后进行评效:完全缓解(complete remission CR),所有病灶消失,至少维持4周;部分缓解(partial remission,PR),靶病灶最长径之和与基线病灶相比,至少缩小30%;进展(progressive disease PD),基线病灶长径总和增加超过20%或出现一个或多个新发病灶;稳定(stable disease,SD),基线病灶长径总和有缩小但未达PR或有增加但未达PD。
1.4 统计学方法 应用SPSS 26.0统计软件分析数据。计量资料比较分别采用F检验、SNK-q检验和配对t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 3组活化性受体NKG2D、NKp30、NKp44、NKp46表达比较 非小细胞肺癌ⅢB~Ⅳ期患者CD56dim活化性受体NKG2D、NKp30表达均低于健康体检者和Ⅰ~ⅢA期患者,非小细胞肺癌Ⅰ~ⅢA期和ⅢB~Ⅳ期CD56dim活化性受体NKp44表达均低于健康体检者(P<0.05);3组CD56dim活化性受体NKp46差异无统计学意义(P>0.05)。3组CD56bright活化性受体NKG2D、NKp30、NKp44、NKp46差异均无统计学意义(P>0.05)。见表1,2。
表1 3组CD56dim活化性受体表达比较
Table 1 Comparison of the expression frequency of CD56dim activating receptors in different stages![]()
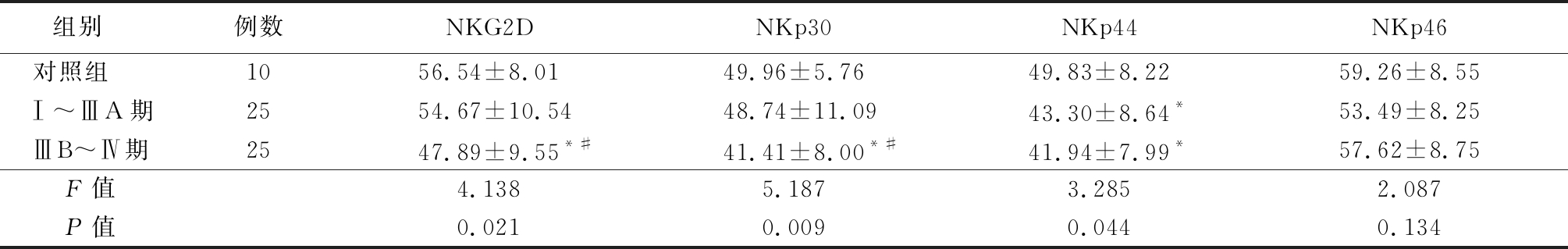
组别 例数NKG2DNKp30NKp44NKp46对照组 1056.54±8.0149.96±5.7649.83±8.2259.26±8.55Ⅰ~ⅢA期2554.67±10.5448.74±11.0943.30±8.64*53.49±8.25ⅢB~Ⅳ期2547.89±9.55*#41.41±8.00*#41.94±7.99*57.62±8.75F值4.138 5.1873.2852.087P值0.0210.0090.0440.134
*P值<0.05与对照组比较 #P值<0.05与Ⅰ~ⅢA期比较(SNK-q检验)
表2 3组CD56bright活化性受体表达比较
Table 2 Comparison of the expression frequency of CD56bright activating receptors in different stages![]()
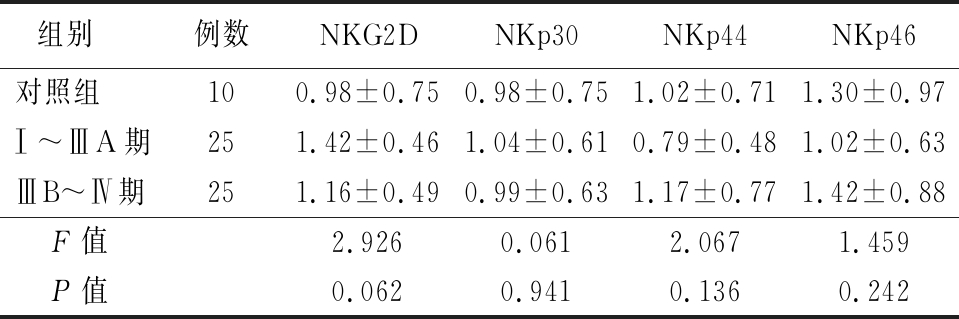
组别 例数NKG2DNKp30NKp44NKp46对照组 100.98±0.750.98±0.751.02±0.711.30±0.97Ⅰ~ⅢA期251.42±0.461.04±0.610.79±0.481.02±0.63ⅢB~Ⅳ期251.16±0.490.99±0.631.17±0.771.42±0.88F值2.9260.0612.0671.459P值0.0620.9410.1360.242
2.2 3组抑制性受体CD158a、CD158b、CD158e表达比较 3组CD56dim抑制性受体CD158a、CD158b、CD158e及 CD56bright抑制性受体CD158a、CD158b、CD158e差异均无统计学意义(P>0.05),见表3,4。
表3 3组CD56dim抑制性受体表达比较
Table 3 Comparison of the expression frequency of CD56dim inhabiting receptors in different stages![]()

组别 例数CD56dim158aCD56dim158bCD56dim158e对照组 107.59±4.5412.94±7.415.92±3.98Ⅰ~ⅢA期256.07±3.5211.96±8.233.78±2.19ⅢB~Ⅳ期257.05±5.6411.25±6.543.89±2.02F值0.4350.1852.786P值0.6500.8310.071
表4 3组CD56bright抑制性受体表达比较
Table 4 Comparison of the expression frequency of CD56bright inhabiting receptors in different stages![]()

组别 例数CD56bright158aCD56bright158bCD56bright158e对照组 100.70±0.470.25±0.180.30±0.29Ⅰ~ⅢA期250.43±0.350.60±0.420.16±0.56ⅢB~Ⅳ期250.39±0.290.50±0.390.19±0.15F值2.8612.9452.749P值0.0660.0610.073
2.3 非小细胞肺癌ⅢB~Ⅳ期患者化疗2个周期后NK活化性受体及抑制性受体表达比较 因入组人员缺失,ⅢB~Ⅳ期化疗2个周期后患者入组14例。化疗后非小细胞肺癌ⅢB~Ⅳ期患者CD56dim活化性受体NKp30、NKp44表达高于化疗前(P<0.05)。化疗后CD56dim活化性受体NKp46、NKG2D及抑制性受体CD158a、CD158b、CD158e与化疗前差异均无统计学意义(P>0.05);化疗后CD56brigh活化性受体NKp30、NKp44、NKp46、NKG2D及抑制性受体CD158a、CD158b、CD158e与化疗前差异均无统计学意义(P>0.05)。见表5,6。
表5 ⅢB~Ⅳ期患者2个周期化疗后CD56dimNK受体表达变化
Table 5 Changes of CD56dimNK receptor expression in patients with stage ⅢB-Ⅳ after 2 cycles of chemotherapy![]()
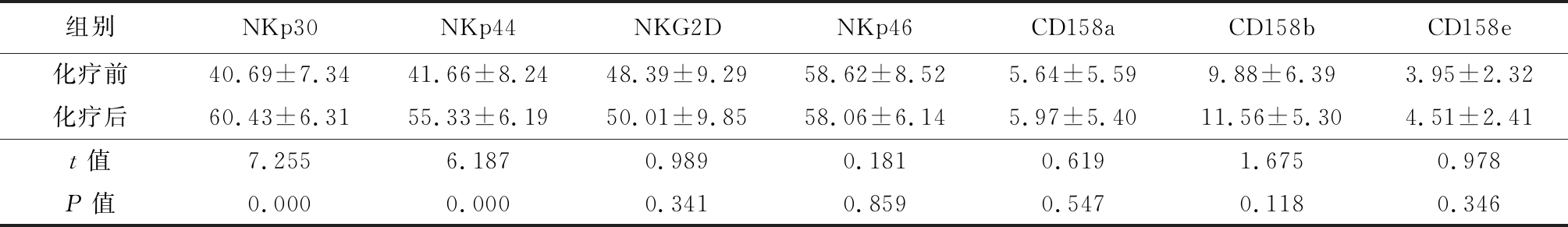
组别NKp30NKp44NKG2DNKp46CD158aCD158bCD158e化疗前40.69±7.3441.66±8.2448.39±9.2958.62±8.525.64±5.599.88±6.393.95±2.32化疗后60.43±6.3155.33±6.1950.01±9.8558.06±6.145.97±5.4011.56±5.304.51±2.41t值7.2556.1870.9890.1810.6191.6750.978P值0.0000.0000.3410.8590.5470.1180.346
表6 ⅢB~Ⅳ期患者2个周期化疗后CD56brightNK受体表达变化
Table 6 Changes of CD56brightNK receptor expression in patients with stage ⅢB-Ⅳ after 2 cycles of chemotherapy![]()
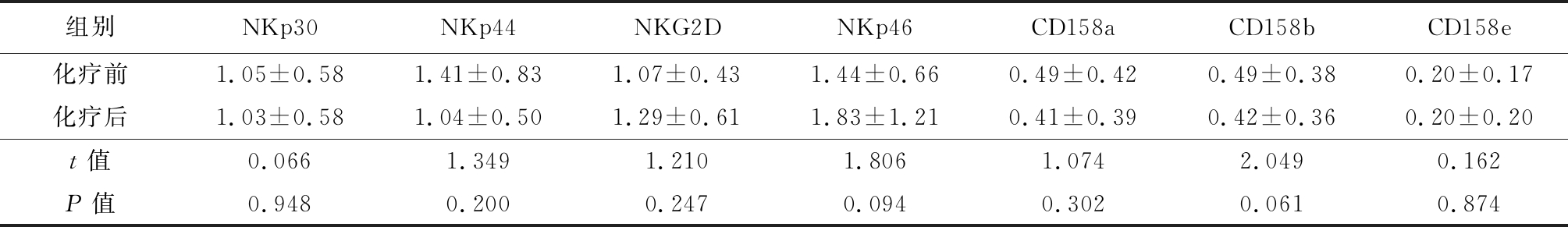
组别NKp30NKp44NKG2DNKp46CD158aCD158bCD158e化疗前1.05±0.581.41±0.831.07±0.431.44±0.660.49±0.420.49±0.380.20±0.17化疗后1.03±0.581.04±0.501.29±0.611.83±1.210.41±0.390.42±0.360.20±0.20t值0.0661.3491.2101.8061.0742.0490.162P值0.9480.2000.2470.0940.3020.0610.874
2.4 疗效评价 ⅢB~Ⅳ期化疗2个周期后14例患者中评效为PR 11例,PD 3例,ⅢB~Ⅳ期患者2周期化疗后PR率达78.5%(11/14)。
3 讨 论
肺癌是最常见的恶性肿瘤之一,其中以非小细胞肺癌为主,占肺癌总类型的75%~80%,5年生存率仅19.3%[3]。初期症状不典型,绝大部分确诊后属于ⅢB~Ⅳ期,手术机会小,临床上根据患者具体病情虽可进行放化疗、靶向治疗、免疫治疗及联合治疗等,但随着病情进展,后期耐药性增加,预后较差。机体内存在对抗肿瘤细胞的细胞免疫系统,有效的免疫应答可能清除肿瘤细胞;但在肺癌患者中,肿瘤细胞通过产生活性氮中间产物及活性氧使得周边间质上皮细胞发生恶性转化,或通过分泌多种细胞因子使得抑制性信号通路激活,最终导致免疫细胞耐受[4],肿瘤得以在体内进行扩增及转移。
在机体中发挥作用的免疫细胞主要包括T细胞、B细胞、NK细胞,其中NK细胞是人体抗肿瘤的第一道防线[5]。NK细胞按功能不同分为活化性受体和抑制性受体。活化性受体包括NKG2D、NCR类(NKp30、NKp44和NKp46);抑制性受体包括CD158a、CD158b、CD158e,其可特异性识别、结合HLA类分子,进而有效防止NK细胞对自身正常细胞进行攻击。
NK细胞的活化是由活化性受体和抑制受体精细调整整合后引发的。正常情况下,NK细胞处于静息状态,NK活化性受体与抑制性受体之间保持平衡,但当正常细胞突变为癌细胞时,在一定程度上会导致肿瘤细胞表面主要组织相容性复合体(major histocompatibility complex,MHC)Ⅰ 类分子的表达下降,NK细胞抑制性信号表达减少,NK细胞得以活化,从而发挥对肿瘤的杀伤作用[6-7]。当肿瘤细胞表达MHCⅠ类分子时,NK细胞可以通过NK活化性受体的上调,激活NK细胞,进而发挥杀伤作用;NK细胞还可以通过诱导各种细胞因子和趋化因子的释放,主要包括肿瘤坏死因子、干扰素等,发挥免疫调节及杀伤靶细胞作用。
通常NK细胞以CD3-CD56+表达,并按其表面CD56受体强度表达不同进一步分为2组亚群,即CD56dim和CD56bright组[8],外周血中以CD56dim为主(~95%),表达高水平的低亲和力Fcγ受体CD16,通过它们可以发挥抗体依赖性细胞介导的细胞毒性,即CD56dim主要发挥细胞毒性作用;而在外周血中占少部分的CD56bright(~5%)细胞的细胞毒性很差,主要存在于组织和次级淋巴器官中,具有分泌细胞因子的作用[9-10],通过产生细胞因子如IL-12、IL-18、IL-15等发挥抗肿瘤效应。目前尚无明确机制说明,CD56bright是CD56dim NK的细胞亚群或是CD56dim NK细胞的前体,或者CD56bright是否代表激活或分化的CD56dim NK细胞亚型。
既往研究主要针对肺癌患者外周血中NK细胞总的表达百分比进行统计,Aldarouish等[11]将ⅢB~Ⅳ期非小细胞肺癌患者外周血中免疫细胞包括T细胞、B细胞及NK细胞化疗前后进行比较发现,ⅢB~Ⅳ期患者外周血中NK细胞表达较健康对照组比例降低,化疗后ⅢB~Ⅳ期患者NK细胞总数目较治疗前降低。NK细胞中包含NK活化性受体及NK抑制性受体,2种受体在肿瘤中表达不同以及CD56表达强度不同,功能作用亦有不同。本研究将NK细胞按活化性受体、抑制性受体分别进行统计,并按CD56表达强度不同进行分析,探讨NK细胞CD56dim及CD56bright不同亚群受体表达变化,结果显示非小细胞肺癌ⅢB~Ⅳ期患者NK细胞CD56dim活化性受体NKG2D、NKp30均低于健康体检者,化疗后ⅢB~Ⅳ期患者活化性受体NKp30及NKp44表达水平均高于化疗前。与上述NK细胞在化疗后表达降低存在差异,可能与既往研究主要纳入Ⅳ期患者免疫应答能力低下有关,化疗后NK细胞处于抑制状态。本研究活化性受体比例在化疗后比例回升,且化疗后患者PR率达78.5%(11/14),可能是化疗后机体的NK细胞活化性受体活性在化疗药物作用下在一定程度上有所恢复,进而发挥抗肿瘤效应。
Picard等[12]发现在非小细胞肺癌中CD56dimCD16+细胞毒性低于健康对照组,CD56brightNK细胞与健康对照组差异无统计学意义,CD56brightNKG2D细胞在非小细胞肺癌中比例升高,而NKp30、NKp44在非小细胞肺癌与健康对照组差异无统计学意义,无论哪种亚群的NKp46在非小细胞肺癌表达低于健康对照组。本研究ⅢB~Ⅳ期NKp30及NKp44均较健康体检者降低、NKp46各组间未见明显不同的结果与上述研究存在差异,可能与其并未按肺癌分期进行组间比较有关。
本研究中ⅢB~Ⅳ期肺癌患者CD56dim活化性受体NKG2D、NKp30均低于健康对照组,与Han等[13]的研究发现,在胃癌患者中活化性受体NKp30、NKp46、NKG2D的表达均明显低于健康对照组结果存在一致性;本研究中CD56dim活化性受体NKp44Ⅰ~ⅢA期及ⅢB~Ⅳ期均较健康体检者表达降低,而NKp44在胃癌患者与健康体检者间差异并无统计学意义。Nieto-Velázquez 等[14]对乳腺癌的研究发现,CD56dimNKp44细胞在乳腺癌患者中表达高于健康对照组,CD56dimNKp30、NKG2D表达低于健康对照组;CD56brightNKp30、NKp46、NKG2D表达也低于健康对照组。本研究结果显示,3组CD56bright活化性受体NKp30、NKp46、NKG2D差异均无统计学意义。张爱民等[15]在肝癌研究中发现,CD56dimNK细胞的活化性受体 NKG2D、NKp30表达在肝癌组高于肝硬化组。既往研究发现,NK细胞在化疗后百分比高于化疗前,而且病理分级不同对化疗的敏感性亦不相同[16-17],但其研究并未按NK细胞亚群进行具体分析。
综上所述,NK细胞的活化与NK活化性受体和抑制性受体间信号整合相关。ⅢB~Ⅳ期肿瘤患者外周血中CD56dim活化性受体表达降低,表明NK细胞的细胞毒性作用和释放细胞因子功能失衡与NK细胞活化性受体下调有关,使得肿瘤细胞逃离机体的免疫监视作用,进而引起肿瘤细胞扩增及转移。经2个周期化疗后疗效评价达PR的患者NK活化性受体NKp30、NKp44表达升高,表明化疗后可能使得机体自身NK细胞活性提高,从而发挥NK细胞对肿瘤细胞的杀伤作用,故推测化疗有可能在改善患者的免疫微环境,这对既往研究中化疗对免疫系统的抑制作用有了新的理解,化疗在抑制免疫细胞活性的同时,部分活化性受体表达有所回升。
[1] 杜媛鲲,米源,陈阁,等.Gli通过PI3K/AKT途径促进肺腺癌A549细胞侵袭转移的研究[J].河北医科大学学报,2018,39(1):24-28.
[2] 张彩,田志刚.NK细胞受体群谱偏移与肿瘤免疫逃逸及逆转[J].中国免疫学杂志,2016,32(5):609-614.
[3] 江美林,彭文颖,李佳,等.非小细胞肺癌免疫治疗生物标志物研究进展[J].肿瘤防治研究,2018,45(10):805-810.
[4] 刘倩,孙爱民,王玮.固有免疫细胞抗肿瘤免疫治疗的研究进展[J].现代肿瘤医学,2018,26(8):1292-1296.
[5] 杨冀,于卉影.NKp30受体在肿瘤和感染性疾病中的研究进展[J].中国免疫学杂志,2018,34(10):1585-1589,1595.
[6] 王莉新,吴文斌.NK细胞的免疫监视作用及肿瘤免疫逃逸[J].细胞与分子免疫学杂志,2017,33(3):418-422.
[7] 王雯欣,黄娟娟,王振坤,等.NK 细胞治疗血液系统恶性肿瘤的研究进展[J].检验医学与临床,2016,13(9):1286-1288.
[8] Moreno-Nieves UY,Mundy DC,Shin JH,et al. The aryl hydrocarbon receptor modulates the function of human CD56NK cells[J]. Eur J Immunol,2018,48(5):771-776.
[9] Björkström NK,Ljunggren HG,Micha lsson J. Emerging insights into natural killer cells in human peripheral tissues[J]. Nat Rev Immunol,2016,16(5):310-320.
lsson J. Emerging insights into natural killer cells in human peripheral tissues[J]. Nat Rev Immunol,2016,16(5):310-320.
[10] Michel T,Poli A,Cuapio A,et al. Human CD56bright NK cells:an update[J]. J Immunol,2016,196(7):2923-2931.
[11] Aldarouish M,Su X,Qiao J,et al. Immunomodulatory effects of chemotherapy on blood lymphocytes and survival of patients with advanced non-small cell lung cancer[J]. Int J Immunopathol Pharmacol,2019,33:2058738419839592.
[12] Picard E,Godet Y,Laheurte C,et al. Circulating NKp46±Natural Killer cells have a potential regulatory property and predict distinct survival in non-small cell lung cancer[J]. Oncoimmunology,2018,8(2):e1527498.
[13] Han B,Mao FY,Zhao YL,et al. Altered NKp30,NKp44,NKG2D,and DNAM-1 expression on circulating NK cell is associated with tumor progression in human gastric cancer[J]. J Immunol Res,2018,2018:6248590.
[14] Nieto-Vel zquez NG,Torres-Ramos YD,Mu
zquez NG,Torres-Ramos YD,Mu oz-S
oz-S nchez JL,et al. Altered expression of natural cytotoxicity receptors and NKG2D on peripheral blood NK cell subsets in breast cancer patients[J]. Transl Oncol,2016,9(5):384-391.
nchez JL,et al. Altered expression of natural cytotoxicity receptors and NKG2D on peripheral blood NK cell subsets in breast cancer patients[J]. Transl Oncol,2016,9(5):384-391.
[15] 张爱民,柳芳芳,杨晓,等.肝细胞癌患者外周血NK细胞频率及受体表达[J].传染病信息,2016,29(4):213-215,227.
[16] 张明雷,尹晓东,李海洋,等.化疗对原发性胃癌患者外周血中免疫细胞亚群的影响[J].医学临床研究,2019,36(2):401-403.
[17] 王乃金,应浩杰,史进,等.胃癌患者化疗前后T细胞亚群、NK细胞及血清炎性因子水平变化的意义[J].解放军预防医学杂志,2019,37(2):57-59,62.