糖尿病是因胰岛素分泌功能障碍或其生物作用损伤而发生机体持续高血糖的代谢性疾病,其中以2型糖尿病(type 2 diabetes mellitus,T2DM)最为常见[1]。T2DM临床表现为疲乏无力、体重降低、多饮多食等症状,长期高血糖会缓慢损伤机体眼、肾、心脏及神经等,严重影响患者生活质量,甚至因并发症威胁患者生命安全[2]。临床常以糖尿病健康宣教、饮食支持、运动及药物治疗等措施为主要形式治疗T2DM[3],伏格列波糖是新一代α-葡萄糖苷酶抑制剂,可有效抑制小肠内α-葡萄糖苷酶活性,抑制餐后糖分降解,改善餐后高血糖症状[4]。临床研究证实,单用一种降糖药物效果往往不佳,而联用不同作用机制的降糖药物可有效控制患者血糖水平,降低心血管事件发生概率[5]。磷酸西格列汀是首个二肽基肽酶4(dipeptidyl peptidase-4,DDP-4)抑制剂,可通过提高肠促胰岛素分泌量而增强机体血糖控制水平[6]。有研究表明,血清鸢尾素(irisin)是一种肌因子,可在促进脂肪消耗、增加胰岛素敏感性及提高糖耐量水平等方面发挥积极作用[7]。人新饱食分子蛋白1(Nesfatin-1)是新近发现的脂肪因子,在机体能量消耗和代谢过程起到重要作用,且与T2DM的发生发展有重要联系[8]。目前临床已证实西格列汀或伏格列波糖的临床疗效[9],但二者联合应用对血清irisin和Nesfatin-1的影响研究相对较少。本研究探讨西格列汀联合伏格列波糖治疗2型糖尿病的效果及其对血清irisin、Nesfatin-1的影响,旨在为临床治疗提供依据,报告如下。
1 资料与方法
1.1 一般资料 选取2017年1月—2019年1月我院收治的T2DM患者164例,按照入院顺序编号,采用随机信封法将其分为观察组和对照组,每组82例。2组性别、年龄、体重指数及病程差异均无统计学意义(P>0.05),具有可比性,见表1。
本研究经医院医学伦理委员会批准通过,所有患者均研究知情并签署同意书。
1.2 纳入标准和排除标准 纳入标准:①符合T2DM诊断标准[10],空腹血糖(fasting blood glucose,FBG)≥7.0 mmol/L,餐后2 h血糖(2 h-postprandial plasma glucose,2 hPG)≥11.1 mmol/L;②文化程度小学及以上,有沟通交流的基础能力;③近3个月未服用过研究药物。排除标准:①妊娠期糖尿病、糖耐受不正常等其他内分泌疾病者;②妊娠期或哺乳期妇女;③严重心、肝及肾等脏器官损伤者;④合并患有恶性肿瘤、自身免疫疾病者;⑤对西格列汀或伏格列波糖不耐受或过敏者;⑥不配合者或因血糖持续较低而退出研究者。
表1 2组一般资料比较
Table 1 Comparison of general information between two groups![]()
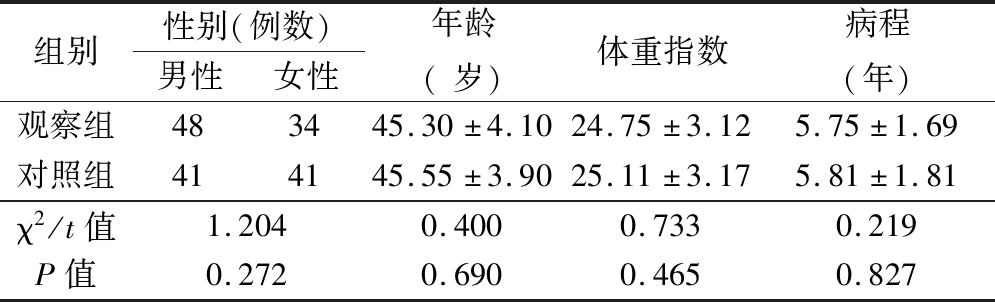
组别性别(例数)男性女性年龄(岁)体重指数病程(年)观察组483445.30±4.1024.75±3.125.75±1.69对照组414145.55±3.9025.11±3.175.81±1.81χ2/t值1.2040.4000.7330.219P值0.2720.6900.4650.827
1.3 治疗方法 2组均给予必要饮食营养支持、运动和心理疏导等基础治疗。对照组餐前即刻口服伏格列波糖片(天津武田药品有限公司,批准文号为国药准字H20010308,规格 0.2 mg),1片/次,3次/d。观察组在对照组基础上服用磷酸西格列汀片(Merck Sharp & Dohme Ltd.,批准文号为国药准字H20090834,规格 100 mg),不可与食物同服,1片/次,1次/d。2组均4周为1个疗程,治疗3个疗程。治疗过程中监测患者血糖情况,若血糖<3.9 mmol/L或出现症状性低血糖观察一段时间,若自行恢复血糖则可继续试验,若仍无法控制低血糖症状需停止服药或改用其他药物,同时退出研究。本研究患者均获得随访并完成研究,未见退出者。
1.4 观察指标
1.4.1 血糖、血脂及胰岛素抵抗等指标 于入组时和治疗后采集所有患者空腹外周血,应用BK-200型号全自动生化仪(山东博科生物产业有限公司)测定FBG、糖化血红蛋白(hemoglobin A1c,HbA1c)、空腹胰岛素(asting insulin,FINS)、三酰甘油(triglyceride,TG)、总胆固醇(total cholesterol,TC)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)及高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)等指标,同时在患者餐后测量患者2 hPG,并计算胰岛素抵抗指数(Homeostasis model-insulin resistance,HOMA-IR),HOMA-IR=FINS×FBG/22.5。
1.4.2 临床疗效[11] 治疗后评估2组治疗效果。显效:临床症状、体征显著改善,FBG和2 hPG恢复至正常水平或降低治疗前的40%,HbA1c恢复至正常水平或降低治疗前的30%。有效:临床症状、体征有所好转,FBG和2 hPG降低治疗前的20%,HbA1c降低治疗前的10%。无效:临床症状、体征没有改善,甚至加重,FBG、2 hPG和HbA1c没有降低至有效标准。总有效率=(显效+有效)/总例数×100%。
1.4.3 血清irisin和Nesfatin-1水平 入组时和治疗后采集患者外周静脉血4 mL置于抗凝管中,应用Allegray 64R Centrifuge 离心机型号离心机(美国Beckman Coulter)以3 000 r/min的速度离心10 min,获得血清,应用帝肯Infinite F50酶标仪酶联免疫法测定血清irisin和Nesfatin-1水平,试剂盒购自上海继锦化学科技有限公司。
1.4.4 不良反应发生情况 治疗期间记录2组出现皮疹、腹泻、便秘、肠鸣音亢进及恶心呕吐等不良反应事件。
1.5 统计学方法 应用SPSS 19.0统计软件分析数据。计量资料比较分别采用配对t检验和两独立样本的t检验;计数资料比较采用χ2检验;等级资料比较采用秩和检验。P<0.05为差异有统计学意义。
2 结 果
2.1 2组血糖指标和胰岛素抵抗指数比较 入组时,2组FBG、HbA1c、2 hPG和HOMA-IR差异均无统计学意义(P>0.05);治疗后,2组FBG、HbA1c、2 hPG和HOMA-IR均明显低于入组时,观察组FBG、HbA1c、2 hPG和HOMA-IR均低于对照组,差异有统计学意义(P<0.01)。见表2。
表2 2组血糖指标和胰岛素抵抗指数比较
Table 2 Comparison of blood glucose index and insulin resistance index between two groups![]()

组别FBG(mmol/L)入组时治疗后HbA1c(%)入组时治疗后2hPG(mmol/L)入组时治疗后HOMA-IR入组时治疗后观察组12.17±2.017.15±2.09∗10.48±2.878.14±1.16∗18.44±3.7810.11±3.23∗5.15±1.383.44±0.66∗对照组12.23±2.1210.01±2.24∗10.41±2.679.12±2.09∗18.89±3.4613.46±2.90∗5.13±1.284.65±1.21∗t值0.1868.4540.1623.7130.7956.9880.0967.950P值0.853<0.0010.872<0.0010.428<0.0010.923<0.001
*P值<0.05与入组时比较(配对t检验)
2.2 2组血脂比较 入组时,2组TC、TG、HDL-C、LDL-C差异无统计学意义(P>0.05);治疗后,2组TC、TG和LDL-C水平均明显低于入组时,HDL-C水平明显高于入组时,观察组TC、TG和LDL-C水平均低于对照组, HDL-C水平高于对照组,差异有统计学意义(P<0.01)。见表3。
表3 2组血脂比较
Table 3 Comparison of blood lipids between two groups![]()
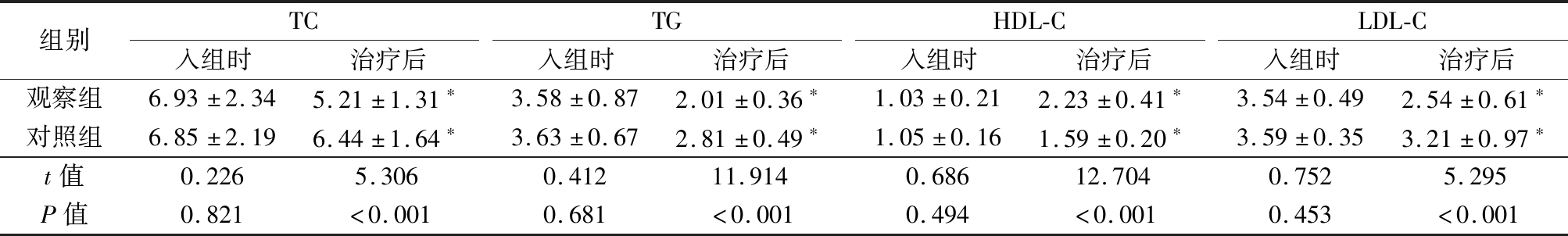
组别TC入组时治疗后TG入组时治疗后HDL-C入组时治疗后LDL-C入组时治疗后观察组6.93±2.345.21±1.31∗3.58±0.872.01±0.36∗1.03±0.212.23±0.41∗3.54±0.492.54±0.61∗对照组6.85±2.196.44±1.64∗3.63±0.672.81±0.49∗1.05±0.161.59±0.20∗3.59±0.353.21±0.97∗t值0.2265.3060.41211.9140.68612.7040.7525.295P值0.821<0.0010.681<0.0010.494<0.0010.453<0.001
*P值<0.05与入组时比较(配对t检验)
2.3 2组临床疗效比较 治疗后,观察组临床疗效优于对照组,总有效率明显高于对照组,差异均有统计学意义(P<0.01),见表4。
表4 2组临床疗效比较
Table 4 Comparison of clinical efficacy between two groups (n=82,例数)
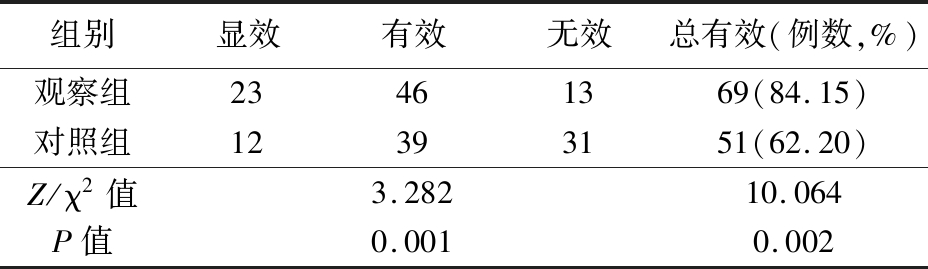
组别显效有效无效总有效(例数,%)观察组23461369(84.15)对照组12393151(62.20)Z/χ2值3.28210.064P值0.0010.002
2.4 2组血清irisin和Nesfatin-1水平比较 入组时,2组血清irisin和Nesfatin-1水平差异均无统计学意义(P>0.05);治疗后,2组血清Nesfatin-1水平明显低于入组时,血清irisin水平明显高于入组时,观察组血清Nesfatin-1水平明显低于对照组,血清irisin水平明显高于对照组,差异均有统计学意义(P<0.01)。见表5。
表5 2组血清irisin和Nesfatin-1水平比较
Table 5 Comparison of level of irisin and Nesfatin-1between two groups![]()
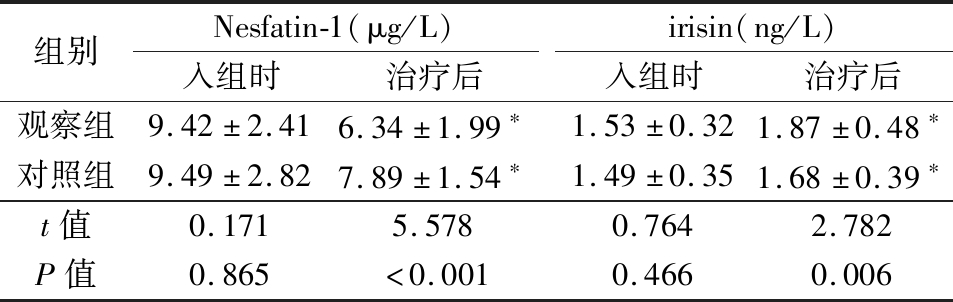
组别Nesfatin-1(μg/L)入组时治疗后irisin(ng/L)入组时治疗后观察组9.42±2.416.34±1.99∗1.53±0.321.87±0.48∗对照组9.49±2.827.89±1.54∗1.49±0.351.68±0.39∗t值0.1715.5780.7642.782P值0.865<0.0010.4660.006
*P值<0.05与入组时比较(配对t检验)
2.5 2组不良反应发生率比较 2组皮疹、腹泻、便秘、肠鸣音亢进、恶心呕吐、低血糖等不良反应发生率差异均无统计学意义(P>0.05),见表6。
表6 2组不良反应发生率比较
Table 6 Comparison of adverse reaction events between two groups (n=82,例数,%)
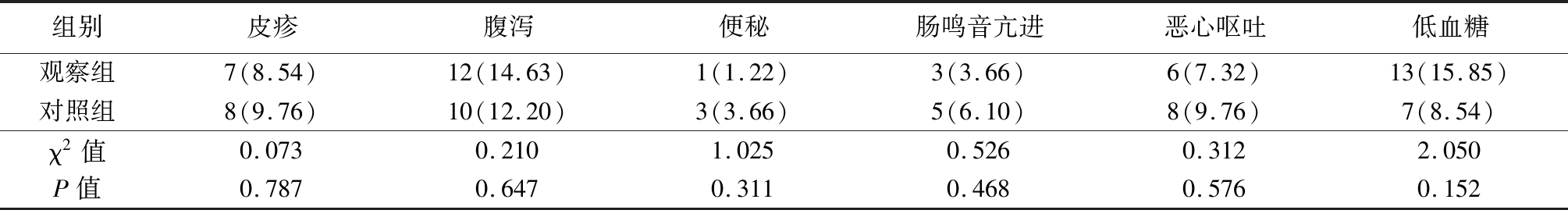
组别皮疹腹泻便秘肠鸣音亢进恶心呕吐低血糖观察组7(8.54)12(14.63)1(1.22)3(3.66)6(7.32)13(15.85)对照组8(9.76)10(12.20)3(3.66)5(6.10)8(9.76)7(8.54)χ2值0.0730.2101.0250.5260.3122.050P值0.7870.6470.3110.4680.5760.152
3 讨 论
T2DM是以持续高血糖为主要病理特征的常见内分泌代谢性疾病,若不及时诊断并控制血糖,不仅会造成“三多一少”经典体征,而且还会引发白内障、下肢周围神经病变及骨质疏松等并发症,严重威胁患者生活质量[12]。目前单独应用口服降糖药可有效控制血糖,但单一疗法会逐渐产生耐药性,因而有学者提出联合用药的理念,联合用药可从不同角度保护胰岛B细胞,缓解胰岛素抵抗作用,进而改善糖代谢功能,达到长期控制血糖的功效[13]。临床上已有西格列汀和伏格列波糖单独治疗T2DM的对比研究,二者均可有效控制血糖,而针对病程较长的患者,胰岛素抵抗会削弱单独给药的疗效[14]。因而本研究探讨西格列汀联合伏格列波糖治疗T2DM的效果及其对血清irisin和Nesfatin-1的影响,旨在为临床研究提供依据。本研究结果显示,治疗后,观察组FBG、HbA1c、2 hPG和HOMA-IR水平均明显低于对照组,TC、TG和LDL-C水平均明显低于对照组,HDL-C水平明显高于对照组(P<0.05);进一步比较2组临床疗效,观察组临床疗效优于对照组,总有效率高于对照组(P<0.05)。表明西格列汀联合伏格列波糖可有效控制机体血糖和血脂水平,缓解胰岛素抵抗水平,提高临床疗效。分析认为,T2DM患者通常表现为高血糖和血脂代谢异常等疾病,而伏格列波糖可与小肠黏膜表面糖苷酶竞争性争夺结合位点,延缓餐后淀粉、蔗糖等碳水化合物的降低,进而控制餐后血糖水平[15]。而磷酸西格列汀片可有效拮抗二肽基肽酶4,活化胰高糖素样多肽1,进而刺激机体分泌胰岛素;同时还可以降低机体胰高血糖素水平,进一步控制血糖[16]。二者从不同机制联合作用,共同提高机体控制血糖和血脂水平,提供临床疗效。此外,二者联用并没有增加治疗期间的不良反应,且梁菁菁等[17]Meta分析研究显示,西格列汀和伏格列波糖均具有较高的安全性。
现阶段研究表明,T2DM的发生发展与糖脂代谢、免疫功能及炎症反应有关[3]。Irisin是由纤连蛋白Ⅲ型结构包含蛋白5水解分化而成的肌因子,可由运动产生或过氧化物酶体增殖物激活受体γ共激活因子1α(peroxisome proliferator-activated receptor-γ coactivator-1α, PGC-1α)的大量表达而诱导分泌,可在炎症反应、脂肪消耗和机体代谢循环中发挥重要作用[7]。Nesfatin-1是新近发现的脂肪因子,广泛分布于下丘脑、垂体及肝脏组织等中枢神经系统中,具有调控脂肪和血糖代谢等生物学功能[8]。Algul 等[18] 研究表明,Nesfatin-1可促进胰岛B细胞分泌胰岛素,在T2DM发病过程中Nesfatin-1可作为代偿因子,通过调控胰岛素、胰高血糖素等激素水平改善机体糖脂代谢异常的症状。本研究结果显示,2组血清Nesfatin-1水平明显低于入组时,血清irisin水平明显高于入组时,观察组血清Nesfatin-1水平明显低于对照组,血清irisin水平明显高于对照组(P<0.05)。表明西格列汀联合伏格列波糖可有效提高血清irisin水平,降低血清Nesfatin-1水平。分析认为,西格列汀通过促进肠促胰岛素分泌量,伏格列波糖可有效抑制小肠内α-葡萄糖苷酶活性,降低餐后糖分的分解程度,二者共同降低血糖,进而降低Nesfatin-1代偿作用,因而降低血清Nesfatin-1水平。PGC-1α在机体糖脂代谢、内细胞稳态调控等过程中发挥重要作用[19],而西格列汀和伏格列波糖可有效纠正机体糖脂代谢异常,提高PGC-1α水平,进而上调血清irisin水平。药理研究表明,机体肝细胞分泌的DDP-4可诱发脂肪细胞和组织发生炎症反应,而西格列汀是DDP-4抑制剂,可有效降低机体慢性炎症反应[20],同时西格列汀可通过抑制抑制Nrf2/Keap1/ARE通路而发挥抗炎作用[21],而血清irisin具有抗炎作用,血清Nesfatin-1可诱导炎症发生,因而联合西格列汀可有效提高血清irisin水平,降低Nesfatin-1水平。杨卫东[22] 研究证实,西格列汀可有效降低T2DM患者炎症反应,改善患者临床疗效。
综上所述,西格列汀联合伏格列波糖治疗T2DM可有效提高临床疗效,改善脂代谢水平,上调血清irisin水平,降低血清Nesfatin-1水平,安全性好,值得临床推广。
[1] Tilg H,Moschen AR,Roden M. NAFLD and diabetes mellitus[J]. Nat Rev Gastroenterol Hepatol,2017,14(1):32-42.
[2] 黄娟,胡维,熊丹.血清LDL与2型糖尿病周围神经病变的相关性研究[J].分子诊断与治疗杂志,2018,10(5):352-355,360.
[3] Hamed SA. Brain injury with diabetes mellitus: evidence,mechanisms and treatment implications[J]. Expert Rev Clin Pharmacol,2017,10(4):409-428.
[4] Kurozumi A,Okada Y,Satoh H,et al. Effects of linagliptin monotherapy compared with voglibose on postprandial lipid profiles in Japanese patients with type 2 diabetes: linagliptin study of effects on postprandial blood glucose(L-STEP) sub-study 1[J]. Endocr J,2018,65(4):415-425.
[5] 牟伦盼,蒋建家,张雅萍,等.达格列净与利格列汀对口服降糖药控制不佳的超重或肥胖2型糖尿病患者的疗效和安全性比较[J].中华糖尿病杂志,2019,11(3):190-195.
[6] Ahrén B,Masmiquel L,Kumar H,et al. Efficacy and safety of once-weekly semaglutide versus once-daily sitagliptin as an add-on to metformin,thiazolidinediones,or both,in patients with type 2 diabetes(SUSTAIN 2): a 56-week,double-blind,phase 3a,randomised trial[J]. Lancet Diabetes Endocrinol,2017,5(5):341-354.
[7] Colaianni G,Mongelli T,Cuscito C,et al. Irisin prevents and restores bone loss and muscle atrophy in hind-limb suspended mice[J]. Sci Rep,2017,7(1):2811.
[8] Xu Y,Zhang H,Li Q,et al. The role of nesfatin-1 expression in letrozole-induced polycystic ovaries in the rat[J]. Gynecol Endocrinol,2017,33(6):438-441.
[9] Arao T,Okada Y,Torimoto K,et al. Comparison between effectiveness of 100 mg/day sitagliptin and a switch to mitiglinide calcium hydrate/voglibose from 50 mg/day sitagliptin in patients with type 2 diabetes[J]. J Uoeh,2017,39(1):1-9.
[10] Lee KT,Yeh YH,Chang SH,et al. Metformin is associated with fewer major adverse cardiac events among patients with a new diagnosis of type 2 diabetes mellitus:a propensity score-matched nationwide study[J]. Medicine,2017,96(28):e7507.
[11] 石慧敏,丘军,贾冬梅,等.门冬胰岛素30不同注射次数对老年2型糖尿病患者临床疗效的比较[J].中国糖尿病杂志,2017,25(5):403-406.
[12] 张华贞,赵晓琴,吴琼皎.厄贝沙坦与前列地尔联用治疗糖尿病肾病的可行性分析[J].分子诊断与治疗杂志,2019,11(1):54-57,62.
[13] 陆菊明.沙格列汀和二甲双胍缓释片治疗2型糖尿病的研究进展[J].中国糖尿病杂志,2017,25(1):91-94.
[14] Matsushima Y,Takeshita Y,Kita Y,et al. Pleiotropic effects of sitagliptin versus voglibose in patients with type 2 diabetes inadequately controlled via diet and/or a single oral antihyperglycemic agent: a multicenter,randomized trial[J]. BMJ Open Diabetes Res Care,2016,4(1):e000190.
[15] 杨玉华,孙丽,王桂花,等.伏格列波糖联合利拉鲁肽治疗2型糖尿病的疗效观察[J].现代药物与临床,2017,32(8):1532-1535.
[16] Nauck MA,Meier JJ. Sitagliptin plus basal insulin: simplifying in-hospital diabetes treatment?[J]. Lancet Diabetes Endocrinol,2017,5(2):83-85.
[17] 梁菁菁,陈静芸,杨艳,等.西格列汀与其他降糖药物对照治疗2型糖尿病的Meta分析[J].医学综述,2015,21(5):886-889,892.
[18] Algul S,Ozcelik O. Evaluating the levels of nesfatin-1 and ghrelin hormones in patients with moderate and severe major depressive disorders[J]. Psychiatry Investig,2018,15(2):214-218.
[19] Peng K,Yang L,Wang J,et al. The interaction of mitochondrial biogenesis and fission/fusion mediated by PGC-1α regulates rotenone-induced dopaminergic neurotoxicity[J]. Mol Neurobiol,2017,54(5):3783-3797.
[20] 蔡清颜,林开阳,李良毅,等.西格列汀对2型糖尿病小鼠的降脂与改善炎症反应的作用[J].中国临床药理学杂志,2019,35(1):42-44.
[21] Civantos E,Bosch E,Ramirez E,et al. Sitagliptin ameliorates oxidative stress in experimental diabetic nephropathy by diminishing the miR-200a/Keap-1/Nrf2 antioxidant pathway[J]. Diabetes Metab Syndr Obes,2017,10:207-222.
[22] 杨卫东.二甲双胍联合西格列汀对初诊T2DM患者临床疗效分析[J].药物评价研究,2018,41(4):643-647.