糖代谢异常与心血管疾病关系密切,2型糖尿病(type 2 diabetes mellitus,T2DM)是血管系统疾病重要危险因素之一,冠心病(coronary heart disease,CHD)是糖尿病并发症之一,糖尿病可增加2~4倍心血管疾病发生及死亡风险[1-2]。传统口服降糖药物和胰岛素治疗虽然可有效控制血糖水平,但是并不能控制心血管事件风险,且西药治疗具有较大不良反应,影响治疗效果。丹红注射液是基于中医理论,从丹参和红花中萃取的有效药物成分,主要功效为活血化瘀[3],现代临床研究显示丹红注射液可扩张血管、降低血液黏滞度、改善血液循环等作用,显著降低心血管疾病患者心血管事件风险[4]。一项荟萃分析显示丹红注射液用于T2DM合并CHD患者治疗可有效缓解患者心绞痛症状,改善心电图表现[5]。但是目前少有丹红注射液对T2DM合并CHD患者胰岛素抵抗、内皮功能、炎症因子、心血管事件影响的报道,鉴于此,本研究设计随机对照试验,观察丹红注射液对T2DM合并CHD患者的保护机制,为临床治疗提供参考。
1 资料与方法
1.1 一般资料 选取2016年1月—2018年12月石家庄市栾城人民医院诊治的206例T2DM合并CHD患者,纳入标准:①符合 2013 年欧洲心脏病学会指南中CHD诊断标准[6];②符合2013年版《中国2型糖尿病防治指南》中T2DM诊断标准[7];③配合本研究实验室和影像检查项目。排除标准:①冠状动脉疾病以外心脏病、恶性肿瘤、外周血管病变患者;②妊娠期、哺乳期妇女、绝经前妇女;③本研究所需实验室生化指标和影像检查结果不全者。采用随机、双盲、平行方法将患者分为2组,每组103例。研究组男性72例,女性31例,年龄48~60岁,平均(53.2±3.4)岁,T2DM病程4~15年,平均(8.1±3.6)年,CHD病程2~7年,平均(3.6±0.5)年;对照组男性68例,女性35例,年龄45~61岁,平均(53.5±3.6)岁,T2DM病程3~16年,平均(8.3±3.5)年,CHD病程1~6年,平均(3.5±0.7)年。2组性别、年龄、病程等基线资料比较差异无统计学意义(P>0.05),具有可比性。
本研究通过医院伦理委员会批准,患者均知情同意并签署同意书。
1.2 方法 对照组采用降糖、降脂、降压等基础治疗,并给予糖尿病、冠心病教育,饮食控制,适当运动及美托洛尔治疗方案。拜阿司匹林肠溶片(拜耳医药保健有限公司,国药准字J20130078) 0.1 g/次,口服,1次/d,酒石酸美托洛尔片(阿斯利康制药有限公司,国药准字H32025391)12.5 mg/次,每天2次,维持治疗14 d。研究组在对照组的基础上联合应用丹红注射液进行辅助治疗,丹红注射液(济南步长制药有限公司生产,国药准字Z20026866)40 mL加入250 mL生理盐水中静脉滴注,1 次/d,维持治疗14 d。
1.3 观察指标 ①治疗前、后分别采集清晨空腹静脉血检测胰岛素抵抗相关指标,糖化血红蛋白(hemoglobin A1c,HbA1c)采用高效液相法,空腹血糖(fasting plasma glucose,FPG)、餐后2 h血糖(2 h plasma glucose,2 hPG)采用葡萄糖氧化酶法,试剂盒均购自美国Bio-Rad公司,通过稳态模型计算胰岛素抵抗指数(Homeostasis model assessment insulin resistance,HOMA-IR),仪器为美国贝克曼库尔特AU5800型全自动生化分析仪。②血管内皮舒张功能,包括血流介导的血管内皮依赖性舒张功能(flow-mediated endothelium-dependent vasodilation,FMD)和硝酸甘油介导的非依赖性血管内皮舒张功能(nitroglycerin-mediated non-dependent vasodilation,NMD)。方法如下:IE-33彩色超声诊断仪(美国Philips公司)分别测量安静状态下舒张末期(N1)、反应性充血试验(血压计袖带加压至300 mmHg后驱血4 min,放气1 min测量)(N2)、口服0.5 mg硝酸甘油4 min(N3)肱动脉内径,FMD=(N2-N1)/N1×100%, NMD=(N3-N1)/N1×100%[8]。取同一部位3次测量取平均值。③治疗前、后分别采集清晨空腹静脉血,酶联免疫吸附试验检测肿瘤坏死因子α(tumor necrosis factor-α,TNF-α),白细胞介素6(interleukin-6,IL-6),仪器为意大利全自动酶免分析仪BIOBASE2000, TNF-α试剂盒购自美国Epitope Diagnostics公司,IL-6试剂盒购自上海西唐生物科技有限公司。超敏C反应蛋白(high-sensitivity C-reactive protein,hs-CRP)采用美国雅培AxSYM化学发光分析仪及其配套试剂检测。免疫组织化学法检测血清调控因子核因子κB(nuclear factor-κB,NF-κB)活性,试剂盒购自武汉博士德公司。④所有患者均随访6个月,统计心血管事件发生情况,包括心源性死亡、心肌梗死、急性冠状动脉综合征、心力衰竭。
1.4 统计学方法 应用SPSS 25.0统计软件进行分析数据。计量数据比较采用独立样本t检验或配对t检验或非参数秩和检验。计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 胰岛素抵抗相关指标比较 治疗前2组患者FPG、2 hPG、HbA1c、HOMA-IR水平比较差异无统计学意义(P>0.05),治疗后2组FPG、2 hPG、HbA1c、HOMA-IR水平均显著下降(P<0.05),研究组治疗后FPG、2 hPG、HbA1c、HOMA-IR水平低于对照组(P<0.01),见表1。
表1 2组治疗前后FPG、2 hPG、HbA1c、HOMA-IR比较
Table 1 Differences of FPG,2hPG,HbA1c and HOMA-IR between two groups before and after treatment (n=103)

组别FPG(x-±s,mmol/L)治疗前治疗后2hPG(x-±s,mmol/L)治疗前治疗后HbA1c(x-±s,%)治疗前治疗后HOMA-IR[M(QR]治疗前治疗后研究组12.7±3.27.1±2.6∗15.5±6.210.2±2.5∗9.2±2.35.1±1.7∗3.3(2.8)2.1(1.6)∗对照组12.2±3.39.6±3.0∗15.3±6.712.9±3.6∗9.3±2.57.5±1.8∗3.4(2.9)3.0(2.2)∗t/Z值1.1026.3910.2226.2520.2997.4361.29916.961P值0.271<0.0010.824<0.0010.765<0.0010.195<0.001
*P值<0.05 与治疗前比较(配对t检验或秩和检验)
2.2 内皮功能比较 治疗前2组患者FMD、NMD水平比较差异无统计学意义(P>0.05),治疗后研究组患者FMD、NMD水平均显著升高(P<0.05),对照组FMD有所升高(P<0.05),NMD无明显变化(P>0.05),研究组治疗后FMD、NMD水平高于对照组(P<0.05),见表2。
2.3 炎症因子比较 治疗前2组患者血清TNF-α、IL-6、hs-CRP、NF-κB水平比较差异无统计学意义(P>0.05),治疗后2组TNF-α、IL-6、hs-CRP、NF-κB水平均显著下降(P<0.05),研究组治疗后TNF-α、IL-6、hs-CRP、NF-κB水平低于对照组(P<0.01),见表3。
表2 2组治疗前后FMD、NMD比较
Table 2 Differences of FMD and NMD between two groups before and after treatment (n=103)
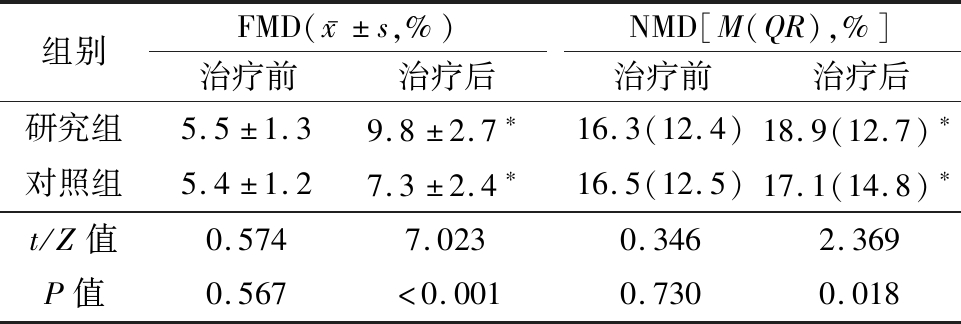
组别FMD(x-±s,%)治疗前治疗后NMD[M(QR),%]治疗前治疗后研究组5.5±1.39.8±2.7∗16.3(12.4)18.9(12.7)∗对照组5.4±1.27.3±2.4∗16.5(12.5)17.1(14.8)∗t/Z值0.5747.0230.3462.369P值0.567<0.0010.7300.018
*P值<0.05 与治疗前比较(配对t检验或秩和检验)
表3 2组治疗前后TNF-α、IL-6、hs-CRP、NF-κB比较
Table 3 Differences of TNF-alpha, IL-6, hs-CRP and NF-κB between two groups before and after treatment![]()
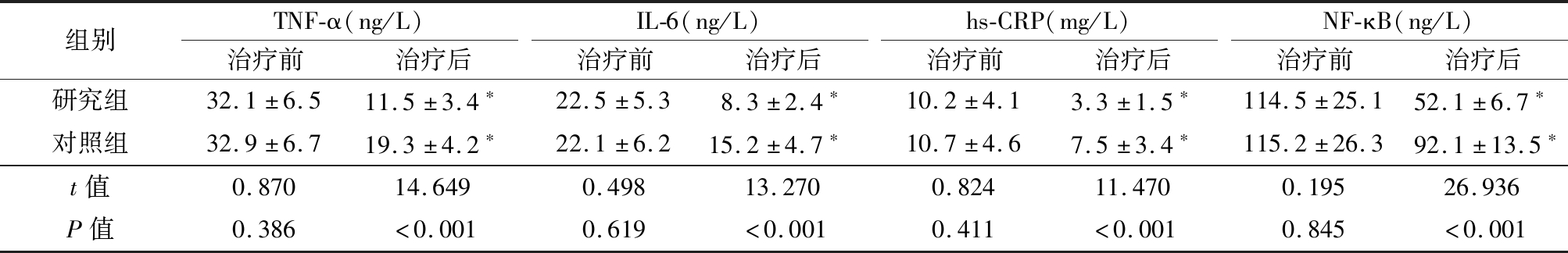
组别TNF-α(ng/L)治疗前治疗后IL-6(ng/L)治疗前治疗后hs-CRP(mg/L)治疗前治疗后NF-κB(ng/L)治疗前治疗后研究组32.1±6.511.5±3.4∗22.5±5.38.3±2.4∗10.2±4.13.3±1.5∗114.5±25.152.1±6.7∗对照组32.9±6.719.3±4.2∗22.1±6.215.2±4.7∗10.7±4.67.5±3.4∗115.2±26.392.1±13.5∗t值0.87014.6490.49813.2700.82411.4700.19526.936P值0.386<0.0010.619<0.0010.411<0.0010.845<0.001
*P值<0.05与治疗前比较(配对t检验)
2.4 心血管事件比较 研究组随访期间心源性死亡、心肌梗死、急性冠状动脉综合征、心力衰竭总心血管事件发生率低于对照组(P<0.05),见表4。
表4 2组心源性死亡、心肌梗死、急性冠脉综合征、心力衰竭发生率比较
Table 4 Incidence of cardiogenic death, myocardial infarction, acute coronary syndrome and heart failure case (n=103,例数,%)

组别心源性死亡心肌梗死急性冠状动脉综合征心力衰竭总心血管事件发生率研究组0(0.00)1(0.97)1(0.97)3(2.91)5(4.85)对照组3(2.91)4(3.88)4(3.88)5(4.85)16(15.53)χ2值6.416P值0.011
3 讨 论
糖尿病是代谢紊乱性疾病,涉及全身各个系统,糖尿病患者糖脂、蛋白质代谢障碍增加心血管疾病风险,持续高血糖是动脉粥样硬化性疾病的独立危险因素,CHD是T2DM严重心血管并发症,T2DM合并CHD相互促进、影响,导致心肌梗死等急性心血管事件的发生,据统计约80.00%糖尿病患者死于心血管疾病,其中70.00%死于CHD[9]。当冠心病合并糖尿病时,从冠状动脉造影结果来看,合并多支病变的概率更高、程度更严重[10]。丹红注射液是目前临床上治疗心血管疾病较为广泛的中成药制剂,主要成分有丹参酮、丹参酚酸、红花酚普和儿茶酚、红花黄色素等,可通过刺激血管生长因子改善血管再生功能,抑制凝血酶原活性,增加血栓溶解功能,提高患者抗心肌缺血能力,同时还能减少心肌耗氧,改善心功能[11]。然而丹红注射液是否能使T2DM合并CHD患者在胰岛素抵抗、内皮功能、炎症反应、心血管事件方面获益尚待研究证实。
胰岛素抵抗是T2DM发病主要环节之一,同样与CHD高危因素呈明显相关性,随着胰岛素抵抗程度的增加,CHD危险因素呈聚集性增加趋势,冠脉病变程度逐渐加重。积极降低胰岛素抵抗治疗是预防大血管病变的关键措施。T2DM合并CHD患者FPG、2 hPG、HbA1c、HOMA-IR水平普遍偏高,且高血糖和胰岛素抵抗患者冠状动脉完全闭塞率、心肌梗死率高于低血糖和胰岛素抵抗水平患者[12]。T2DM微循环障碍可降低血糖的利用度,不利于胰岛β细胞生长发育,并加重胰岛β细胞功能的减退,引起高血糖,加重微循环障碍。丹红注射液通过降低血小板P选择素表达抑制血小板膜糖蛋白受体激活,促进前列环素合成增加,改善微循环状态[13],进而抑制胰岛β细胞功能衰退,增加外周组织细胞对葡萄糖的敏感性和摄取,降低血糖水平,改善胰岛素抵抗状态。本研究结果显示治疗后2组FPG、2 hPG、HbA1c、HOMA-IR水平明显下降,研究组FPG、2 hPG、HbA1c、HOMA-IR水平低于对照组,提示丹红注射液可降低T2DM合并CHD患者胰岛素抵抗,改善其胰岛功能,杨丽鸣等[14]在研究中也同样证实丹红注射液对改善胰岛功能有重要作用。
内皮功能障碍是细胞膜损伤表现之一,也是胰岛素抵抗自身固有表现,在胰岛素之前已经发生,内皮功能损伤可改变胰岛素受体功能,降低外周组织对葡萄糖的摄取和利用,参与胰岛素抵抗的发生和发展。血管内皮功能受损可诱发动脉粥样硬化性心血管疾病[15],内皮依赖性血管舒张功能受损是血管内皮功能障碍最为显著的表现,且发生早于动脉粥样硬化形成之前,并且参与动脉粥样硬化全过程。本研究结果显示,治疗前2组患者FMD、NMD处于较低水平,提示T2DM合并CHD患者已经有明显的血管内皮舒张功能障碍,治疗后研究组患者FMD、NMD高于对照组,提示丹红注射液在改善血管内皮依赖性舒张功能和非依赖性血管内皮舒张功能更具有优势。丹红注射液可有效清除氧自由基,减轻血管炎症反应,改善血流变学[16],其次通过抑制脂质过氧化过程,减少氧化型低密度脂蛋白对细胞膜的损伤,稳定细胞膜,保护血管内皮功能。丹红注射液还可以通过降低胰岛素抵抗,增加胰岛素敏感性,减少对血管内皮细胞的损伤,保护内皮功能。也有学者[17]认为丹红注射液通过降低氧化应激损伤,保护血管内皮功能。
T2DM和CHD均是慢性低度炎症性疾病,炎性因子在T2DM合并CHD发病和进展过程中发挥了重要作用。相关研究显示T2DM患者血清TNF-α、IL-6、hs-CRP水平明显升高[18],炎性因子水平升高可增加胰岛素抵抗,并促进血管局部中性粒细胞和单核细胞浸润、脂质沉积和动脉粥样硬化斑块形成。CHD患者炎性因子TNF-α、IL-6、hs-CRP升高是CHD患者预后不良的有效预测指标[19]。TNF-α、IL-6是多效促炎因子,在炎性介质网发挥关键作用,hs-CRP是急性时相蛋白,是炎性反应敏感指标,NF-κB是启动和调节炎性反应关键核因子,并调控炎性因子转录。本研究治疗前2组患者血清TNF-α、IL-6、hs-CRP、NF-κB水平明显升高,治疗后均出现下降,而研究组下降更为明显。刘畅等[20]也观察到丹红注射液可降低老年心力衰竭患者血清TNF-α、NF-κB和IL-1β水平,提示丹红注射液具有抑制炎症反应作用,但是具体机制尚不清楚,可能与丹红注射液改善患者内皮功能,降低血糖水平和胰岛素抵抗,改善机体微环境有关。
本研究通过对所有患者进行6个月随访,发现研究组患者心血管事件发生率远低于对照组,说明丹红注射液有助于预防不良心血管事件的发生。分析原因为丹红注射液有效控制T2DM合并CHD患者动脉粥样硬化进程,减少心肌缺血发生,防止大血管病变。
综上所述,丹红注射液可降低T2DM合并CHD患者胰岛素抵抗和炎症反应水平,改善血管内皮功能,预防心血管事件的发生,具有较高应用价值。
[1] Ofstad AP. Myocardial dysfunction and cardiovascular disease in type 2 diabetes[J]. Scand J Clin Lab Invest,2016,76(4):271-281.
[2] Arbel Y,Fuster V,Baber U,et al. Incidence,determinants and impact of acute kidney injury in patients with diabetes mellitus and multivessel disease undergoing coronary revascularization: Results from the FREEDOM trial[J]. Int J Cardiol,2019,293:197-202.
[3] 吕海洋,莫颖宁.丹红注射液治疗老年病的临床应用及药理作用研究进展[J].天津中医药,2016,33(2):120-124.
[4] You Q,Wang J,Dong W,et al. Protective effect of Danhong injection in patients with acute myocardial infarction at a high risk of no-reflow during primary percutaneous coronary intervention[J]. J Geriatr Cardiol,2019,16(5):406-413.
[5] 李海东.中药注射剂的临床应用分析以及丹红注射液治疗糖尿病性冠心病疗效的Meta分析[D].太原:山西医科大学,2017.
[6] Montalescot G,Sechtem U,Achenbach S,et al. 2013 ESC guidelines on the management of stable coronary artery disease: the Task Force on the management of stable coronary artery disease of the European Society of Cardiology[J]. Eur Heart J,2013,34(38):2949-3003.
[7] 中华医学会糖尿病学分会.中国2型糖尿病防治指南(2013年版)[J].中华糖尿病杂志,2014,6(7):447-498.
[8] Celermajer DS,Sorensen KE,Gooch VM,et al. Non-invasive detection of endothelial dysfunction in children and adults at risk of atherosclerosis[J]. Lancet,1992,340(8828):1111-1115.
[9] Ergul A. Endothelin-1 and diabetic complications:focus on the vasculature[J]. Pharmacol Res,2011,63:477-482.
[10] 侯晓沛,田艳蒙,许亮,等.糖化血红蛋白水平对稳定性冠心病合并2型糖尿病患者冠状动脉病变程度的影响[J].中国循环杂志,2018,33(5):435-440.
[11] 王建军,王凯,韩旭晨.丹红注射液治疗冠心病合并糖尿病的临床疗效[J].辽宁中医杂志,2017,44(7):1429-1430.
[12] Effoe VS,Wagenknecht LE,Echouffo Tcheugui JB,et al. Sex differences in the association between insulin resistance and incident coronary heart disease and stroke among blacks without diabetes mellitus:the jackson heart study[J]. J Am Heart Assoc,2017,6(2). pii: e004229.
[13] 陈勇,李晓琴,李燕.丹红注射液对糖尿病伴高凝状态的疗效观察研究[J].西南国防医药,2017,27(12):1259-1262.
[14] 杨丽鸣,邵文妍,赵蓓俊,等.丹红注射液对2型糖尿病血瘀证患者胰岛素抵抗的影响[J].世界中医药,2019,14(2):434-437.
[15] 贾慧宇,程光慧.负荷量加高维持量阿托伐他汀对ACS行PCI患者炎症因子及血管内皮功能的影响[J].河北医科大学学报,2018,39(10):1131-1134,1157.
[16] 冷唯.丹红注射液联合硝酸甘油对急性心肌梗死经皮冠状动脉介入手术的影响[J].湖北中医药大学学报,2016,18(5):18-21.
[17] 董静,陈韵岱,刘红旭,等.丹红注射液对不稳定型心绞痛血瘀证患者经皮冠状动脉介入术围手术期血管内皮功能的影响[J].中医杂志,2014,55(13):1109-1112.
[18] 汪菲,高向阳,张蓉.糖尿病肾病患者血清炎性因子、vWf、VEGF及黏附分子水平变化及意义[J].海南医学院学报,2017,23(16):2207-2210.
[19] Li H,Sun K,Zhao R,et al. Inflammatory biomarkers of coronary heart disease[J]. Front Biosci (Landmark Ed),2017,22:504-515.
[20] 刘畅,张苗苗,刘丽.丹红注射液对老年心衰患者血清TNF-α、NF-κB和IL-1β的影响研究[J].河北医学,2017,23(1):10-13.