2型糖尿病随着病程的增加,发生糖尿病慢性并发症的风险大大增加,尤其血糖控制不佳者更易发生慢性并发症。糖尿病肾病是糖尿病较常见的严重慢性并发症之一,也是目前中末期肾病的主要病因,约占所有终末期肾病的1/3[1]。2009—2012年我国2型糖尿病患者的糖尿病肾病患病率在社区患者中为30%~50%,在住院患者中为40%[2]。糖尿病肾病严重影响患者生存质量,不易早期发现及预防,糖尿病肾病起病隐匿,一旦进入大量蛋白尿期,进展至终末期肾病(end-stage renal disease,ESRD)的速度为其他肾病的14倍[2],因此早期发现、预防、治疗糖尿病肾病,对提高患者存活率及生存质量意义重大。当前研究表明引起或加重糖尿病肾功能损害的因素包括性别、年龄、病程、血压、吸烟史、血脂、体重指数(body mass index,BMI)、体重、血糖、血压、尿酸(uric acid,UA)等[3-5]。之前相关研究仅对于个别或单一因素进行分析,本研究收集多种代谢参数,并以不同年龄及体重分组,观察各组肾小球滤过率(estimating glomerular filtration rate,eGFR)变化情况,并分析各代谢参数与eGFR的相关性,以发现可能引起糖尿病肾病肾损害的危险因素,从而更好的控制糖尿病肾病地发生与发展。
1 资料与方法
1.1 一般资料 选择2016年1月—2017年3月复旦大学附属中山医院内分泌科收治的2型糖尿病患者207例及非糖尿病患者68例,共275例。首先按照年龄20岁间隔分组,共分为4组,≤20岁组(n=11),>20~40岁组(n=59),>40~60岁组(n=101),>60~80岁组(n=104)。为观察不同体重中老年患者的eGFR差异情况,再将40~70岁175例患者以不同BMI分组,共分为4组,BMI≤24组(n=43),BMI> 24~28 组(n=79),BMI>28~32组(n=31),BMI>32组(n=22)。2型糖尿病的诊断与分型依据2003年美国糖尿病学会(American Diabetes Association,ADA)标准,除外1型糖尿病、特殊类型糖尿病,高血压肾病、肾小球肾炎等患者。采用横断面研究对所研究对象询问个人史、既往史、家族史。测量患者身高,空腹测量体质量、腰围、臀围,并检测糖化血红蛋白(hemoglobin A1c,HbA1c)、血常规、肝功能、肾功能、血脂全项、同型半胱氨酸(homocysteine,HCY)等。
1.2 eGFR计算 应用改良MDRD公式计算eGFR(mL·min-1·1.73m-2)=175×血清肌酐(serum creatinine,SCr)1.234×年龄-0.179(女性×0.79)。
1.3 统计学方法 应用SPSS 20.0统计软件分析数据。计量资料多组间比较符合正态分布及方差齐性时采用ANOVA方差分析和SNK-q检验,计数资料比较采用χ2检验。相关因素分析采用Pearson相关性分析,再以eGFR为因变量,以各代谢参数为自变量行线性回归分析。P<0.05为差异有统计学意义。
2 结 果
2.1 患者一般临床特征 随着年龄的增加,eGFR逐步降低,同时BMI、丙氨酸转氨酶(glutamic pyruvic transaminase,ALT)、天冬氨酸转氨酶(glutaminc oxalacetic transaminase,AST)、UA水平逐步降低,HbA1c逐渐增高,尿微量白蛋白(microalbuminuria,mAlb)水平增高,差异有统计学意义(P<0.01),见表1。
表1 不同年龄组患者临床特征
Table 1 Clinical features of type 2diabetespatients with different age![]()
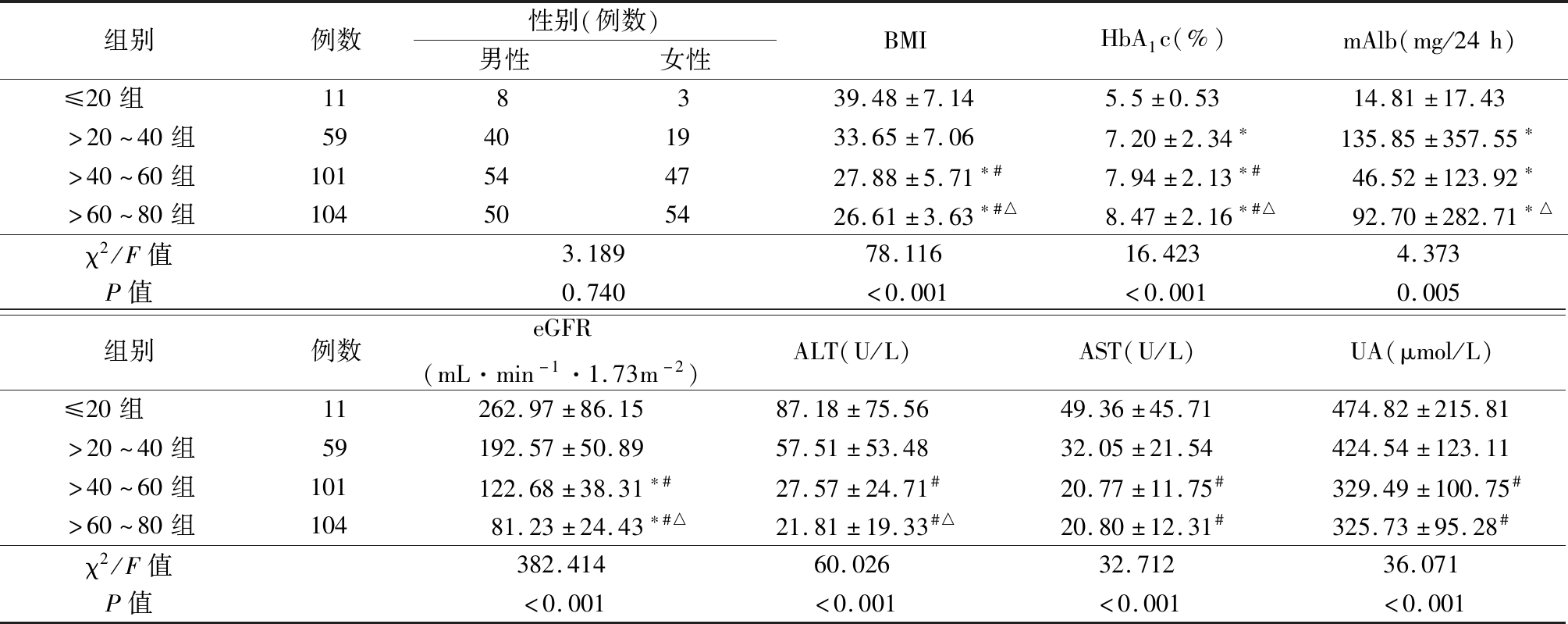
组别例数性别(例数)男性女性BMIHbA1c(%)mAlb(mg/24h)≤20组 118339.48±7.145.5±0.5314.81±17.43>20~40组59401933.65±7.067.20±2.34∗135.85±357.55∗>40~60组101544727.88±5.71∗#7.94±2.13∗#46.52±123.92∗>60~80组104505426.61±3.63∗#△8.47±2.16∗#△92.70±282.71∗△χ2/F值3.18978.11616.4234.373P值0.740<0.001<0.0010.005组别例数eGFR(mL·min-1·1.73m-2)ALT(U/L)AST(U/L)UA(μmol/L)≤20组 11262.97±86.1587.18±75.5649.36±45.71474.82±215.81>20~40组59192.57±50.8957.51±53.4832.05±21.54424.54±123.11>40~60组101122.68±38.31∗#27.57±24.71#20.77±11.75#329.49±100.75#>60~80组10481.23±24.43∗#△21.81±19.33#△20.80±12.31#325.73±95.28#χ2/F值382.41460.02632.71236.071P值<0.001<0.001<0.001<0.001
*P值<0.05与≤20岁组比较 #P值<0.05与>20~40岁组比较 △P值<0.05与>40~60岁组比较(SNK-q检验)
2.2 相关性分析 eGFR与BMI、TG、ALT、AST、GGT、UA均呈正相关(P<0.01),与性别、HCY、HbA1c、25(OH)D呈负相关(P<0.05或P<0.01),见表2。
表2 不同代谢因素与eGFR Pearson相关性分析
Table 2 Pearson correlation analysis of glomerular filtration rateand different metabolic factors
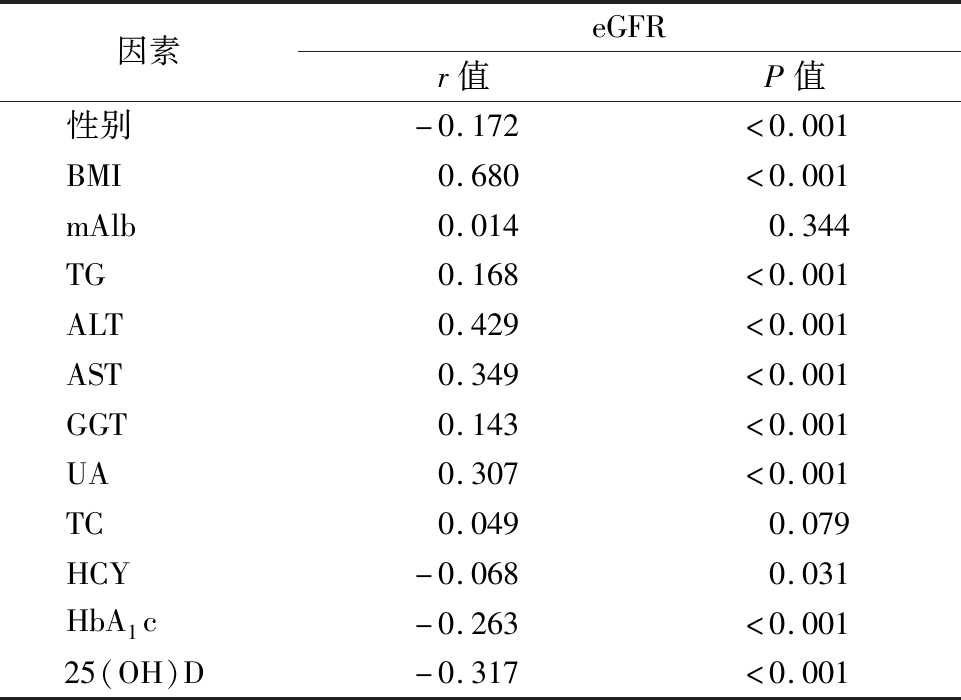
因素eGFRr值P值性别-0.172<0.001BMI0.680<0.001mAlb0.0140.344TG0.168<0.001ALT0.429<0.001AST0.349<0.001GGT0.143<0.001UA0.307<0.001TC0.0490.079HCY-0.0680.031HbA1c-0.263<0.00125(OH)D-0.317<0.001
2.3 不同代谢因素与eGFR线性回归分析 以eGFR为因变量,以BMI、TG、ALT、AST、GGT、UA、HbA1c、HCY、25(OH)D为自变量进行线性回归分析。结果表明BMI、TG、ALT是eGFR的保护因素,AST、GGT、UA、HbA1c、HCY、25(OH)D是eGFR危险因素(P<0.001),见表3,4。
表3 变量赋值表
Table 3 Variableassignment table

组别变量赋值BMI≤30=0;>30=1TG≤1.7mmol/L=0;>1.7mmol/L=1ALT≤40U/L=0;>40U/L=1AST≤40U/L=0;>40U/L=1GGT≤30U/L=0;>30U/L=1UA≤420μmol/L=0;>420μmol/L=1HbA1c≤6.5%=0;>6.5%=1HCY≤15.4μmol/L=0;>15.4μmol/L=125(OH)D≤20μg/L=0;>20μg/L=1
表4 不同代谢因素与eGFR线性回归分析
Table 4 Linear regression analysis of glomerular filtration rateand different metabolic factors
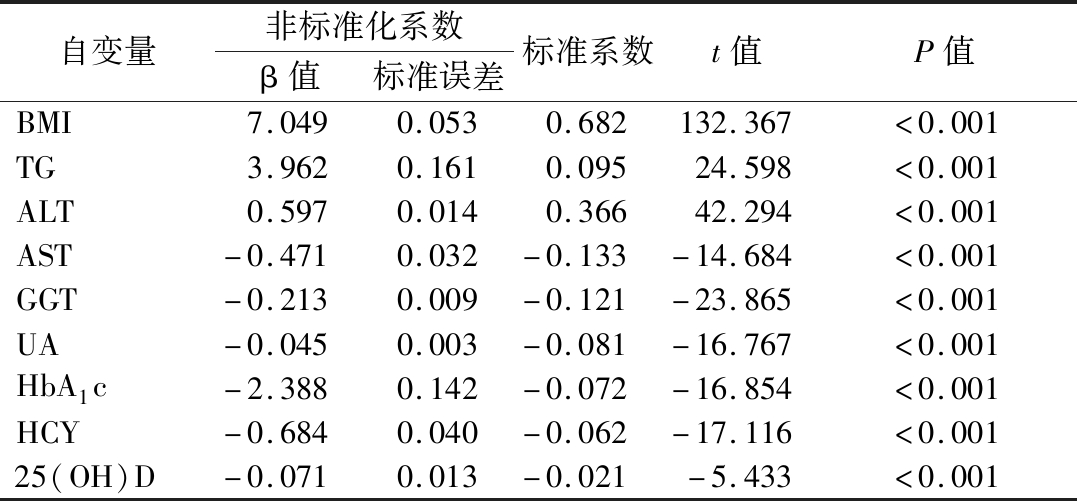
自变量非标准化系数β值标准误差标准系数t值P值BMI7.0490.0530.682132.367<0.001TG3.9620.1610.09524.598<0.001ALT0.5970.0140.36642.294<0.001AST-0.4710.032-0.133-14.684<0.001GGT-0.2130.009-0.121-23.865<0.001UA-0.0450.003-0.081-16.767<0.001HbA1c-2.3880.142-0.072-16.854<0.001HCY-0.6840.040-0.062-17.116<0.00125(OH)D-0.0710.013-0.021-5.433<0.001
2.4 年龄相近不同BMI组间eGFR临床特征 随着BMI的增加,eGFR水平逐步增高,差异有统计学意义(P<0.05),见表5。
表5 年龄相近不同BMI组间eGFR一般临床特征
Table 5 General clinical features of eGFR between groups with similar age and different BMI![]()
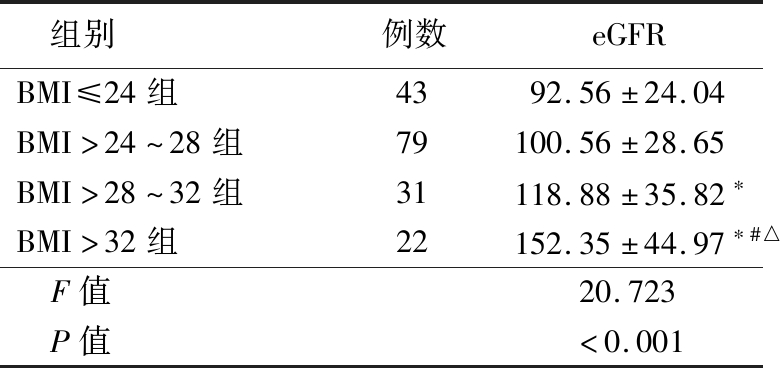
组别例数eGFRBMI≤24组4392.56±24.04BMI>24~28组79100.56±28.65BMI>28~32组31118.88±35.82∗BMI>32组22152.35±44.97∗#△F值20.723P值<0.001
*P值<0.05与≤24组比较 #P值<0.05与>24~28组比较 △P值<0.05与>28~32组比较(SNK-q检验)
3 讨 论
本研究结果提示,25(OH)D为糖尿病肾损伤的危险因素。25(OH)D反映维生素D活性,糖尿病肾病多继发维生素D缺乏,既往研究结果提示血清25(OH)D在2型糖尿病患者中体现低水平[6]。本研究提示高25(OH)D与eGFR呈负相关,考虑可能为机体一种代偿机制,是疾病发展中的一个阶段,需进一步研究。本研究结果提示UA为eGFR的危险因素,既往有研究表明糖尿病患者UA水平与尿蛋白水平呈正相关[7],UA为糖尿病肾病患者影响肾脏功能的独立危险因素[8],本研究结果与之一致,因此对于糖尿病患者应积极控制UA水平。既往研究表明高HCY是糖尿病肾病的危险因素之一[9],并有研究表明HCY与尿白蛋白排泄率呈正相关,对早期诊断糖尿病肾病具有重要意义[10]。既往研究提示大于9%,糖尿病肾病检出率明显增高[11],本研究结果提示HbA1c与eGFR呈负相关,与该研究结论一致,应积极控制血糖。
相近年龄组不同BMI组间比较提示,随着BMI的增高eGFR水平增高,可能与肥胖引起机体高代谢率有关,肾脏为高滤过状态。代谢综合征肾损害的临床表现包括肾小球高滤过、微量白蛋白尿、蛋白尿、肾小管功能改变、eGFR<60 mL·min-1·1.73m-2肾内血管阻力增加等[12]。国内外研究调查结果显示,肥胖症与eGFR增加有关[13]。有研究提示生活方式干预(包括饮食治疗、运动、戒烟、控制体重)有利于减缓糖尿病肾病的进展,保护肾功能[14]。本研究结果显示随着年龄的增高,BMI、转氨酶及UA水平逐步降低,提示代谢水平降低,与本课题组此前研究提示糖尿病患者随着病程增加,代谢水平降低的结论相近[15]。此外,有研究表明高中性粒细胞/淋巴细胞比值可能反映早期糖尿病肾病,炎性反应和内皮功能紊乱可能揭示糖尿病肾病的发病机制[16]。
本研究结果显示,性别与eGFR是负相关,可能由于男性吸烟、高血压、肥胖等高危因素较女性多所致。既往研究表明,高血压病程、收缩压、舒张压、餐后2 h血糖、TC及血UA是老年2型糖尿病患者肾功能异常的危险因素[17]。高血压及高血糖均可引起肾小球高滤过,从而引起肾小球损伤,故积极控制血压是减缓及预防糖尿病肾病发生及进展的重要措施。本研究结果提示,BMI、TG、ALT与eGFR呈正相关(P<0.001),提示肥胖及高TG早期引起肝细胞脂肪变性,未造成严重损伤,仅仅ALT升高,此时的eGFR增高也是由于机体高代谢状态引起的,待损伤进一步加重时,引起肝细胞线粒体损伤,从而出现AST增高,本研究显示,AST、GGT与eGFR呈正相关,提示糖尿病患者出现非酒精性脂肪性肝损时,肾功能同时受损。
糖尿病肾病防治分为三个阶段。第一个阶段为对重点人群进行糖尿病筛查,发现糖耐量异常或空腹血糖受损患者,采取生活方式干预及积极控制血糖,预防糖尿病及糖尿病肾病的发生。第二个阶段为糖尿病肾病的早期治疗,出现微量白蛋白尿患者,早期给于血管紧张素转化酶抑制剂(angiotensin-converting enzyme inhibitor,ACEI)类或血管紧张素受体拮抗剂(angiotensin receptor blocker,ARB)类药物及改善微循环药物治疗,可逆转或减少大量蛋白尿的发生。第三阶段为预防和延缓肾功能不全的发生和进展。糖尿病肾病的治疗以控制血糖、血压为主,还包括纠正脂质代谢异常,纠正贫血、低蛋白血症、高磷低钙等,ESRD主要依靠血液透析治疗。最新研究结果表明一级亲属糖尿病家族史与年轻患者eGFR快速下降独立相关[18]。因此早期发现及治疗对于糖尿病肾病诊治非常重要。
综上所述,2型糖尿病患者随着年龄增长,代谢水平及eGFR逐渐降低,AST、25(OH)D、UA、HCY为肾损伤的独立危险因素。年龄相近患者,肥胖患者较体重正常及超重者eGFR水平高。因此应积极控制体重、血UA、HCY及血糖,以减缓糖尿病肾病的发生与进展,减少ESRD的发病率。
[1] Hamzawy M,Gouda SAA,Rashid L,et al. The cellular selection between apoptosis and autophagy:roles of vitamin D,glucose and immune response in diabetic nephropathy[J]. Endocrine,2017,58(1):66-80.
[2] 中华医学会糖尿病学分会微血管并发症学组.糖尿病肾病防治专家共识(2014年版)[J].中国糖尿病杂志,2014,6(11):792-801.
[3] 王鲁伃.2型糖尿病合并早期糖尿病肾病的相关危险因素分析[J].影像研究与医学应用,2018,5(2):209-210.
[4] 朱晓荣.糖尿病肾病危险因素及血压控制临界值研究[J/CD].临床医药文献电子杂志,2018,39(5):69.
[5] 李小勇,沈鹏,林鸿波,等.宁波社区2型糖尿病患者发生糖尿病肾病危险因素调查[J].浙江大学学报(医学版),2018,47(2):163-168.
[6] 曾艳,赵韶静,李正东.2型糖尿病肾病患者25-羟维生素D水平变化及意义[J].临床肾脏病杂志,2018,18(12):770-774.
[7] 李红艳,凌凯,徐月霞,等.血清尿酸与糖尿病肾病相关性[J].中国老年学杂志,2019,39(6):1321-1323.
[8] 罗立,冯锦红,孔刘莎,等.β-catenin和cadherin蛋白联合血尿酸检测对DN预后的评估[J].临床输血与检验,2019,21(2):180-183.
[9] 范佳双.2型糖尿病患者高同型半胱氨酸与糖尿病血管病变相关性研究进展[J].云南医药,2019,40(1):81-84.
[10] 吴福杉,苏虹梅,陈婷丽.血清胱抑素C和同型半胱氨酸水平与早期糖尿病肾病的关系[J].海南医学,2017,28(2):214-216.
[11] 黄晓雯,张雪,叶洪波.糖化血红蛋白、尿微量白蛋白、空腹血糖与糖尿病肾病的关系[J].标记免疫分析与临床,2019,26(1):83-85,106.
[12] 庄永泽.重视代谢综合征肾损害的诊治[J].肾脏病与透析肾移植杂志,2018,27(4):344-345.
[13] 史永红,吴广礼,王丽晖.肥胖相关性肾病流行病学现状及发病机制研究进展[J].解放军医药杂志,2018,30(7):110-113.
[14] Andresdottir G,Jensen ML,Carstensen B,et al. Improved survival and renal prognosis of patients with type 2 diabetes and nephropathy with improved control of risk factors[J]. Diabetes Care,2014,37(6):1660-1667.
[15] 郭哲,常薪霞,夏明锋,等.不同病程2型糖尿病伴脂肪肝患者代谢参数与胰岛功能的相关性分析[J].中国临床医学,2018,25(1):65-69.
[16] 赵万霞,王何婷,任月秋,等.糖尿病肾病早期标志物研究新进展[J].国际内分泌代谢杂志,2018,38(3):192-195.
[17] Chai T,Zhang D,Li Z. Aanlysis on influencing factors of abnormal renal function in elderly patients with type 2 diabetes mellitus[J]. Minerva Endocrinol,2018,43(2):117-125.
[18] Wang Y,Zhao L,Zhang J,et al. Implications of a family history of diabetes and rapid eGFR decline in patients with type 2 diabetes and biopsy-proven diabetic kidney disease[J]. Front Endocrinol,2019,10:855.