胃癌是发生于胃黏膜上皮的一种常见恶性肿瘤,其在胃恶性肿瘤中占95%以上,在消化道恶性肿瘤疾病中占首位[1]。胃黏膜上皮细胞的凋亡与增殖通常情况下保持动态平衡,而一些生长因子、癌基因及抑癌基因的共同调控是维持这种平衡的关键[2]。细胞周期是一个经高度有序、严格调控的过程,而细胞的间接分裂对肿瘤细胞扩增中发挥着重要的调节作用,间接分裂的偏差会造成基因组不稳定而引发肿瘤。p27是一个细胞周期的负性调控因子,会随着细胞周期进展的变化而变化,对于多种细胞周期激酶和蛋白的活性具有较好的抑制作用,因此p27被认为是一种抑癌基因[3]。世界卫生组织(World Health Organization,WHO)于1994年宣布人类胃癌的Ⅰ类致癌原为幽门螺杆菌(Helicobacter pylori,H.pylori),但目前尚不明确H.pylori引起胃癌的发病机制。本研究旨在探讨H.pylori感染与胃癌癌组织中p27蛋白表达的关联性,了解H.pylori感染引起胃癌的发病机制,报告如下。
1 资料与方法
1.1 一般资料 选取2017年1月—2018年12月在我院行胃癌切除术的胃癌组织标本共62例(胃食管交界46例,远端组织16例),其中男性32例,女性30例,年龄34~75岁,平均(59.40±2.10)岁;TNM分期为Ⅰ、Ⅱ期23例,Ⅲ、Ⅳ期39例;胃癌组织分化程度:低分化25例,高、中分化37例。所有患者术前均无服用非甾体抗炎药物及接受抗H.pylori治疗,且临床资料完整。另选择癌旁组织(距离肿瘤边缘2.5~5 cm)标本42例,男性20例,女性22例,年龄 35~72岁,平均(58.60±1.80)岁。 胃癌组织标本与癌旁组织标本差异无统计学意义(P>0.05),具有可比性。
1.2 方法
1.2.1 H.pylori检测 采用14C-尿素酶呼气(14C-UBT,)方法,14C-UBT检测仪为深圳市中核海得威生物科技有限公司生产。患者在空腹6 h后采集100 mL呼气,服用14C之后再采集100 mL呼气,密封待检;将收集的呼气装置与C红外线能谱仪检测孔连接进行自动检测,设备检测完成之后自动生成检测报告,其中阳性值为DOB>2.5[4]。病理组织染色处理:采用改良Giemsa染色处理方法,标本使用10%甲醛进行固定,梯度乙醇脱水-石蜡包埋-切片(厚度4 μm),行姬姆萨染色处理。处理步骤[5]:第一步将石蜡切片行常规脱蜡、脱水处理,然后加入2% Ciemsa染色剂,浸泡30 min;染色完成后使用自来水清洗,迅速使用纯酒精脱水及二甲苯处理,促使切片透明,最后行树胶封固。在油镜下(×1 000)观察H.pylori感染情况,看见小杆菌为确诊感染。
1.2.2 p27蛋白表达检测 采用福州迈新生物技术开发有限公司生产的快捷法通用型二抗、鼠抗人p27单克隆抗体试剂盒及北京中杉金桥生物技术生产的氨基联苯胺显色试剂盒[6]。用微波炉进行抗原修复,按试剂盒说明书进行免疫组织化学检测,并由2名专业病理医师进行结果判定。胃癌组织中细胞核和细胞浆出现棕黄色染色为p27蛋白表达阳性。癌旁组织中细胞胞核和胞浆中呈明显棕色颗粒状为p27表达阳性。免疫组织化学染色评分根据以下3个方面进行判定;①阳性细胞百分比评分:0分,0%;1分,<10%;2分,10%~50%;3分,51%~90%;4分,>90%;②染色密度评分:0分,无染色;1分,弱染色;2分,中染色;3分,强染色;③染色方式评分:0分,无染色;1分,散在染色;2分,局灶染色;3分,弥漫染色。每例标本的染色积分=①×②×③,其中阳性为1~36分,阴性为0分。
1.3 统计学方法 应用SPSS 19.0统计软件处理数据。计数资料比较采用χ2检验,相关性分析应用线性相关性分析,影响因素确定采用多因素Logistic回归分析。P<0.05为差异有统计学意义。
2 结 果
2.1 H.pylori检测结果 62例胃癌患者均行14C-UBT检测,结果显示,H.pylori感染40例,感染率为64.52%。
2.2 不同临床病理特征胃癌患者p27蛋白表达情况比较 高、中分化胃癌患者p27蛋白表达率高于低分化胃癌患者,差异有统计学意义(P<0.01);不同性别、年龄、肿瘤大小、TNM分期、肿瘤浸润深度及淋巴结胃癌患者p27蛋白表达率差异无统计学意义(P>0.05)。见表1。
表1 不同临床病理特征胃癌患者p27蛋白表达情况比较
Table 1 Comparison of p27protein expression in gastric cancer patients with different clinicopathological characteristics (例数,%)
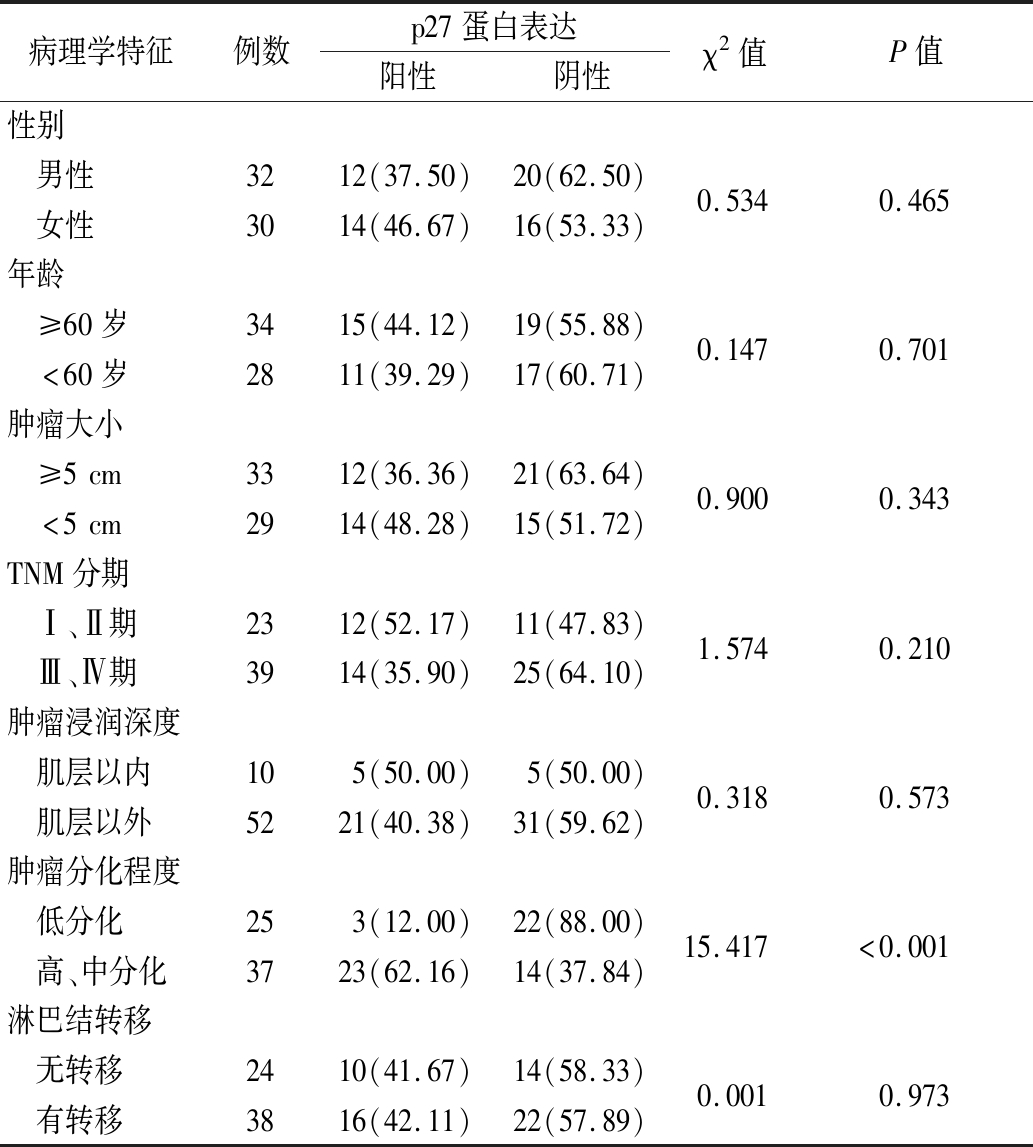
病理学特征例数p27蛋白表达阳性阴性χ2值P值性别 男性 女性323012(37.50)14(46.67)20(62.50)16(53.33)0.5340.465年龄 ≥60岁 <60岁342815(44.12)11(39.29)19(55.88)17(60.71)0.1470.701肿瘤大小 ≥5cm <5cm332912(36.36)14(48.28)21(63.64)15(51.72)0.9000.343TNM分期 Ⅰ、Ⅱ期 Ⅲ、Ⅳ期233912(52.17)14(35.90)11(47.83)25(64.10)1.5740.210肿瘤浸润深度 肌层以内 肌层以外10525(50.00)21(40.38)5(50.00)31(59.62)0.3180.573肿瘤分化程度 低分化 高、中分化25373(12.00)23(62.16)22(88.00)14(37.84)15.417<0.001淋巴结转移 无转移 有转移243810(41.67)16(42.11)14(58.33)22(57.89)0.0010.973
2.3 胃癌癌组织中 H.pylori感染与p27蛋白表达的相关性 H.pylori感染与胃癌癌组织中p27蛋白表达呈负性相关(P<0.01)。见表2。
表2 胃癌癌组织中H.pylori感染与p27蛋白表达的相关性
Table 2 Correlation between H.pyloriinfection and p27protein expression in gastric cancer tissues (例数)
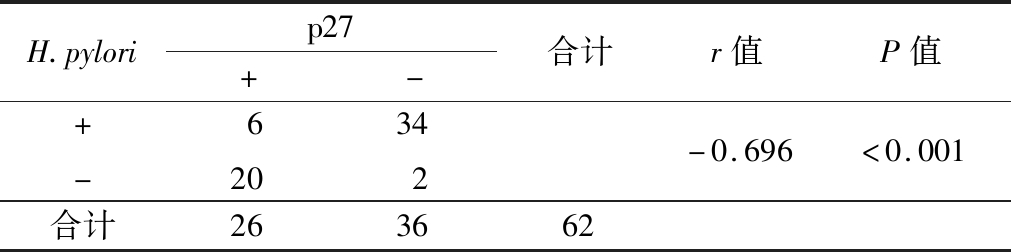
H.pylorip27+-合计r值P值+-620342-0.696<0.001合计263662
2.4 p27在胃癌组织和癌旁组织中的表达比较 p27在胃癌组织中的表达率明显低于癌旁组织,差异有统计学意义(P<0.01),见表3。
表3 p27在胃癌组织和癌旁组织中的表达比较
Table 3 Comparison of expression of p27in stomach cancer tissue and cancerside tissue (例数,%)
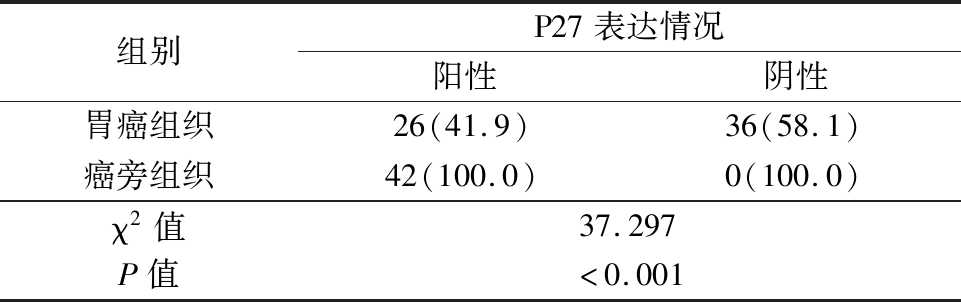
组别P27表达情况阳性阴性胃癌组织26(41.9)36(58.1)癌旁组织42(100.0)0(100.0)χ2值37.297P值<0.001
2.5 多因素Logistic回归分析 以p27蛋白表达(阴性=0,阳性=1)的因变量,以肿瘤分化程度(低分化=0,高、中分化=1)为自变量,进行多因素Logistics回归分析,结果显示肿瘤分化程度是胃癌组织p27蛋白阳性表达的危险因素(P<0.01),见表4。
表4 多因素Logistic回归分析
Table 4 Multiple logistic regression analysis
病理学特征回归系数回归系数标准误Waldχ2值P值OR值95%CI肿瘤分化程度2.0640.41225.097<0.0017.8773.513~17.664
3 讨 论
H.pylori为一种定植于胃黏膜的革兰阴性螺旋细长微弯杆菌[7]。目前,我国H.pylori感染率达50%~80%,且随着人们生活方式和饮食习惯的改变,其感染率呈逐渐升高趋势[8]。H.pylori是引起慢性胃炎、消化性溃疡、胃癌及胃淋巴瘤的主要原因之一,也是导致胃癌发生并发展的Ⅰ类致病源,因其具有强烈的黏附性,且分泌的毒素具有致病性,故极易导致胃黏膜病变,一般癌变顺序是由慢性炎症发展为萎缩性胃炎,进而发展到萎缩性胃炎伴肠化,最终发展为癌变,被WHO列为人类Ⅰ类致癌因子[9]。
通常恶性肿瘤的发生是多种因素共同作用的结果。李晓琴等[10]研究表明,H.pylori感染是胃癌发生的重要危险因素之一,胃癌患者中约70%与H.pylori感染有关。H.pylori感染引起的胃癌发生有多种机制,主要与人体抑癌基因的失活和内癌基因的激活及突变有关,其中抑癌基因主要包括野生型p53、p27、抑癌基因(deleted in colorectal carcinoma,DCC)、结肠腺瘤样息肉病基因(adenomatous polyposis coli, APC)等,内癌基因主要包括c-myc、ras基因和Bcl-2活化[11]。其中抑癌基因p27是近年来新发现的CKI基因,属于细胞周期蛋白依赖性激酶(cyclin-dependent kinase in-hibitors,CDK)抑制剂之一,定位于人体内部12p13交界处,主要包含1个内含子、1个无功能的外显子和2个有编码功能的外显子。研究发现[12],p27蛋白可通过作为细胞外刺激信号的潜在媒介对细胞周期进行调控,同时作为调控细胞周期的负性调控因子,具有抑制肿瘤发生发展的作用,还可以抑制细胞周期素-CDK复合物的生物学活性[13]。且通过研究肺癌、乳腺癌和内分泌肿瘤,可发现p27蛋白的表达与肿瘤的生长、分化及预后密切相关[14]。此外,p27蛋白表达水平在细胞周期G1/S的重要转换中降低,则无法阻断细胞增殖和分裂,而导致肿瘤形成。据研究表明[15],抑癌基因的缺失或减少及细胞凋亡是癌症发生发展的2个重要因素,作为抑癌基因之一的p27蛋白下降可增加细胞周期蛋白-CDK2复合物活性,对细胞的增殖具有促进作用,最终演变成肿瘤。p27表达在胃癌进展过程中逐渐降低使癌细胞分化越低、淋巴结转移更快、恶性程度越高,而导致胃癌的转移或进展。
黄虎等[16]研究发现,长期慢性H.pylori感染可致p27胞浆错位,使p27从抑癌转变为癌基因,导致胃癌的发生,并促使了胃癌的进一步发展。孔凡立等[17]研究发现,H.pylori感染可能影响p27表达,促进胃肿瘤细胞增殖。本研究结果显示,胃癌组织中H.pylori感染与p27蛋白表达呈负相关,表明H.pylori感染极易引起胃黏膜抑癌基因p27表达降低或缺失,从而导致胃黏膜癌变发生。此外,多因素Logistics回归分析结果显示,肿瘤分化程度为胃癌癌组织p27蛋白阳性表达的影响因素。表明p27蛋白表达与肿瘤分化程度有关。H.pylori感染引起胃癌的机制可能为H.pylori感染导致p27丧失调控细胞周期的负性调控因子的抑癌作用,还可能为H.pylori感染导致p27降低引起细胞黏附性和细胞外基质降低,导致肿瘤浸润并转移[18]。
综上所述,胃癌的发生发展与p27缺失或凋亡减少有关,p27蛋白表达水平与H.pylori感染存在一定的关联性,p27蛋白可作为临床诊断胃癌及是否合并H.pylori感染的辅助指标,在疾病后期诊断、治疗及预后评估中具有重要价值,值得推广应用。
[1] 刘润,高海燕,韩淑琴,等.p27蛋白及细胞凋亡指数在慢性胃病及胃癌患者胃黏膜中的表达及临床意义[J].河北医药,2018,40(11):1642-1645.
[2] 陈思远,济安.诱导的细胞自噬机制在抗癌治疗中的应用进展[J].浙江大学学报(农业与生命科学版),2016,42(6):694-702.
[3] 黄建民.13C呼气试验和血清学检验幽门螺旋杆功的结果分析[J].标记免疫分析与临床,2016,23(12):1481-1482.
[4] 蒋世烨,孙为豪.幽门螺杆菌感染和环氧化酶-2在胃癌发生中的作用研究进展[J].东南国防医药,2019,21(4):392-396.
[5] 张灿.胃蛋白酶原联合幽门螺杆菌IgG抗体检验在胃癌筛查中的价值[J].影像研究与医学应用,2018,2(5):207-208.
[6] 李俊,姚保栋,李为希,等.血清幽门螺杆菌抗体、胃蛋白酶原、胃泌素-17检测对5552名社区胃癌高危人群的筛查研究[J].中国肿瘤,2019,28(8):629-635.
[7] 宗燕.幽门螺杆菌感染与胃癌前病变、胃癌的关系分析[J].影像研究与医学应用,2018,2(10):12-13.
[8] 杜春,崔洁,陈平,等.血清胃功能三项联合Hp检测在胃癌筛查中的临床研究[J].内蒙古医科大学学报,2019,41(3):281-283.
[9] Shan JH,Bai XJ,Han LL,et al .Changes with aging in gastric biomarkers levels and in biochemical factors associated with Helicobacter pyloriinfection in asymptomatic ChNISE population[J]. World J Gastroentero,2017,23(32):5945-5953.
[10] 李晓琴,单文杰,董文福,等.胃蛋白酶原和胃泌素对萎缩性胃炎、胃癌的筛查价值及与幽门螺旋杆菌感染的关系[J].宁夏医科大学学报,2017,39(9):1062-1065.
[11] 胡桂梅,叶国良,秦丽君.Stathmin和p27在胃癌演变过程中的表达变化及与Hp感染的关系[J].浙江医学,2016,38(17):1393-1396.
[12] 王书彩,朱希燕,李琛琮,等.血清胃泌素17及胃蛋白酶原联合14C呼气试验在健康体检人群胃癌筛查中的价值研究[J].中国全科医学,2018,21(13):1585-1588.
[13] 周丽雅,肖士渝.幽门螺杆菌与胃癌的研究进展[J].临床内科杂志,2018,35(12):797-799.
[14] 李正义,李颖毅,罗成,等.前列腺癌组织中p27、bcl-2蛋白的表达水平及临床意义[J].中国实验诊断学,2019,23(6):954-956.
[15] 乔正梅,王登峰,赵秋剑,等.血清胃蛋白酶原、胃泌素-17在胃癌及胃癌前病变的诊断价值[J].中国卫生检验杂志,2017,27(2):198-200.
[16] 黄虎,栗娜,杨柳,等.非小细胞肺癌组织中NF-κB和CyclinD1及p27表达与患者化疗敏感性[J].贵州医科大学学报,2019,44(2):195-199.
[17] 孔凡立,李铮.血清胃蛋白酶原检测对幽门螺杆菌感染相关高危胃癌患者的诊断效果研究[J].中华医院感染学杂志,2019,29(16):2468-2472.
[18] 李光艳,薛明辉,张兰芳,等.胃癌组织中IFN-γ、IL-4、SOX-2蛋白的表达特点及与Hp感染的相关性[J].实验与检验医学,2019, 37(3):430-432,452.