妊娠期高血压疾病(hypertensive disorder complicating pregnancy,HDCP)是妊娠期常见并发症之一,包括妊娠期高血压、子痫、子痫前期以及慢性高血压并发子痫前期等[1-3]。HDCP主要临床表现为高血压、水肿、尿蛋白等。流行病学调查研究发现,世界范围内HDCP发病率为8%~10%,国内发病率为9.4%~10.4%,且随着社会发展,其发病率呈不断上升趋势[4]。资料显示,重度子痫前期及子痫孕妇分娩的新生儿病死率为3.36%~5.89%,而妊娠期高血压及轻度子痫前期孕妇分娩的新生儿病死率高达17.8%~21.25%,严重威胁新生儿的生命健康[5]。HDCP可导致新生儿出现不同程度的血液学变化,激活凝血系统及纤溶系统,进而导致新生儿凝血系统的平衡被打破,引发凝血功能障碍,最终造成新生儿出血以及血栓性疾病。既往对于HDCP的研究主要集中在对母体及胎盘的影响,而对新生儿影响的相关研究报道尚少,但当此类患儿出现凝血功能障碍相关临床表现时,往往已错过最佳治疗时机,增加治疗难度及后遗症发生风险。降钙素原(procalcitonin,PCT)早已运用于感染性疾病的早期诊断[6]。目前已有研究发现,HDCP孕产妇体内PCT水平较正常时偏高[7]。HDCP孕妇还可增加新生儿窒息、脑损伤的发生风险。神经元特异性烯醇化酶(neuron-specific enolase,NSE)作为早期评价缺氧缺血性脑病的生化指标之一,已有研究报道新生儿脑损伤患儿NSE水平有所上升[8]。但目前尚无研究探讨PCT、NSE与HDCP孕产妇分娩的新生儿之间的相关性。基于此,本研究探讨HDCP对新生儿凝血功能、NSE及PCT水平的影响,旨在为临床上诊治提供相关依据。
1 资料与方法
1.1 一般资料 选择2017年1月—2019年1月河北省石家庄市妇幼保健院重症监护室(intensive care unit,ICU)收治的HDCP患者分娩的新生儿592例为观察对象。纳入标准:①新生儿未注射维生素K1;②孕产妇患有HDCP但未合并其他影响新生儿凝血功能障碍疾病者。排除标准:①出生后1周内死亡者;②新生儿患有严重先天性代谢性疾病者;③孕产妇患有其他严重疾病者;④孕产妇在妊娠期服用过可能影响研究结果者。根据产妇病情严重情况将新生儿分为3组:A组(重度子痫前期,112例)、B组(轻度子痫前期,197例)、C组(HDCP,283例),选取同期未患有HCDP的产妇所分娩的新生儿500例为对照组。4组研究对象在一般资料上比较差异无统计学意义(P>0.05),见表1。
本研究通过医院伦理委员会批准。所纳入对象家属知情,并签署知情同意书。
表1 4组一般资料比较
Table 1 Comparison of four groups of general data
组别例数分娩方式(例数,%)自然分娩剖宫产性别(例数,%)男性女性母亲年龄(x-±s,岁)出生体质量(x-±s,kg)胎龄(x-±s,周)A组 11291(81.25)21(18.75)60(53.57)52(46.43)27.91±2.242.24±0.3635.22±2.23B组 197154(78.17)43(21.83)105(53.30)92(46.70)28.03±2.512.26±0.3135.17±2.54C组 283225(79.51)58(20.49)151(53.36)132(46.64)28.11±2.332.27±0.5235.28±2.17对照组500413(82.60)87(17.40)261(52.20)239(47.80)27.98±2.622.31±0.4735.33±2.09χ2/F值2.2440.1530.2401.1940.274P值0.5230.9850.8690.3110.843
1.2 方法 所有研究对象于出生2 h内采集股静脉血2 mL,采用普利生C2000-A全自动血凝分析仪检测凝血功能指标[凝血酶原时间(prothrombin time,PT)、活化部分凝血激酶时间(activated partial thromboplastin time,APTT)、纤维素原(Fibrinogen,FIB)、D-二聚体(D dimer,D-D)、血小板计数(platelet count,PLT)、纤维蛋白原降解产物(fibrinogen degradation product,FDP)]。采用酶联免疫吸附法检测血清PCT及NSE水平。本研究所用试剂盒均购于上海碧云天生物科技有限公司。
1.3 统计学方法 应用SPSS 22.0统计软件分析,多组间计量资料比较采用F检验,组间两两比较,若方差齐性,采用LSD检验,若方差不齐,采用Dunnett-t3检验,计数资料采用χ2检验,采用Spearman相关法分析各指标相关性。P<0.05为差异有统计学意义。
2 结 果
2.1 不同严重程度HDCP孕产妇分娩的新生儿各指标水平比较 与对照组比较,A、B、C组PT、APTT、D-D、FDP、PCT及NSE水平更高,而FIB及PLT水平更低,差异有统计学意义(P<0.05),且随着病情程度的加重,研究对象PT、APTT、D-D、FDP、PCT及NSE水平有所上升,而FIB及PLT水平有所下降,见表2。
表2 不同严重程度HDCP孕产妇分娩的新生儿各指标水平情况
Table 2 Levels of neonatal indicators of different severity HDCP maternal delivery![]()
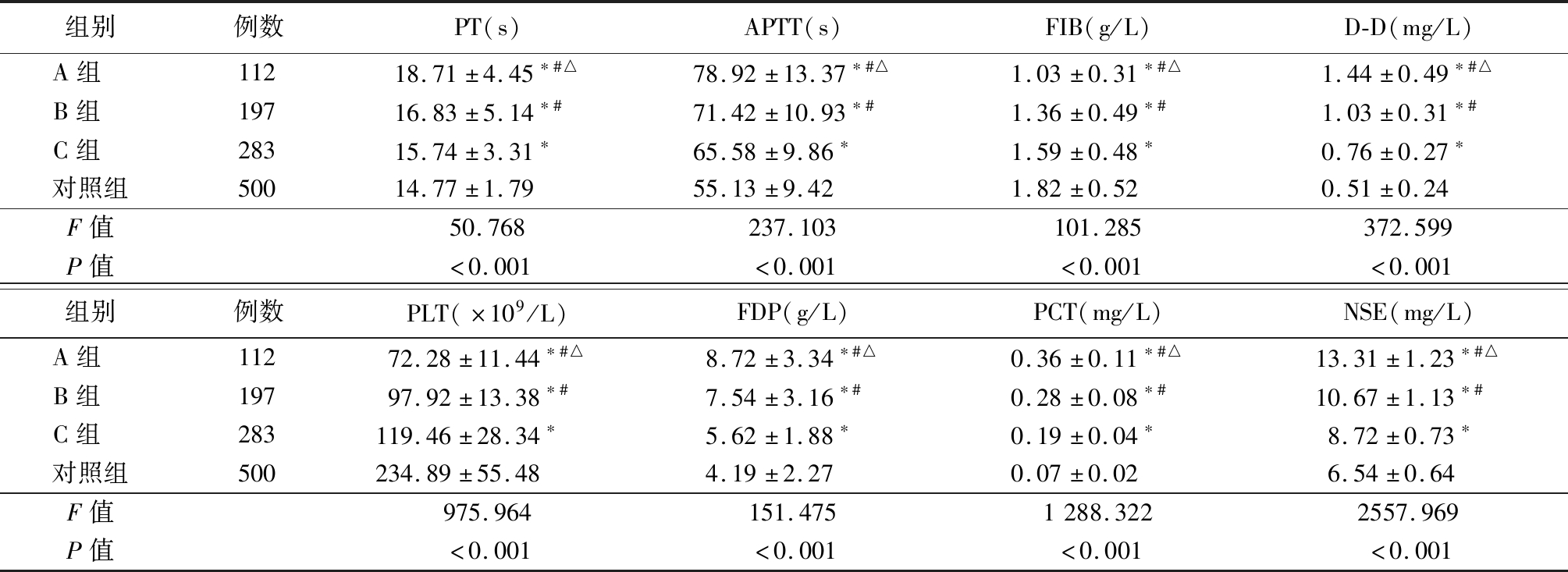
组别例数PT(s)APTT(s)FIB(g/L)D-D(mg/L)A组 11218.71±4.45∗#△78.92±13.37∗#△1.03±0.31∗#△1.44±0.49∗#△B组 19716.83±5.14∗#71.42±10.93∗#1.36±0.49∗#1.03±0.31∗#C组 28315.74±3.31∗65.58±9.86∗1.59±0.48∗0.76±0.27∗对照组50014.77±1.7955.13±9.421.82±0.520.51±0.24F值50.768237.103101.285372.599P值<0.001<0.001<0.001<0.001组别例数PLT(×109/L)FDP(g/L)PCT(mg/L)NSE(mg/L)A组 11272.28±11.44∗#△8.72±3.34∗#△0.36±0.11∗#△13.31±1.23∗#△B组 19797.92±13.38∗#7.54±3.16∗#0.28±0.08∗#10.67±1.13∗#C组 283119.46±28.34∗5.62±1.88∗0.19±0.04∗8.72±0.73∗对照组500234.89±55.484.19±2.270.07±0.026.54±0.64F值975.964151.4751288.3222557.969P值<0.001<0.001<0.001<0.001
*P值<0.05与对照组比较 #P值<0.05与C组比较 △P值<0.05与B组比较(LSD检验或Dunnett-t3检验)
2.2 各指标与HDCP病情严重程度相关性 相关性分析结果显示,PT、APTT、D-D、FDP、PCT及NSE水平与HDCP病情严重程度呈正相关,而FIB、PLT水平与HDCP病情严重程度呈负相关(P<0.05或P<0.01),见表3。
表3 各指标与HDCP病情严重程度相关性
Table 3 Correlation between indicators and severity of HDCP

指标PTAPTTFIBD-DPLT(×109/L)FDPPCTNSEr值0.5740.668-0.6740.729-0.7130.5580.6240.526P值0.0210.014<0.0010.0050.012<0.0010.023<0.001
3 讨 论
HDCP是一类妊娠期特有疾病,其发病机制可能为血管内皮细胞损伤导致血管收缩、舒张功能异常,进而引发全身小血管痉挛以及组织缺氧[9-10]。全身小血管痉挛以及组织缺氧又会导致子宫-胎盘灌注障碍,进而胎盘功能下降,胎儿氧及营养物的摄取减少,最终导致宫内生长迟缓、新生儿窒息、宫内窘迫、流产、早产等不良妊娠结局[11]。
正常生理条件下,机体的纤溶系统及凝血系统处于动态平衡状态。而HDCP可能会激活新生儿纤溶系统及凝血系统,导致凝血功能障碍,严重时甚至发生弥漫性血管内凝血[12]。重度HDCP孕产妇分娩的新生儿发生凝血功能障碍风险更高,且肺出血、脑出血等疾病的发生率升高[12]。因此,对于这一类新生儿进行早期凝血功能指标检测有利于早发现、早诊断凝血功能障碍。
APTT和PT作为反映机体内、外源性凝血途径中的相关凝血因子水平及活性的指标之一,已经广泛用于凝血功能的检测。PT主要反映来源于组织中的凝血因子Ⅰ、Ⅱ、Ⅴ、Ⅶ及Ⅹ水平,而APTT主要反映来源于血液中的凝血因子Ⅷ、Ⅸ、Ⅺ及Ⅻ水平。由于HDCP孕产妇分娩的新生儿发生窒息的风险较高,当新生儿缺氧时会导致肝脏合成的凝血因子水平减少,特别是维生素K依赖性凝血因子Ⅱ、Ⅶ、Ⅸ及Ⅹ。本研究结果显示,相较于对照组,HDCP孕产妇分娩的新生儿APTT及PT水平显著下降,并与病情严重程度呈正相关。研究发现,PLT可聚集并黏附于出血部位促进止血,而活化后的PLT及其裂解产物具有很好的凝血功能,因此临床上将PLT计数作为评估患者出血风险的指标之一[13]。FIB是由肝脏合成的内外源凝血系统共同途径的最终底物,可调节血浆黏滞度。其在凝血酶的作用下可生成纤维蛋白,从而直接参与凝血过程。HDCP孕产妇极易发生早产,对于这一类患儿其各个组织器官尚未发育完善,进而导致血浆纤维蛋白清除率过高。而由于HDCP孕产妇分娩的新生儿凝血功能系统被激活,导致新生儿处于低凝状态以及继发性纤溶状态,FIB被大量消化。本研究结果显示,相较于对照组,HDCP孕产妇分娩的新生儿PLT及FIB水平显著下降,并与病情严重程度呈负相关。这也提示HDCP孕产妇分娩的新生儿存在低凝及继发性纤溶亢进。FDP和D-D是由FIB和纤维蛋白在纤维溶每作用下所产生的一类反映纤溶系统状态的活性物质。D-D主要反映机体凝血功能及纤溶蛋白溶解系统活化,具有敏感度、特异度高的特点。正常生理条件下,机体D-D水平极低,而一旦其水平快速上升,往往可反映机体血栓形成及血管内高凝状态。而FDP可减弱血小板及凝血酶聚集能力,从而抑制纤维蛋白多聚体的产生。正常生理条件下,FDP可预防微循环内血栓的形成,HDCP孕产妇由于血管内皮细胞发生损伤,激活凝血系统,最终导致FDP水平上升。本研究结果显示,相较于对照组,HDCP孕产妇分娩的新生儿FDP及D-D水平显著下降,并与病情严重程度呈正相关。提示HDCP孕产妇病情越严重,其分娩的新生儿纤溶系统越亢进。
PCT作为早期诊断感染性指标之一,具敏感度、特异度、准确度高的特点。正常机体血清PCT水平极低,而一旦机体发生感染时,其水平快速上升,并在24 h内达到峰值[14]。目前PCT检测已广泛运用于临床各个学科的诊断中。HDCP孕产妇可增加新生儿发生感染风险,因此通过检测新生儿PCT水平可早期发现及诊断,为临床治疗提供可靠依据。HDCP可导致新生儿出现缺氧缺血性脑损伤,而这一类患儿在出生后可导致多种新生儿疾病,特别是中枢神经系统。因此早期发现HDCP对新生儿的影响,预测新生儿脑损伤的发生风险对提高新生儿生命质量,改善生长发育至关重要。NSE是一类与神经功能受损及维护密切相关的指标,研究发现,NSE不仅存在于神经系统中,其在胎盘、脐带组织也有所表达。正常生理条件下,NSE在机体体液中表达水平极低,而当机体出现脑损伤时,NSE将从受损的神经元中渗出,进而通过血-脑脊液屏障进入到血液循环中[15]。已有研究证实,血液NSE水平在诊断脑损害程度中具有敏感度、特异度高的特点[16]。因此,本研究也探讨了NSE及PCT在不同程度HDCP所分娩的新生儿中的表达情况。结果显示,相较于对照组,HDCP孕产妇分娩的新生儿PCT及NSE水平显著下降,并与病情严重程度呈正相关。这也提示HDCP可能增加新生儿感染及脑损伤的发生风险。
综上所述,HDCP易导致新生儿凝血功能障碍,使新生儿血液处于低凝和继发性纤溶亢进的状态,并会增加新生儿脑损伤及感染发生风险。且孕产妇病情越严重,新生儿越易导致凝血功能障碍及脑损伤。但本研究也存在样本量较小等不足,因此仍需后续研究加以证实。
[1] 谢幸,孔北华,段涛.妇产科学[M].9版.北京:人民卫生出版社,2018:83-91.
[2] 崔世红,高亚南,张琳琳,等.不同类型子痫前期患者胎盘组织内NFAT5、MCP-1的表达[J].郑州大学学报(医学版),2017,52(2):183-187.
[3] Benschop L,Bergen NE,Schalekamp-Timmermans S,et al. Maternal lipid profile 6 years after a gestational hypertensive disorder [J]. J Clin Lipidol,2018,12(2):428-436.
[4] Leas smiranda A,Méndezaguilar F,Ramírezvalenzuela KL,et al. Circulating angiogenic factors are related to the severity of gestational hypertension and preeclampsia,and their outcomes[J]. Medicine,2017,96(4):60-63.
smiranda A,Méndezaguilar F,Ramírezvalenzuela KL,et al. Circulating angiogenic factors are related to the severity of gestational hypertension and preeclampsia,and their outcomes[J]. Medicine,2017,96(4):60-63.
[5] 纪叶霞.早发型重度子痫前期患者不同孕周终止妊娠对母婴结局的影响[J].中国妇幼保健,2017,32(1):32-34.
[6] Shokri M,Ghasemian R,Bayani M,et al. Serum and alveolar procalcitonin had a weak diagnostic value for ventilatorassociated pneumonia in patients with pulmonary infection score≥6[J]. Rom J Intern Med,2018,56(1):9-14.
[7] 王霞,李庆,麦燕,等.25羟维生素D 和降钙素原在妊高症孕妇体内的表达及临床意义研究[J].标记免疫分析与临床,2018,25(7):1042-1047.
[8] Elhawary IM,Abdel Ghany EAG,Aboelhamed WA,et al. Incidence and risk factors of post-phototherapy neonatal reboundhyperbilirubinemia[J]. World J Pediatr,2018,14(4):350-356.
[9] He Y,Liu J,Cai Q,et al. The pregnancy outcomes in patients with stage 3-4 chronic kidney disease and the effects of pregnancy in the long-term kidney function[J]. J Nephrol,2018,31(6):953-960.
[10] 刘强,张登洪,杨小梅,等.尿微量白蛋白/肌酐比值及β2-微球蛋白联合检测对妊娠期高血压疾病早期肾损伤的临床价值[J].四川医学,2017,38(1):69-71.
[11] Sovio U,Gaccioli F,Cook E,et al. Prediction of preeclampsia using the soluble fms-like tyrosine kinase 1 to placental growth factor ratio:aprospective cohort study of unselected nulliparous women[J]. Hypertension,2017,69:731-738.
[12] 牟凤萍,冯丽娟.不同胎龄早产儿早期凝血功能的变化及临床意义[J].中国妇幼保健,2017,32(16):3803-3805.
[13] 欧容,徐酉华.新生儿继发性凝血功能障碍病因研究进展[J].儿科药学杂志,2016,22(4):47-49.
[14] Wu G,Wu G,Wu S,et al. Comparison of procalcitonin guidance-administered antibiotics with standard guidelines on antibiotic therapy in children with lower respiratory tract infections:a retrospective study in china[J]. Med Princ Pract,2017,26(4):316-320.
[15] Mahmoodpoor A,Shokouhi G,Hamishehkar H,et al. A pilot trial of l-carnitine in patients with traumatic brain injury:Effects on biomarkers of injury [J]. J Crit Care,2018,9(45):128-132.
[16] 黄海英,陈尚明,刘永华,等.NSE和HMGB1在妊娠高血压病产妇的新生儿脑损伤中的诊断价值[J].江苏医药,2016,42(1):44-46.