周围神经损伤(peripheral nerve injury,PNI)是临床上较为多见的创伤,每年新增创伤患者超过千万,其中合并PNI的高达2.8%[1],是一种常见的致残性疾病,常见的有腓总神经损伤、臂丛神经损伤、桡神经损伤、股神经损伤等。PNI常伴神经的缺血缺氧性损伤,尤其是挤压伤后,引起该神经支配区域早期出现运动感觉障碍,晚期出现营养(植物神经功能)障碍[2]。周围神经与中枢神经不同,其具有损伤后神经再生的能力,肌神经纤维断裂之后,细胞和分子生物学一系列变化在神经断端远侧和近侧纤维出现,新的突触联系在相应的靶器官和再生的轴突之间重新建立[3]。临床上促进PNI后再生和修复的方法种类繁多,目前国内外主要方法是桥接神经断端,促进神经轴突再生,克服再生屏障为神经再生提供了良好的基础,但是神经再生的速度并不能因此而显著加快[4],因此怎样使PNI后轴突的再生速度加快,是PNI修复的临床治疗研究重点。PNI后神经营养因子参与神经元再生、生长及分化,发挥其特异生物学功能,神经细胞轴索在神经损伤后中断,可产生大量脑源性神经营养因子[5]。这些脑源性神经营养因子和神经生长因子(nerve growth factor,NGF)、碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)在构成良好微环境中起重要作用,在神经损伤后单独或协同作用保护神经元、促进轴突再生。经颅磁刺激原理是人体在磁场的作用下,受损神经组织兴奋,促进神经轴突的再生,使受损神经功能恢复加速,因此可被用于PNI的治疗中[6]。本实验旨在探讨重复经颅磁刺激治疗兔腓总神经损伤的疗效及对NGF和bFGF的影响。
1 材料与方法
1.1 一般资料 普通级健康雄性Sprague-Dawley新西兰兔80只,随机分为2组,每组40只。治疗组6~8月龄,平均(7.00±0.60)月龄,体重2.0~3.0 kg,平均(2.50±0.25)kg,模型组6~8月龄,平均(7.00±0.80)月龄,体重2.10~2.90 kg,平均(2.45±0.30)kg。2组月龄、体重差异无统计学意义(P>0.05),具有可比性。
1.2 建立腓总神经损伤动物模型 每只家兔均行右后肢腓神经钳夹术,建立失神经模型。各实验组家兔用3%戊巴比妥钠溶液(1.5 mL/kg)腹腔缓慢注射麻醉,取右后肢外侧钝性分离开股二头肌,分离出胫神经和腓总神经。腓总神经沿股二头肌内侧缘向外下方行走,后分成内、外侧束,钝性分离出家兔右侧腓神经后,在分束前钳夹腓神经,止血钳扣满3扣,钳夹15 s松开,神经挫压长度为3 mm,钳夹后见腓神经变菲薄,将神经放回原位,神经损伤点处用9-0Nylon线标记。后逐层缝合皮肤,模型建立过程由一个人完成。
1.3 免疫组织化学染色 所用试剂为鼠抗兔NGF单克隆抗体(Sigma公司),鼠抗兔bFGF单克隆抗体(Sigma公司),免疫组织化学链霉菌抗生物素蛋白-过氧化物酶(streptavidin-perosidase,SP)试剂盒、对氨基联苯胺显色剂。腓神经组织在10%的中性福尔马林溶液48 h浸泡固定,石蜡包埋,切片机做3~4 μm厚度连续切片,采用SP法进行免疫组织化学检测。分六步进行:①无水酒精二甲苯脱蜡,酒精95%、80%、79%梯度水化;②切片用3%双氧水5 min灭活内源性过氧化物酶活性,PBS洗2 min,2~3次;③加一抗室温孵育60 min,PBS洗2 min,2~3次;④加过氧化物酶标记的Ⅱ抗,室温孵育30min,PBS洗2 min,2~3次;⑤对氨基联苯胺显色6 min,显微镜下观察胞浆呈棕色为阳性;⑥苏木素复染,盐酸酒精分化,常规脱水,透明,用中性树胶封片。阴性对照采用PBS代替一抗。阳性对照使用订购的阳性对照片。
1.4 治疗方法 采用武汉依瑞德CCY-ITMS治疗仪,在兔头顶正上方2 cm处放置直径为10 cm的磁刺激线圈,应用rTMS模式,频率为10 Hz,磁场强度为1 T。每次治疗20 min,1次/d,共治疗20 d。治疗组家兔在手术次日开始作重复经颅磁刺激,模型组不做rTMS,但同样置于和治疗组相同的笼内。
1.5 取材 造模成功1 d后开始治疗,连续治疗20 d后进行取材。按同样的方法麻醉、消毒原切口分离暴露损伤侧腓总神经。在距离钳夹神经致损处1 cm远端取2段5 mm长的腓神经组织放入10%的中性福尔马林溶液及浸泡固定,进行石蜡包埋、染色和中性树胶封片,免疫组化染色定量分析,同时行3~4 μm厚度半薄切片。
1.6 疗效评定方法
1.6.1 肌电图检测 用日本产Keypoint 2/4型4导程肌电图仪,刺激点位于胫前肌肌腹,检测时室温要求在25 ℃。测定到插入电位延长;静息状态出现纤颤电位;轻收缩时运动单位电位平均时限延长大于正常值的20%,波幅小于正常值的75%为异常。记录异常只数。运动传导速度和波幅的测定,腓神经运动传导速度低于(58.4±6.7) m/s为减慢,波幅低于(18±8) mV为降低。
1.6.2 图像分析 每张切片经免疫组化染色后,于显微镜下随机取5个部位图像框,用HPAIS-1000高清晰度彩色病理图文报告分析系统免疫组化测量程序(河北医科大学病理教研室提供)进行检测,显微镜下观察细胞胞浆呈棕色为阳性,灰度值与阳性反应强度呈反比。
1.7 统计学方法 应用SPSS 20.0统计学软件分析数据。计量资料比较采用t检验,计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 肌电图检测 治疗前,2组插入电位延长、纤颤电位、运动单位电位指标差异无统计学意义(P>0.05)。治疗后,2组插入电位延长、纤颤电位指标异常只数明显少于治疗前,运动单位电位指标异常只数明显多于治疗前,差异均有统计学意义(P<0.05)。治疗后,治疗组插入电位延长、纤颤电位指标异常只数明显少于模型组,运动单位电位指标异常只数明显多于模型组,差异均有统计学意义(P<0.05)。见表1。
表1 治疗前后2组肌电图指标比较
Table 1 Comparision of electromyography before and after therapy between two groups (n=40,例数,%)
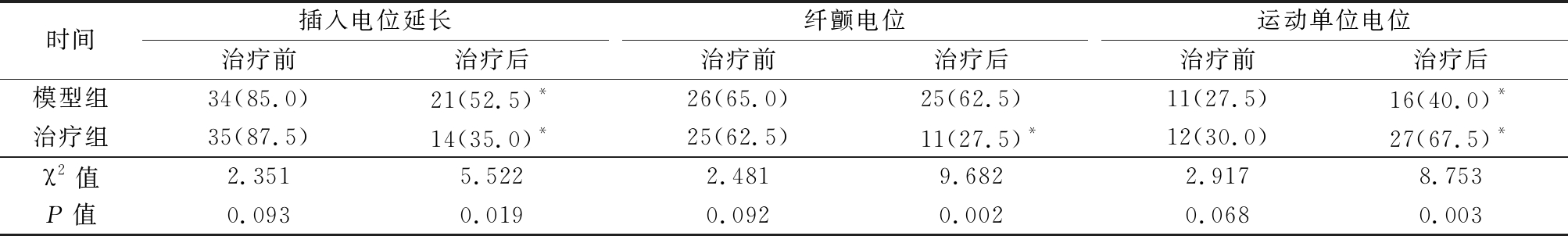
时间插入电位延长治疗前治疗后纤颤电位治疗前治疗后运动单位电位治疗前治疗后模型组34(85.0)21(52.5)*26(65.0)25(62.5)11(27.5)16(40.0)*治疗组35(87.5)14(35.0)*25(62.5)11(27.5)*12(30.0)27(67.5)*χ2值2.3515.5222.4819.6822.9178.753P值0.0930.0190.0920.0020.0680.003
*P值<0.05与治疗前比较(χ2检验)
2.2 运动神经传导速度及波幅的比较 治疗前,2组运动神经传导速度及波幅差异无统计学意义(P>0.05)。治疗后,2组运动神经传导速度及波幅均高于治疗前,治疗组运动神经传导速度及波幅均高于模型组,差异均有统计学意义(P<0.05)。见表2。
2.3 2组受损腓神经组织NGF和bFGF的灰度值比较 治疗组兔受损腓神经组织中NGF和bFGF的灰度值均明显高于模型组,差异均有统计学意义(P<0.05)。见表3。
表2 治疗前后2组运动传导速度及波幅值比较
Table 1 Comparision of and Amplitude before and after between therapy two groups![]()
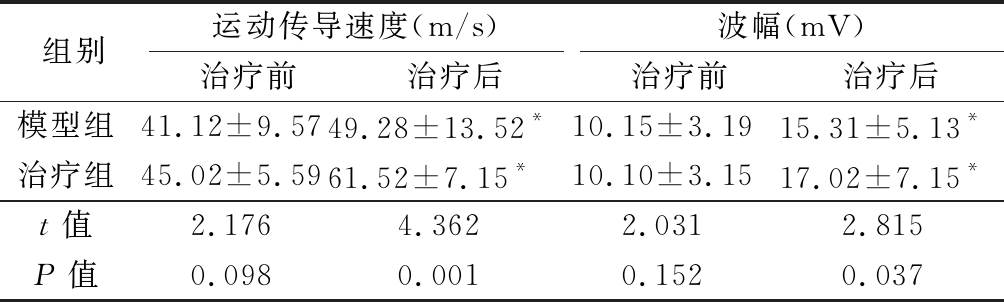
组别运动传导速度(m/s)治疗前治疗后波幅(mV)治疗前治疗后模型组41.12±9.5749.28±13.52*10.15±3.1915.31±5.13*治疗组45.02±5.5961.52±7.15*10.10±3.1517.02±7.15*t值2.1764.3622.0312.815P值0.0980.0010.1520.037
*P值<0.05与治疗前比较(配对t检验)
表3 2组受损腓神经组织NGF和bFGF的灰度值比较
Table 3 Comparison of gray values of NGF and bFGF between two groups![]()
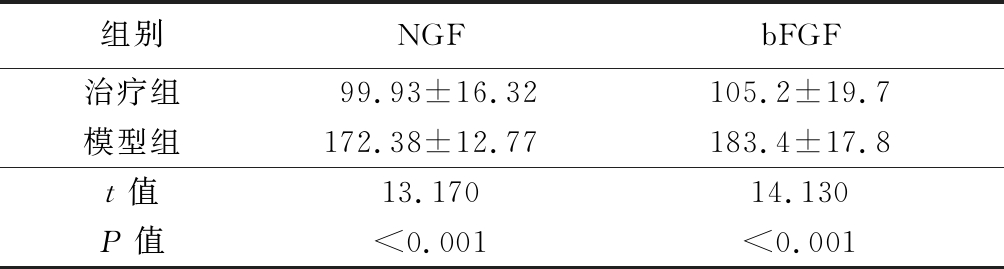
组别NGFbFGF治疗组99.93±16.32105.2±19.7模型组172.38±12.77183.4±17.8t值13.17014.130P值<0.001<0.001
3 讨 论
腓总神经绕行腓骨颈处位置表浅,且紧贴骨膜,周围骨性组织坚硬,神经在狭小的空间活动,对外来伤害的躲避能力较差,在这些部位更易受到伤害[7],很多诱因易压迫腓总神经造成损伤麻痹如坐姿不正确、蹲位时间过长、间质性炎症等。腓总神经为混合神经,运动纤维多,感觉纤维较少,损伤后主要引起运动功能障碍,踝背屈不能,伸趾不能,马蹄状内翻足等典型症状,还可引起不同程度的靶器官肌肉萎缩,严重影响患者日常活动和正常行走能力[8]。由于神经以平均每天1 mm的速度缓慢生长,再生速度极其缓慢,在重新得到神经再支配前,可能导致其支配肌肉肌萎缩,严重者可致终身残疾。因此及早积极运用神经再生技术将相应的靶器官和再生轴突重新建立突触联系、防止肌肉失神经萎缩显得尤为重要[9],促进神经功能恢复是康复训练早期的重点。
神经营养因子是调节外周和中枢神经系统神经元发育、维持和存活的细胞生长因子。NGF有神经元营养和促进突起生长双重生物学功能,在糖尿病周围神经病变的大鼠应用神经营养因子治疗研究中,证实雪旺细胞增殖显著、并通过对神经相关蛋白表达的调节,使神经轴索及髓鞘再生加快[10]。bFGF在PNI的神经再生中起关键作用,可激活神经细胞、雪旺细胞及成纤维细胞,促进神经残端的轴突生长[11]。bFGF具有活性强、含量少的特性,可增强骨骼肌修复调整作用。bFGF在正常状态的骨骼肌组织内检测不到或仅微弱表达,在骨骼肌受损伤时,bFGF表达明显增强并发挥其生物学功能促进神经功能修复,孔亚敏等[12]研究亦可证明bFGF表达增强,可以调节微环境,能够增强受损部位骨骼肌修复,阻止或延缓骨骼肌萎缩。
经颅磁刺激技术(transcranial magenetic stimulation,TMS)是近年来新兴且发展较好的治疗手段,广泛应用于神经康复领域,但在治疗PNI方面报道较少。TMS原理是通电线圈产生的磁场作用于头颅表面,感应电流会在磁场对皮层神经的作用下产生,改变神经动作电位进而影响皮层神经的兴奋性[13]。依据刺激的频率和释放数目,将TMS分成3种模式,即单脉冲TMS、双脉冲TMS以及重复TMS。高、低频2种磁刺激,是依据频率不同、强度不同及间隔、持续时间等参数不同进行分类,不同频率的重复TMS可产生的一系列不同神经生理效应,低频模式抑制皮层,高频模式兴奋皮层,故应在治疗不同疾病选择模式时加以注意。目前磁刺激在高频率、高强度的时候可使兴奋性突触后总和电位增加,引起刺激部位神经元的异常兴奋,此观点被普遍认同,也为临床治疗PNI时选择TMS参数提供重要参考价值。
局部磁刺激作用有:①神经膜去极化,形成钙离子内流,形成钙波,改变神经生长相关因子的转录调控及其受体的构型;②靶神经元细胞突触的连接性、可塑性改变使得神经元细胞重塑能力加强,神经元细胞功能的连接修复增强;③同时使受损神经波幅变高,神经传导速度明显加快[14]。本实验结果亦证实,因此经颅磁刺激除具有定向地促进周围神经生长的作用外,还具有脑源性神经递质水平的调节、大脑皮质的兴奋性的调节及重塑神经突触连接的调节作用。研究显示应用免疫组织化学染色法可以提高切片质量,有利于准确测定研究指标和临床诊断判断[15],本实验应用免疫组织化学SP法对受损兔腓总神经组织进行检测,结果显示,经过重复TMS治疗后的兔受损腓神经组织中NGF和bFGF表达明显较模型组高,肌电图检查治疗组受损神经波幅变高,神经传导速度明显加快(P<0.05),因此腓总神经损伤患者康复治疗前后进行肌电图检查可判断有无神经损伤及疗效。腓总神经损伤应在早期予以重复经颅磁刺激治疗, 能够加快神经损伤的恢复。
[1] Battiston B,Titolo P,Ciclamini D,et al. Perl nerve defects:overviews of practice in europe[J]. Hand Clin,2017,33(3):545-550.
[2] 高伟阳.周围神经损伤的诊断[J].中华手外科杂志,2016,32(3):161.
[3] 陆晟,郑佳杰,余赟劼,等.影响周围神经选择性再生的因素[J].解剖科学进展,2014,20(6):575-580,584.
[4] Houschyar KS,Momeni A,Pyles MN,et al. The role of current techniques and concepts in peripheral nerve repair [J]. Plast Surg Int,2016,2016:4175293.
[5] 张平.肌电图引导下局部注射鼠神经生长因子对外周神经损伤的疗效[J].医学信息,2016,29(34):251-252.
[6] 李雪怡,肖农.经颅磁刺激治疗周围神经损伤的研究进展[J].现代医药卫生,2016,32(18):2845-2847.
[7] 何荣, 郭瑜, 刘晓轩.老年人腓总神经损伤的原因及护理对策[J].西南国防医药,2017,27(11):1240-1241.
[8] 蒋拥军,李克军,陈颖,等.电针疗法结合综合康复治疗腓总神经损伤表面肌电图的观察[J].按摩与康复医学,2017,8(1):31-33.
[9] 马书杰,吴佳佳,华续赟,等, 周围神经损伤及脑功能重塑研究进展[J].中国康复,2019,34(3):165-168.
[10] Li R,Li Y,Wu Y,et al. Heparin-poloxamer thermosensitive hydrogel loaded with Bfgf and NGF enhances peripheral nerve regeneration in diabetic rats[J]. Biomaterials,2018,168:24-37.
[11] Matsumine H,Sasaki R,Tabata Y,et al. Facial nerver egenerationusing Basic fibmblast growth factor impregnated gelatin microspheres in a Rat model[J]. J Tissue Eng Regen Med,2016,10(10):E559-E567.
[12] 孔亚敏,严隽陶. 推拿联合跑轮训练对大鼠骨骼肌失神经后碱性成纤维细胞生长因子表达的实验探究细胞生长因子表达的实验探究[J]. 按摩与康复医学,2019,10(11):52-55,58.
[13] 贾晋瑄,吴毅.经颅磁刺激技术在脊髓损伤后痉挛中的应用机制进展[J].中国康复理论与实践,2019,25(6):644-647.
[14] Lenz M,Galanis C,Müller-Dahlhaus F,et al. Repetitive magnetic stimulation induces plasticity of inhibitory synapses[J]. Nat Commun,2016,7:10020.
[15] 骆福吉.免疫组化染色对病理技术质量控制的影响分析[J].临床医药文献杂志,2019,6(4):147.