糖尿病(diabetes mellitus,DM)是一种多因素共同参与的代谢紊乱性疾病,预计到2025年DM患者将达到全世界总人口的5%[1]。2型糖尿病(type 2 diabetes mellitus,T2DM)占DM总数的90%以上。随着DM病情的发展,慢性血管病变是DM的主要并发症,严重影响患者的生活质量,也是其致死的主要原因[2]。DM血管病变主要包括大血管病变和微血管病变,大血管病变是指心、脑及外周动脉血管的病变,而微血管病变主要是指肾脏、视网膜、皮肤微血管病变[3]。同型半胱氨酸(homocysteine acid,Hcy)是一种反应性血管损伤性的氨基酸,其升高可以导致血管钙化、动脉粥样硬化斑块的形成等[4],轻中度Hcy血症是心脑血管疾病的独立危险因素[5]。Hcy与DM的发生发展息息相关,很有可能参与DM血管并发症的发展过程[6]。T2DM患者血浆Hcy升高,与T2DM的病理发展过程呈正相关[7]。目前血清中Hcy与T2DM及其血管并发症的研究越来越多,但是结论不尽相同。关于Hcy能否成为DM血管病变发生发展的一个重要因素还有待于进一步研究和探讨。本文笔者拟选取我院体检的健康人群、DM患者及DM合并血管病变患者,检测Hcy、总胆固醇(total cholesterol,TC)、三酰甘油(triglyceride,TG)、空腹血糖(fasting plasma glucose,FPG)等生化指标的变化,研究血清Hcy浓度与T2DM血管病变之间的关系,进一步分析影响血清Hcy的因素,为DM血管并发症的防治提供更多的思路。报告如下。
1 资料与方法
1.1 一般资料 选择2018年2—8月在我科住院的T2DM患者101例,分为T2DM患者51例(T2DM组)和T2DM合并血管病变患者50例(血管病变组),另选取健康体检者59例为对照组。入选标准:所有T2DM患者的诊断严格遵循1999年WHO糖尿病诊断标准,即有DM的症状加FPG≥7.0 mmol/L、任意时间血糖≥11.1 mmol/L或口服葡萄糖耐量试验(oral glucose tolerance test,OGTT )2 h血糖≥11.1 mmol/L,另其发病情况、胰岛功能及谷氨酸脱羧酶抗体的检测均符合T2DM标准。排除标准:①1 型糖尿病患者;②伴有DM急性或慢性并发症者;③伴有心、脑、肝、肾、甲状腺、垂体、肾上腺疾病者;④伴有其他内分泌代谢性疾病、新近发现肿瘤、自身免疫性疾病者;⑤妊娠及口服避孕药、哺乳期的女性;⑥同时或至少3个月内参加过其他研究性或观察研究者。DM合并血管病变诊断标准:DM血管病变包括颈动脉内膜增厚、颈动脉斑块、脑血管病变、冠心病、糖尿病肾病、糖尿病视网膜病变、糖尿病周围神经病变,有以上并发证均可入组。诊断标准:①脑梗死,根据病史、体格检查、头颅CT或MRI证实;②周围血管病变,超声测颈动脉内膜中层厚度、硬化、斑块及狭窄;③冠心病,根据患者症状、心电图及冠脉造影检查;④糖尿病肾病,24 h尿微量白蛋白尿(30~300 mg/24 h);⑤糖尿病视网膜病变,采用眼底镜检查,包括非增殖期糖尿病视网膜病变、增殖期糖尿病视网膜病、糖尿病性黄斑病变;⑥糖尿病周围神经病变组,患者存在周围神经病变的症状同时肌电图符合标准,排除其他神经病变者。3组一般情况比较差异无统计学意义(P>0.05),具有可比性,见表1。
表1 各组研究对象的一般情况
Table 1 General situation of the research objects in each group![]()
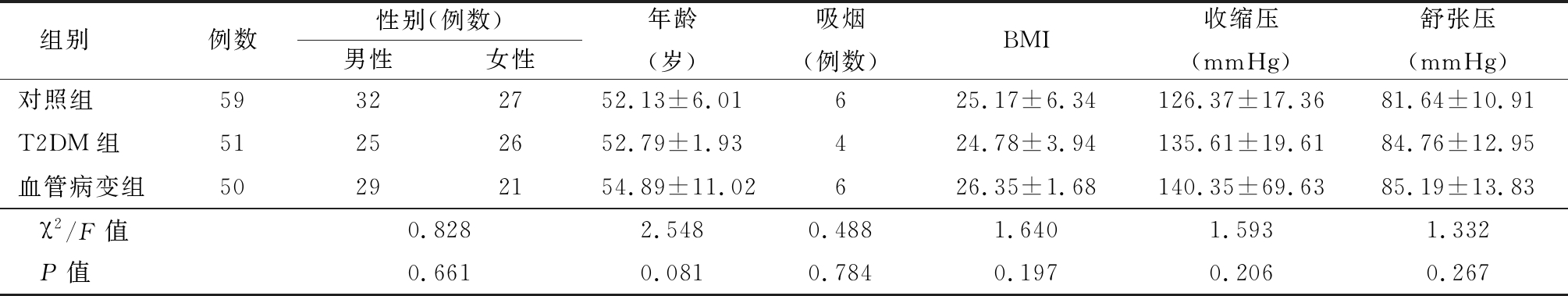
组别例数性别(例数)男性女性年龄(岁)吸烟(例数)BMI收缩压(mmHg)舒张压(mmHg)对照组59322752.13±6.01625.17±6.34126.37±17.3681.64±10.91T2DM组51252652.79±1.93424.78±3.94135.61±19.6184.76±12.95血管病变组50292154.89±11.02626.35±1.68140.35±69.6385.19±13.83χ2/F值0.8282.5480.4881.6401.5931.332P值0.6610.0810.7840.1970.2060.267
1 mmHg=0.133 kPa
1.2 方法 所有研究对象记录性别、年龄、身高、体重、血压、个人史、既往史、家族史等。DM患者入院后24 h内行常规心电图、胸部X线片、头颅CT、头颅MRI、心脏彩色超声、血管彩色超声、踝肱指数检测等。采集所有研究对象空腹血标本用于血液生化指标检测;另采集静脉血5 mL,乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)抗凝置管中,于4 h内分离血清,4 ℃、3 500 r/min离心,10 min后获取上层血清,置于-80 ℃冰箱内保存,用于血清Hcy测定。
1.3 观察指标
1.3.1 生化指标的测定 FPG、尿素氮(urea nitrogen,BUN)、肌酐(creatinine,Cr)、TG、TC均由我院检验科生化室用c16000全自动生化分析仪测定。FPG采用葡萄糖氧化酶法,参考区间3.9~6.1 mmol/L。BUN采用酶偶联速率法,参考区间2.9~8.2 mmol/L。Cr采用酶法,参考区间28.0~97.0 μmol/L。TC采用酶比色法,参考区间<5.2 mmol/L。TG采用氧化酶法,参考区间<1.2 mmol/L。
1.3.2 糖化血红蛋白(glycosylated haemoglobin A1c,GHbA1c)的测定 GHbA1c采用免疫乳胶凝集抑制法测定,参考区间4%~6%。
1.3.3 Hcy的测定 血清Hcy水平采用酶循环法测定,参考区间4~15 μmol/L。
1.3.4 体重指数(body mass index,BMI)计算 BMI=体重/身高(m2)。
1.4 统计学方法 应用Graphpad 5.0统计软件分析数据。计量资料比较采用t检验、单因素方差分析和SNK-q检验,计数资料比较采用χ2检验,相关生采用多元线性分析,危险因素确定采用多元逐步Logistic回归分析。P<0.05为差异有统计学意义。
2 结 果
2.1 各组生化资料比较 T2DM组和血管病变组TG、TC、 Hcy显著高于对照组,血管病变组Hcy高于T2DM组,差异有统计学意义(P<0.01);血管病变组Cr显著高于对照组和T2DM组,差异有统计学意义(P<0.01),对照组和T2DM组中的Cr差异差异无统计学意义(P>0.05);3组BUN差异无统计学意义(P>0.05)。见表2。
表2 各组研究对象的生化指标
Table 2 Biochemical indicators in each group ![]()
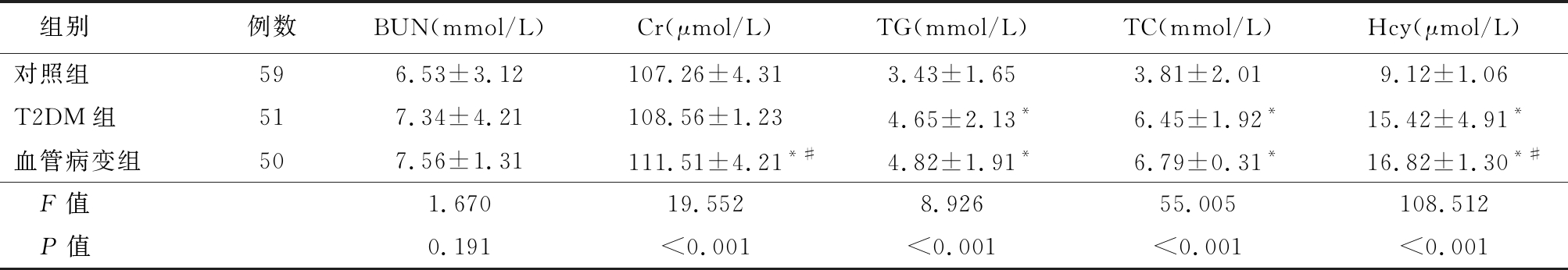
组别例数BUN(mmol/L)Cr(μmol/L)TG(mmol/L)TC(mmol/L)Hcy(μmol/L)对照组596.53±3.12107.26±4.313.43±1.653.81±2.019.12±1.06T2DM组517.34±4.21108.56±1.234.65±2.13*6.45±1.92*15.42±4.91*血管病变组507.56±1.31111.51±4.21*#4.82±1.91*6.79±0.31*16.82±1.30*#F值1.67019.5528.92655.005108.512P值0.191<0.001<0.001<0.001<0.001
*P值<0.05与对照组比较 #P值<0.05与T2DM组比较(SNK-q检验)
2.2 各组Hcy升高发生率比较 以Hcy>15 μmol/L为Hcy升高标准,统计各组Hcy升高发生率。结果显示,T2DM组和血管病变组血清Hcy升高发生率明显高于对照组,差异有统计表学意义(P<0.01)。见表3。
2.3 DM患者中血清Hcy水平及相关因素分析 为了进一步明确血清Hcy与DM发生的关系,在160例研究对象中,进一步根据血浆Hcy的水平将研究对象分为血浆Hcy≤15 μmol/L(正常Hcy组)98例和血浆Hcy>15 μmol/L(高Hcy组)62例。高Hcy组中FPG、GHbA1c、BUN、TC、TG、Hcy及血管病变发生率显著高于正常Hcy组,差异有统计学意义(P<0.01);2组性别、年龄、吸烟、BMI和血压差异均无统计学意义(P>0.05)。见表4。
2.4 相关性分析 Hcy与FPG、GHbA1c、BUN、Cr、TC、TG呈正相关(P<0.01),与性别、年龄、吸烟、BMI和血压均无明显相关性(P>0.01)。见表5。
表3 各组血清Hcy升高发生率比较
Table 3 Incidence of high serum Hcy in each group (例数,%)

组别 例数Hcy升高 对照组591(1.695)T2DM组5125(49.02)*血管病变组5036(72.00)* χ2值59.689 P值<0.001
*P值<0.05与对照组比较(χ2检验)
表4 正常组与高Hcy组间各指标的比较
Table 4 Comparison of indicators between normal group and high Hcy group![]()
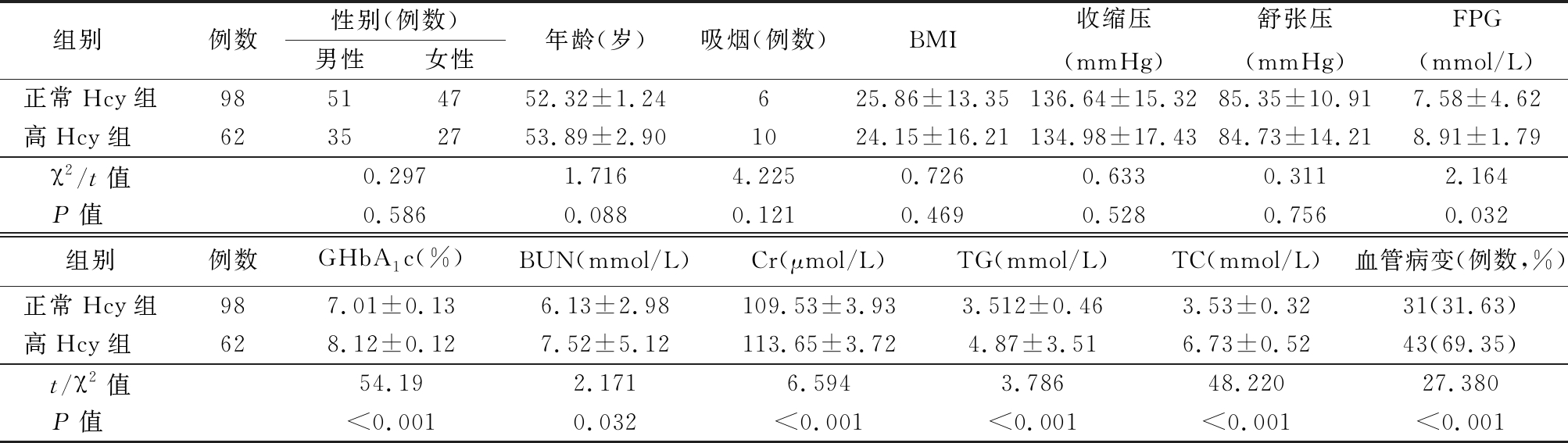
组别 例数性别(例数)男性女性年龄(岁)吸烟(例数)BMI收缩压(mmHg)舒张压(mmHg)FPG(mmol/L)正常Hcy组98514752.32±1.24625.86±13.35136.64±15.3285.35±10.917.58±4.62高Hcy组 62352753.89±2.901024.15±16.21134.98±17.4384.73±14.218.91±1.79χ2/t值0.2971.7164.2250.7260.6330.3112.164P值 0.5860.0880.1210.4690.5280.7560.032组别例数 GHbA1c(%)BUN(mmol/L)Cr(μmol/L)TG(mmol/L)TC(mmol/L)血管病变(例数,%)正常Hcy组987.01±0.136.13±2.98109.53±3.933.512±0.463.53±0.3231(31.63)高Hcy组 628.12±0.127.52±5.12113.65±3.724.87±3.516.73±0.5243(69.35)t/χ2值54.192.1716.5943.78648.22027.380P值 <0.0010.032<0.001<0.001<0.001<0.001
表5 血清Hcy与其他变量的相关性分析
Table 5 Correlation analysis between serum Hcy and other variables
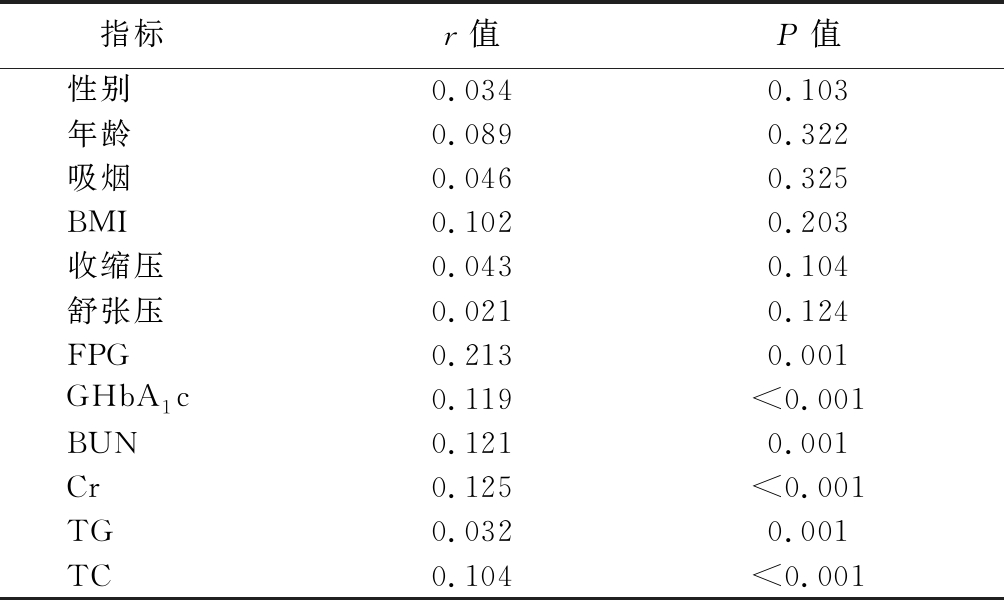
指标r值P值性别0.0340.103年龄0.0890.322吸烟0.0460.325BMI0.1020.203收缩压0.0430.104舒张压0.0210.124FPG0.2130.001GHbA1c0.119<0.001BUN0.1210.001Cr0.125<0.001TG0.0320.001TC0.104<0.001
2.5 糖尿病血管病变的危险因素分析 以糖尿病血管病变为应变量,以FPG、GHbA1c、BUN、Cr、TC、TG作为自变量,进行多元逐步Logistic回归分析,结果显示,TC 和Hcy是糖尿病血管病变的影响因素(P<0.05)。见表6,7。
表6 变量赋值表
Table 6 Variable assignment table

变量类别 变量赋值自变量 FPG<7.0 mmol/L=0;≥7.0 mmol/L=1 GHbA1c<6.5%=0;≥6.5%=1 BUN<8.2 mmol/L=0;≥8.2 mmol/L=1 Cr<97.00 μmol/L=0;≥97.00 μmol/L=1 TG<1.2 mmol/L=0;≥1.2 mmol/L=1 TC<5.20 mmol/L=0;≥5.20 mmol/L=1 Hcy<15.00 μmol/L=0;≥15.00 μmol/L=1因变量 糖尿病血管病变正常=0;病变=1
表7 糖尿病血管病变的危险因素分析
Table 7 Analysis of risk factors for diabetic vascular disease
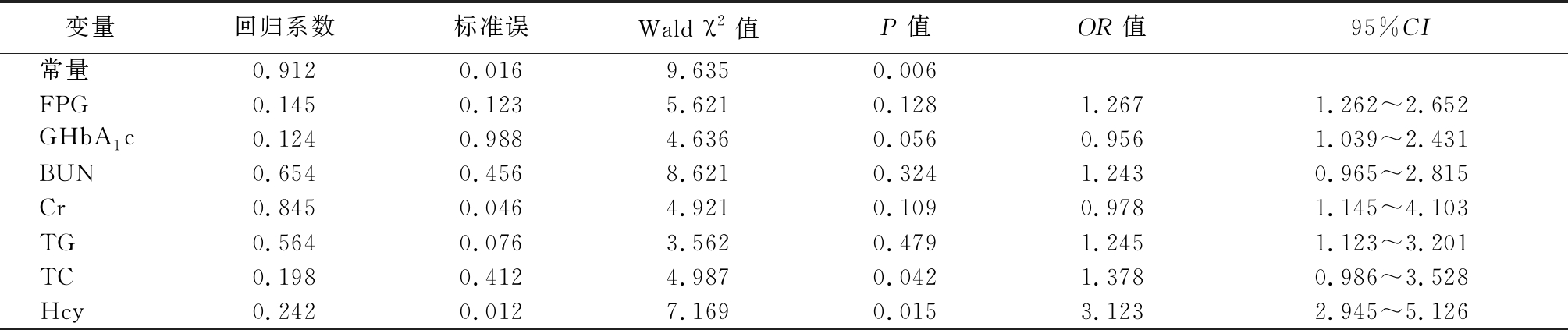
变量回归系数标准误Wald χ2值P值OR值95%CI常量0.9120.0169.6350.006FPG0.1450.1235.6210.1281.2671.262~2.652GHbA1c0.1240.9884.6360.0560.9561.039~2.431BUN0.6540.4568.6210.3241.2430.965~2.815Cr0.8450.0464.9210.1090.9781.145~4.103TG0.5640.0763.5620.4791.2451.123~3.201TC0.1980.4124.9870.0421.3780.986~3.528Hcy0.2420.0127.1690.0153.1232.945~5.126
3 讨 论
随着现代人们生活水平的提高,糖尿病血管病变成为DM死亡的主要原因之一。目前认为DM是一种糖、脂质代谢性疾病,肥胖、高血压等多种因素参与了DM及其血管病变的发生发展过程,但目前关于氨基酸代谢异常在DM血管并发症发病中的作用及机制研究甚少。血清Hcy是蛋氨酸循环形成的一种含硫氨基酸,是反映血管损伤的主要氨基酸。本研究结果显示,T2DM组和血管病变组血清中Hcy水平明显高于对照组,血管病变组血清Hcy水平高于T2DM组(P<0.05)。为了解血清Hcy与DM血管病变发生的关系,进一步将研究对象分为正常Hcy组和高Hcy组,高Hcy组血管病变发生率明显高于正常Hcy组。Logistic回归分析结果显示,TC和Hcy是DM血管病变的影响因素,提示Hcy可能作为DM血管病变重要的危险因素之一,参与DM血管病变的发生发展。
Hcy引起血管损伤的机制有以下几点:① Hcy对血管内皮细胞有直接或间接的损伤作用[8-9];② Hcy可以通过相关信号通路的活化,诱导血管平滑肌细胞(vascular smooth muscle cells,VSMC)增殖,干扰VSMC的正常表型和功能[10-11];③ Hcy可以激活核因子κB等相关炎性反应信号通路,促进血管炎性反应的发生[11-13];④ Hcy促进血栓的形成,通过抑制内皮细胞的抗血栓能力,打破机体凝血系统和纤溶系统的平衡,使抗凝作用降低,促进血液处于高凝状态,促进血栓形成,进一步导致动脉粥样硬化[14-15]。所以Hcy作为心血管疾病的重要危险因素之一,阐明其在DM血管病变中的作用及机制具有重要意义。
综上所述,Hcy作为一种心血管疾病的重要危险因素已越来越得到大家的共识,可以证明Hcy是T2DM及血管病变发生的危险因素,本研究样本量有限, Hcy在DM血管病变发生发展过程中具体的作用机制尚未明确,也是下一步的研究重点,为DM血管病变的防治提供重要的理论基础。
[1] Gandhi J,Dagur G,Warren K,et al.Genitourinary complications of diabetes mellitus:an overview of pathogenesis,evaluation,and management[J]. Curr Diabetes Rev,2017,13(5):498-518.
[2] Barbot M,Ceccato F,Zilio M,et al. Cardiovascular autonomic dysfunction in patients with idiopathic diabetes insipidus[J]. Pituitary,2018,21(1):50-55.
[3] Henning RJ. Type-2 diabetes mellitus and cardiovascular disease[J]. Future Cardiol,2018,14(6):491-509.
[4] Kundi H,Kiziltunc E,Ates I,et al. Association between plasma homocysteine levels and end-organ damage in newly diagnosed type 2 diabetes mellitus patients[J]. Endocr Res,2017,42(1):36-41.
[5] Zhu L,Zhang N,Yan R,et al. Hyperhomocysteinemia induces vascular calcification by activating the transcription factor RUNX2 via Kruppel-like factor 4 up-regulation in mice[J]. J Biol Chem,2019,294(51):19465-19474.
[6] Wang YS,Ye J,Yang X,et al. Association of retinol binding protein-4,cystatin C,homocysteine and high-sensitivity C-reactive protein levels in patients with newly diagnosed type 2 diabetes mellitus[J]. Arch Med Sci,2019,15(5):1203-1216.
[7] Hu Y,Xu Y,Wang G. Homocysteine levels are associated with endothelial function in newly diagnosed type 2 diabetes mellitus patients[J]. Metab Syndr Relat Disord,2019,17(6):323-327.
[8] Hou HT,Wang J,Zhang X,et al. Endothelial nitric oxide synthase enhancer AVE3085 reverses endothelial dysfunction induced by homocysteine in human internal mammary arteries[J]. Nitric Oxide,2018,81:21-27.
[9] Xu L,Hao H,Hao Y,et al. Aberrant MFN2 transcription facilitates homocysteine-induced VSMCs proliferation via the increased binding of c-Myc to DNMT1 in atherosclerosis[J]. J Cell Mol Med,2019,23(7):4611-4626.
[10] Ma SC,Cao JC,Zhang HP,et al. Aberrant promoter methylation of multiple genes in VSMC proliferation induced by Hcy[J]. Mol Med Rep,2017,16(5):7775-7783.
[11] Hu H,Wang C,Jin Y,et al. Catalpol inhibits homocysteine-induced oxidation and inflammation via inhibiting Nox4/NF-kappaB and GRP78/PERK pathways in human aorta endothelial cells[J]. Inflammation,2019,42(1):64-80.
[12] Pang X,Si J,Xu S,et al. Simvastatin inhibits homocysteine-induced CRP generation via interfering with the ROS-p38/ERK1/2 signal pathway in rat vascular smooth muscle cells[J]. Vascul Pharmacol,2017,88:42-47.
[13] Wei LH,Chao NX,Gao S,et al. Homocysteine induces vascular inflammatory response via SMAD7 hypermethylation in human umbilical vein smooth muscle cells[J]. Microvasc Res,2018,120:8-12.
[14] Yao Y,Shang MS,Gao LJ,et al. Elevated homocysteine increases the risk of left atrial/left atrial appendage thrombus in non-valvular atrial fibrillation with low CHA2DS2-VASc score[J]. Europace,2018,20(7):1093-1098.
[15] Siennicka A,Zuchowski M,Chelstowski K,et al. Homocysteine-enhanced proteolytic and fibrinolytic processes in thin intraluminal thrombus and adjacent wall of abdominal aortic aneurysm:study in vitro[J]. Biomed Res Int,2018,2018:3205324.