头颈鳞状细胞癌是耳鼻咽喉-头颈外科中常见的恶性肿瘤,主要包括喉癌、喉咽癌、口腔癌、鼻咽癌等。据资料统计,2015年我国头颈鳞状细胞癌新发病例占所有癌症新发病例的3.1%,而死亡病例占所有癌症死亡病例的2.8%[1]。由于癌组织局部复发和远处转移,使得头颈鳞状细胞癌的预后较差,其5年生存率约为50%[2]。因此,进一步探求头颈鳞状细胞癌相关特异性肿瘤标志物及分子治疗新靶点则具有极为重要的意义。而微小RNA(microRNA,miRNA)作为重要的生物学功能调控分子,在包括头颈鳞状细胞癌在内的多种肿瘤中发挥着重要的生物学作用[3-5]。而既往研究发现,miR-655-3p在食管鳞状细胞癌、宫颈癌、结直肠癌等多种肿瘤中表达水平降低,并具有重要的抑癌作用[6-8]。然而目前尚未发现miR-655-3p在头颈鳞状细胞癌中的相关研究,仅有一项研究发现miR-655-3p在口腔鳞状细胞癌中表达降低,表现出一定程度的抑癌作用[9]。因此,为丰富和完善miRNA在头颈鳞状细胞癌中的相关研究,本研究进一步探讨了miR-655-3p在头颈鳞状细胞癌中的表达情况及其临床意义,对于深入探讨头颈鳞状细胞癌相关机制研究具有重要意义。
1 资料与方法
1.1 一般资料 选择2017年3月—2019年7月接受手术但术前均无放化疗治疗史的头颈鳞状细胞癌患者(耳鼻咽喉科、口腔科、头颈外科)41例,其中男性37例,女性4例,年龄42~71岁,中位年龄57岁,有吸烟史33例,有饮酒史26例,低分化11例,中-高分化30例,伴有颈部淋巴结转移24例,早期(Ⅰ~Ⅱ)头颈鳞状细胞癌患者13例,晚期(Ⅲ~Ⅳ)患者28例。样本癌组织取自非坏死瘤体组织,癌旁正常组织取自距瘤体手术切缘3 mm(声门型喉鳞状细胞癌)、5 mm(其他部位头颈鳞状细胞癌),各样本组织类型均经术后病理证实。所有样本均由河北大学附属医院耳鼻咽喉科负责收集并储存于-80 ℃低温冰箱(Haier,中国)。
本研究经医院伦理委员会批准,所有患者知情同意并签署知情同意书。
1.2 方法 所纳入研究各组织样本,总RNA提取及反转录均依照相应试剂盒说明书操作步骤完成。其中总RNA提取试剂盒(Promega,美国)用于各组织样本中总RNA的提取,分光光度计(Thermo,美国)用于RNA浓度及纯度检测,1%琼脂糖凝胶电泳(含DEPC)法用于RNA完整性检测。质控合格的各组织样本总RNA,部分RNA样本储存于-80 ℃低温冰箱,部分用于反转录。其中反转录试剂盒(Roche,德国)和普通PCR仪(BIO-RAD,美国)用于RNA反转录cDNA的合成,而cDNA浓度及纯度通过分光光度计(Thermo,美国)检测。
1.3 miR-655-3p相对表达水平的检测 基于所获得组织样本的cDNA,采用实时荧光定量反转录聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR)方法,通过qRT-PCR 试剂盒(Promega,美国)和qRT-PCR仪(BIO-RAD,美国)检测各样本中miR-655-3p的相对表达水平。以U6作为内参照,以2-△△ct值代表各组织样本中miR-655-3p相对表达量。相关miR-655-3p及内参U6引物参照既往研究[10]。
1.4 统计学方法 应用SPSS 22.0 统计软件分析数据。计量资料比较采用配对独立样本的t检验,计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 头颈鳞状细胞癌中miR-655-3p表达水平 通过qRT-PCR的方法进行相对表达水平检测发现,在41对头颈鳞状细胞癌组织样本中,有26对头颈鳞状细胞癌组织中miR-655-3p相对表达水平较配对癌旁正常组织降低(图1)。表达水平总体分析发现,与配对癌旁正常组织中表达水平(4.849±2.485)相比,miR-655-3p在头颈鳞状细胞癌组织中表达水平明显降低(4.475±2.168),差异有统计学意义(t=2.217,P=0.032)。
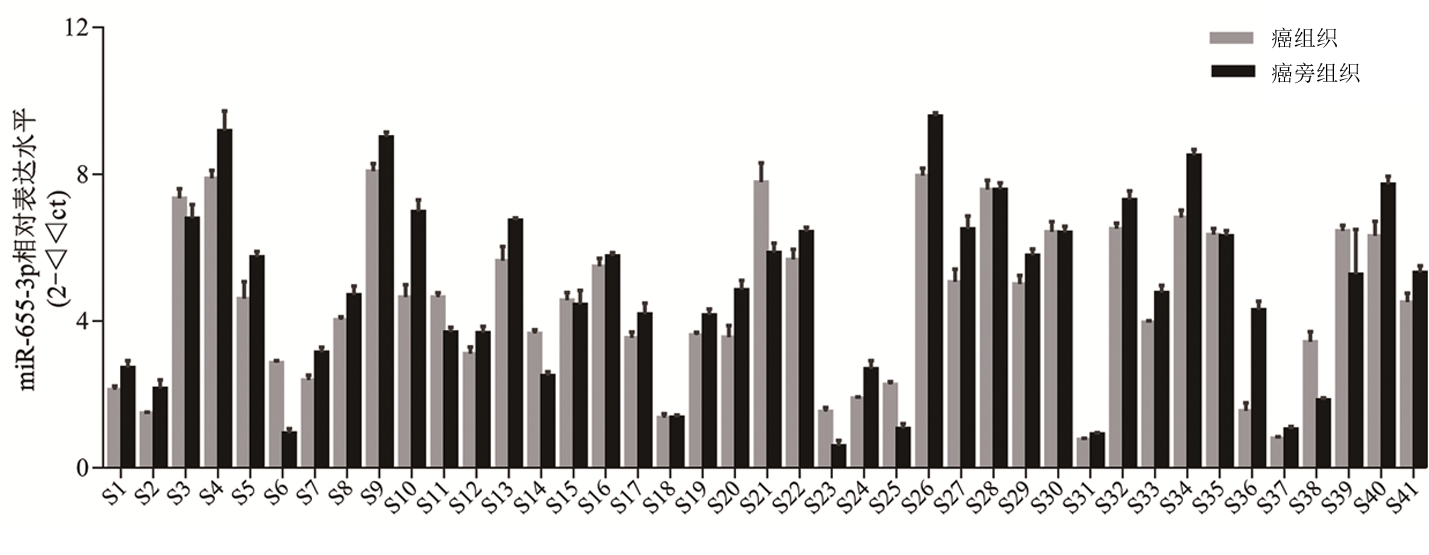
图1 头颈鳞状细胞癌组织中miR-655-3p表达水平分布情况
Figure 1 Expression of miR-655-3p in head and neck squamous cell carcinoma
2.2 不同临床特征的头颈鳞状细胞癌组织中miR-655-3p的表达情况 依据癌组织中miR-655-3p表达水平的中位数(4.565),分为高表达组和低表达组。各组在不同性别、年龄、是否吸烟、是否饮酒者之间构成比差异无统计学意义(P>0.05)。而低表达组晚期(Ⅲ~Ⅳ)构成为主(P=0.034);2组在组织分化、颈部淋巴结转移临床特征组中,构成比不同,差异有统计学意义(P<0.05)。见表1。
表1 不同临床特征头颈鳞状细胞癌患者组织中miR-655-3p低表达率的比较
Table 1 Comparison of miR-655-3p in different clinical features of head and neck squamous cell carcinoma (例数,%)
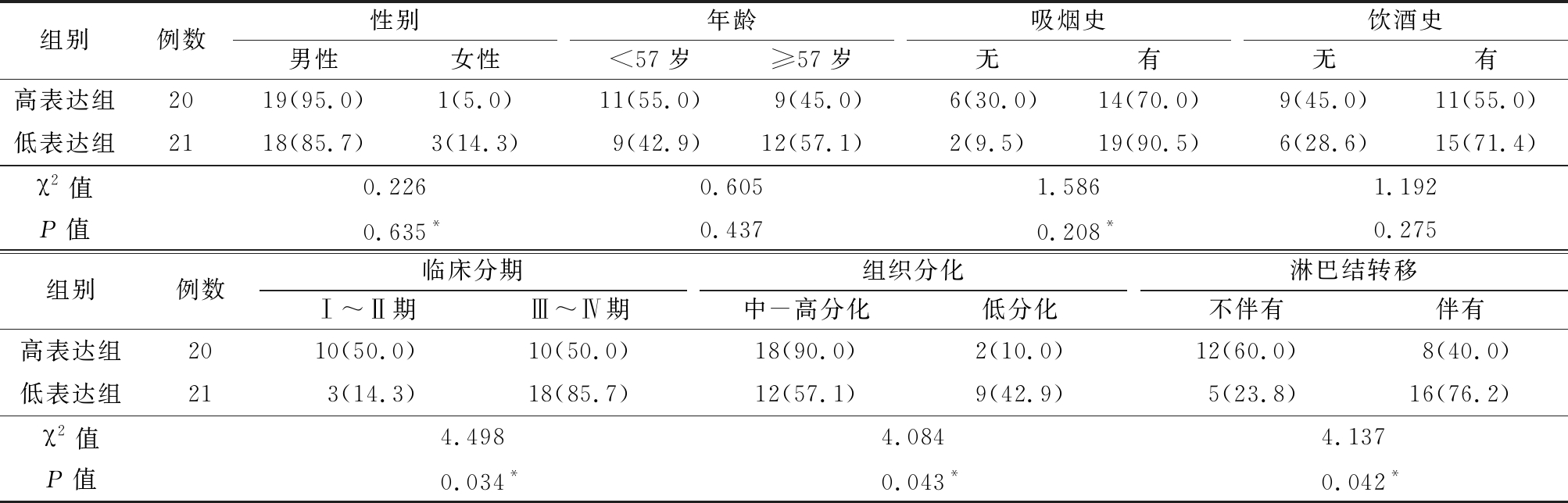
组别例数性别男性女性年龄<57岁≥57岁吸烟史无有饮酒史无有高表达组2019(95.0)1(5.0)11(55.0)9(45.0)6(30.0)14(70.0)9(45.0)11(55.0)低表达组2118(85.7)3(14.3)9(42.9)12(57.1)2(9.5)19(90.5)6(28.6)15(71.4)χ2值0.2260.6051.5861.192P值0.635*0.4370.208*0.275组别例数临床分期Ⅰ~Ⅱ期Ⅲ~Ⅳ期组织分化中-高分化低分化淋巴结转移不伴有伴有高表达组2010(50.0)10(50.0)18(90.0)2(10.0)12(60.0)8(40.0)低表达组213(14.3)18(85.7)12(57.1)9(42.9)5(23.8)16(76.2)χ2值4.4984.0844.137P值0.034*0.043*0.042*
*采用连续校正卡方
3 讨 论
作为生物学功能调控分子,miRNA是一类微小、非编码RNA,长度约22个核苷酸大小,往往以经典的靶向结合方式在胞浆中发挥作用,通过其自身种子区与靶mRNA的3′-非翻译区以碱基互补配对的方式结合,进而引起靶mRNA的翻译抑制或降解,而某些成熟miRNA可以被转运至细胞核内并在核内发挥某种生物学调控作用[11]。研究发现,miRNA在神经退行性相关疾病[12]、低氧诱导的心肌损伤[13]、肿瘤微环境[14]、癌细胞干性维持[15]、肿瘤表观遗传学调控[16]及肿瘤进展[17]等多种生物学过程中具有重要的生物学作用,包括抗癌治疗相关研究[18]。随着相关研究的逐步深入,miRNA在头颈鳞状细胞癌中的功能与作用机制研究同样取得了一定的进展,其在头颈鳞状细胞癌中表达改变,从而参与了头颈鳞状细胞癌的发生发展,并与头颈鳞状细胞癌患者生存预后相关[19-20]。如有研究报道,miR-205-5p在头颈鳞状细胞癌中表达增高,并与患者无复发生存率相关,具有一定的临床预后作用,相关机制研究提示其通过靶向抑制BRCA1 DNA repair associated和RAD17 checkpoint clamp loader component基因的表达,从而降低DNA损伤修复能力,并增加染色体不稳定,进而促进肿瘤的生长[21]。而miR-125a-5p作为肿瘤抑制因子,能够通过靶向调控erb-b2受体酪氨酸激酶2 mRNA的表达,进而影响肿瘤细胞的增殖和对离子辐射的敏感性,其低表达水平与头颈鳞状细胞癌患者局部复发和不良预后有关[3]。另有研究发现,miR-4295在头颈鳞状细胞癌中表达增高,其表达与患者生存时间呈负相关,并能够靶向抑制神经元正五聚蛋白1 mRNA的表达,进而促进头颈鳞状细胞癌细胞的增殖、迁移能力及上皮-间充质转化进程,与肿瘤转移相关[22]。有资料统计,全世界每年大约新增600 000例头颈鳞状细胞癌患者,同时有40%~50%的头颈鳞状细胞癌患者死亡,由于缺乏有效提高患者生存率及个性化的治疗方案,其预后较差,因此,深入探究其发病机制,筛选特异性肿瘤标志物或靶向治疗的新靶点,成为头颈鳞状细胞癌相关分子机制研究的重点[23]。为丰富和完善头颈鳞状细胞癌相关研究,本研究拟从miRNA这一重要的分子水平,探究头颈鳞状细胞癌中具有重要生物学作用的miRNA及其可能的发病机制。基于此研究目的,通过检索miR-655-3p相关的既往研究,发现miR-655-3p作为抑癌因子,在食管鳞状细胞癌患者血浆中表达水平降低,且其低表达水平与肿瘤细胞的淋巴管侵袭、淋巴结转移及肿瘤分期相关,能够抑制食管鳞状细胞癌细胞的增殖、迁移、侵袭能力及上皮-间充质转化进程,并与患者不良预后相关[6]。另有研究发现,miR-655-3p通过靶向抑制配对盒基因6 mRNA的表达,抑制ERK/p38 MAPK信号通路的活性,从而抑制视网膜母细胞瘤的恶性表型,如抑制肿瘤细胞的增殖、侵袭能力,促进肿瘤细胞凋亡等[10]。Zhao等[24]报道,miR-655-3p在上皮源性卵巢癌中表达降低,通过靶向抑制血管内皮生长因子mRNA的表达,抑制肿瘤细胞的增殖和侵袭能力,进而抑制上皮源性卵巢癌的进展。MiR-655-3p在多种肿瘤中表现出不同程度的抑癌作用,提示虽然作用机制不同,但其生物学抑制作用具有泛癌性,可能在包括头颈鳞状细胞癌在内的其他多种肿瘤中具有类似的抑癌作用。而有关口腔鳞状细胞癌的一项研究发现,miR-655-3p通过靶向作用于metadherin抑制PTEN/AKT信号通路,从而表现出抑制肿瘤细胞的增殖及侵袭等抑癌功能[9]。基于以上既往研究的综合分析,提示miR-655-3p作为重要的抑癌因子在多种肿瘤中表达下调,从而促进了肿瘤恶性表型的进展。因此,推测miR-655-3p可能在头颈鳞状细胞癌中同样具有某种抑癌作用,呈低表达趋势。本研究结果发现,miR-655-3p在头颈鳞状细胞癌中表达降低,且在不同临床分期、组织分化程度及是否伴有颈部淋巴结转移的组织样本中表达水平存在差异。而miR-655-3p在具有不同临床病理特征组织样本中的差异表达,提示其在头颈鳞状细胞癌中具有潜在的临床意义及可能的生物学作用。头颈鳞状细胞癌组织中miR-655-3p表达失活,从而诱导了癌的发生和进展,为靶向治疗相关研究提供了一定的参考。
本研究首次探讨了miR-655-3p在头颈鳞状细胞癌中的表达及其临床相关性,对于深入研究头颈鳞状细胞癌的发病机制及其靶向治疗具有重要意义。
[1] Chen W,Zheng R,Baade PD,et al. Cancer statistics in China,2015[J]. CA Cancer J Clin,2016,66(2):115-132.
[2] Ferlay J,Soerjomataram I,Dikshit R,et al. Cancer incidence and mortality worldwide:sources,methods and major patterns in GLOBOCAN 2012[J]. Int J Cancer,2015,136(5):E359-386.
[3] Vo DT,Karanam NK,Ding L,et al. miR-125a-5p functions as tumor suppressor microRNA and is a marker of locoregional recurrence and poor prognosis in head and neck cancer[J]. Neoplasia,2019,21(9):849-862.
[4] 聂红峰,张萍,贺雪霞,等. MiR-19a-3p通过PTEN调节人胃癌细胞增殖水平[J].河北医科大学学报,2019,40(5):538-542,546.
[5] 蒋雪梅,权毅.上调miRNA-27a-3p对乳腺癌MCF-7细胞增殖、侵袭和迁移能力的影响[J].郑州大学学报(医学版),2019,54(2):279-283.
[6] Kiuchi J,Komatsu S,Imamura T,et al. Low levels of tumour suppressor miR-655 in plasma contribute to lymphatic progression and poor outcomes in oesophageal squamous cell carcinoma[J].Mol Cancer,2019,18(1):2.
[7] Han MS,Lee JM,Kim SN,et al. Human papillomavirus 16 oncoproteins downregulate the expression of miR-148a-3p,miR-190a-5p,and miR-199b-5p in cervical cancer[J]. Biomed Res Int,2018,2018:1942867.
[8] Oshima G,Guo N,He C,et al. In vivo delivery and therapeutic effects of a microRNA on colorectal liver metastases[J].Mol Ther,2017,25(7):1588-1595.
[9] Wang Q,Lv L,Li Y,et al. MicroRNA 655 suppresses cell proliferation and invasion in oral squamous cell carcinoma by directly targeting metadherin and regulating the PTEN/AKT pathway[J].Mol Med Rep,2018,18(3):3106-3114.
[10] Zhang M,Li Q,Pan Y,et al. MicroRNA-655 attenuates the malignant biological behaviours of retinoblastoma cells by directly targeting PAX6 and suppressing the ERK and p38 MAPK signalling pathways [J].Oncol Rep,2018,39(4):2040-2050.
[11] Li H,Zhan J,Zhao Y,et al. Identification of ncRNA-Mediated functions of nucleus-localized miR-320 in cardiomyocytes[J]. Mol Ther Nucleic Acids,2020,19:132-143.
[12] Ferrante M,Conti GO. Environment and neurodegenerative diseases:an update on miRNA role [J]. Microrna,2017,6(3):157-165.
[13] Teng YL,Ren F,Xu H,et al. Overexpression of miRNA-410-3p protects hypoxia-induced cardiomyocyte injury via targeting TRAF5 [J].Eur Rev Med Pharmacol Sci,2019,23(20):9050-9057.
[14] Jorge NAN,Cruz JGV,Pretti MAM,et al. Poor clinical outcome in metastatic melanoma is associated with a microRNA-modulated immunosuppressive tumor microenvironment [J]. J Transl Med,2020,18(1):56.
[15] Xia Q,Han T,Yang P,et al. MicroRNA-28-5p regulates liver cancer stem cell expansion via IGF-1 pathway [J]. Stem Cell Int,2019,2019:8734362.
[16] Hu Y,Wu F,Liu Y,et al. DNMT1 recruited by EZH2-mediated silencing of miR-484 contributes to the malignancy of cervical cancer cells through MMP14 and HNF1A [J]. Clin Epigenetics,2019,11(1):186.
[17] Macharia LW,Wanjiru CM,Mureithi MW,et al. MicroRNAs,hypoxiaand the stem-like state as contributors to cancer aggressiveness [J].Front Genet,2019,10:125.
[18] Xie M,Ma L,Xu T,et al. Potential regulatory roles of micrornas and long noncoding rnas in anticancer therapies [J]. Mol Ther Nucleic Acids,2018,13:233-243.
[19] 徐杨斌,洪艺云,李慧凤,等.miRNA-34a通过靶向调控HGF在喉癌中的作用及临床意义[J].癌症进展,2019,17(23):2838-2842.
[20] Shi J,BaoX,Liu Z,et al. Serum miR-626 and miR-5100 are promising prognosis predictors for oral squamous cell carcinoma [J]. Theranostics,2019,9(4):920-931.
[21] Valenti F,Sacconi A,Ganci F,et al. The miR-205-5p/BRCA1/RAD17 axis promotes genomic instability in head and neck squamous cell carcinomas [J]. Cancers(Basel),2019,11(9):E1347.
[22] Lu S,Zhou C,Zou B,et al. MiR-4295 facilitates cell proliferation and metastasis in head and neck squamous cell carcinoma by targeting NPTX1 [J]. Genes Immun,2020,21(1):4-12.
[23] Leemans CR,Snijders PJF,Brakenhoff RH. The molecular landscape of head and neck cancer[J]. Nat Rev Cancer,2018,18(5):269-282.
[24] Zhao Z,Yang S,Cheng Y,et al. MicroRNA 655 inhibits cell proliferation and invasion in epithelial ovarian cancer by directly targeting vascular endothelial growth factor [J]. Mol Med Rep,2018,18(2):1878-1884.