食管癌是一种具有高度侵袭性的恶性肿瘤,在组织学上可分为腺癌和鳞状细胞癌,其中食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)是主要病理类型,其病死率居恶性肿瘤的第7位[1]。然而,由于经济情况和饮食习惯,ESCC在中国恶性肿瘤病死率中居第4位[2]。由于ESCC与广泛的淋巴转移和血管浸润密切相关,因此ESCC诊断时已为晚期,其5年生存率仍较低[3]。因此深入了解ESCC进展的分子机制有利于早期诊断、确定治疗策略和总体预后。转录因子CP2(transcriptional factor CP2,TFCP2)由位于染色体12q13(19,20)的TFCP2基因编码[4]。TFCP2在许多细胞中表达,参与细胞周期、细胞生长发育等多种生物学过程[5]。TFCP2在多种肿瘤的发生发展过程中起重要作用[6]。本课题组前期研究表明,TFCP2直接结合于MAGE-A11的启动子区,并以甲基化依赖的方式调控MAGE-A11在ESCC的表达[7]。而TFCP2在ESCC中的表达情况及其与临床病理参数和预后的关系尚不明确。本研究采用免疫组织化学法检测ESCC组织和癌旁组织中TFCP2蛋白的表达,并分析其与临床病理参数及预后的关系。报告如下。
1 资料与方法
1.1 一般资料 选择2012年2月—2013年4月河北医科大学第四医院收治的食管癌患者80例,均为首次发病,手术前未行放疗、化疗和内分泌治疗。获得手术切除的ESCC组织(原发肿瘤组织)和癌旁组织(距离癌组织5 cm以上经病理检测证实为正常的食管组织)。所有组织均包埋于石蜡中进行免疫组织化学分析。所有研究对象均为河北省及其周边地区的汉族居民,获取标本均获得病人或家属的知情同意。一(或多个)一级或二级亲属患有食管癌/贲门癌/胃癌的被定义为具有上消化道肿瘤(upper gastrointestinal cancers, UGIC) 家族史。临床病理特征的信息从医院记录和病理诊断中获得。
本研究经医院伦理委员会批准通过。
1.2 免疫组织化学染色及结果评价 4 μm石蜡包埋组织切片在二甲苯中脱蜡,通过分级酒精进行水合。然后用磷酸盐缓冲液(PBS,pH7.2)冲洗切片3次,每次5 min。将这些切片在微波炉中加热5 min,在10 mmol/L柠檬酸钠缓冲液(pH6.0)中修复抗原, PBS洗涤。将切片浸入0.3% H2O2中20 min,抑制内源性过氧化物酶活性。PBS冲洗后,切片置于正常山羊血清中常温孵育45 min,防止非特异性免疫球蛋白结合。然后用小鼠抗TFCP2单克隆抗体(1∶200)(BD Biosciences,USA)4 ℃过夜。以正常IgG替代原抗体作为对照。试剂盒中的原液为生物素化的山羊抗鼠二抗和辣根过氧化物酶标记的链酶卵白素,加DAB试剂显色,苏木精复染,中性树胶封片,光镜观察。免疫组织化学染色以细胞核中出现棕黄色颗粒为阳性,采用半定量积分法判断结果,用Image J软件对阳性细胞的表达强度进行评分:阳性细胞数≤5%为0分,6%~25%为1分, 26%~50%为2分, 51%~75%为3分,≥76%为4分。染色强度分级如下:未染色为0分,浅黄色为1分,黄色为2分, 棕黄色为3分。将染色面积和染色强度得分进行相乘, <4分为低表达,≥4分为高表达。
1.3 统计学方法 应用SPSS 22.0统计软件分析数据。计数资料比较采用χ2检验,采用Kaplan-Meier法分析ESCC患者的生存情况,Cox模型分析预后的影响因素。P<0.05为差异有统计学意义。
2 结 果
2.1 ESCC组织和癌旁组织中TFCP2蛋白高表达率比较 ESCC组织中的TFCP2蛋白高表达34例(图1),高表达率为42.5%,癌旁组织中的TFCP2蛋白高表达6例,高表达率为7.5%。ESCC组织中的TFCP2蛋白高表达率明显高于癌旁组织,差异有统计学意义(χ2=26.133,P<0.01)。
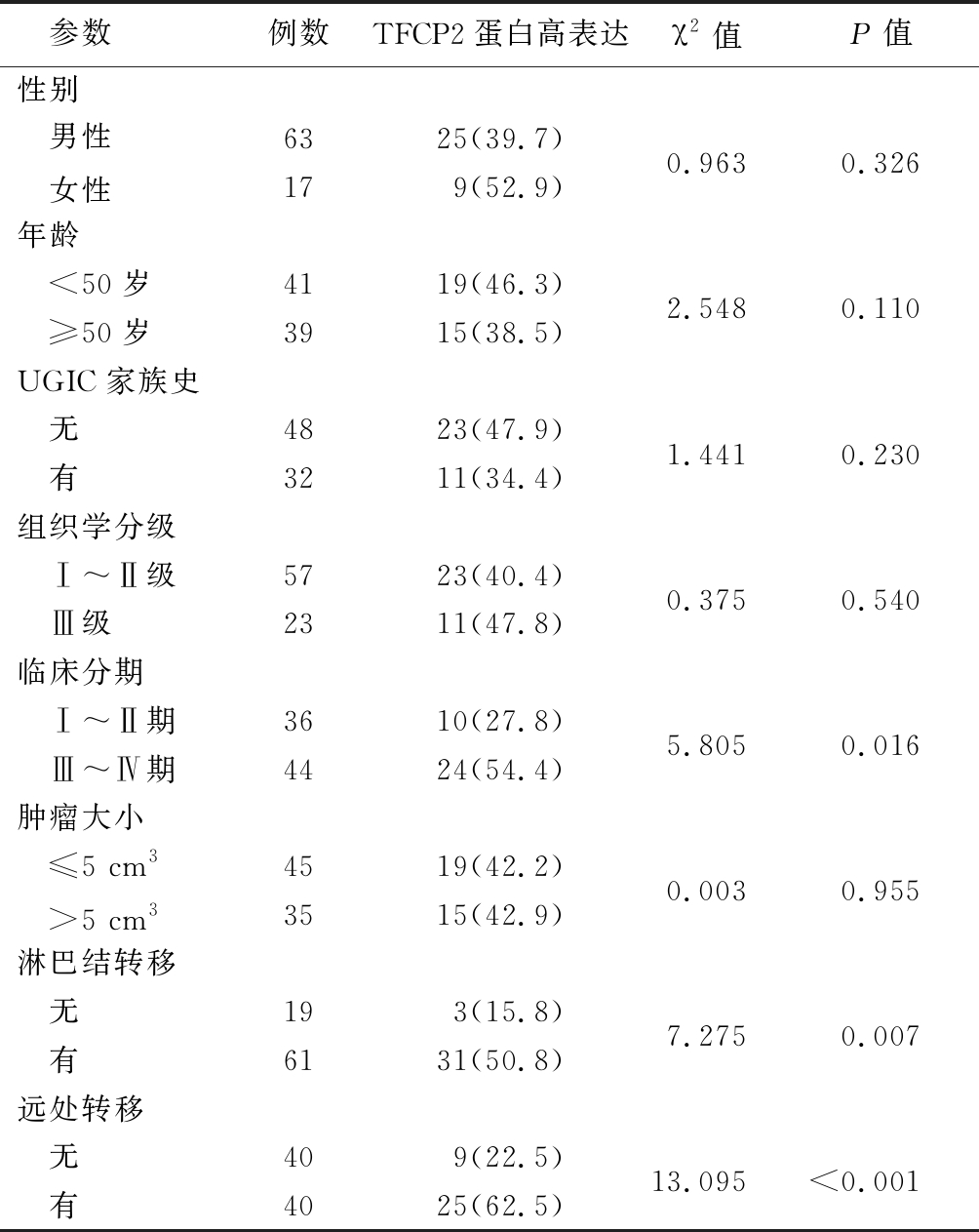
2.2 不同临床病理参数ESCC患者TFCP2蛋白高表达率比较 临床分期Ⅲ~Ⅳ期、有淋巴结转移、有远处转移ESCC患者TFCP2蛋白高表达率高于临床分期Ⅰ~Ⅱ期、无淋巴结转移、无远处转移ESCC患者,差异有统计学意义(P<0.05或P<0.01);不同性别、年龄、上消化道肿瘤家族史、组织学分级和肿瘤大小ESCC患者TFCP2蛋白高表达率差异无统计学意义(P>0.05)。见表1。
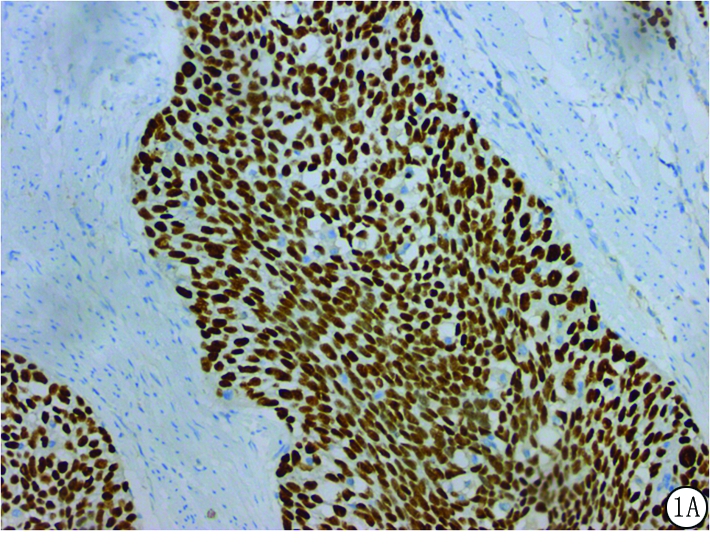
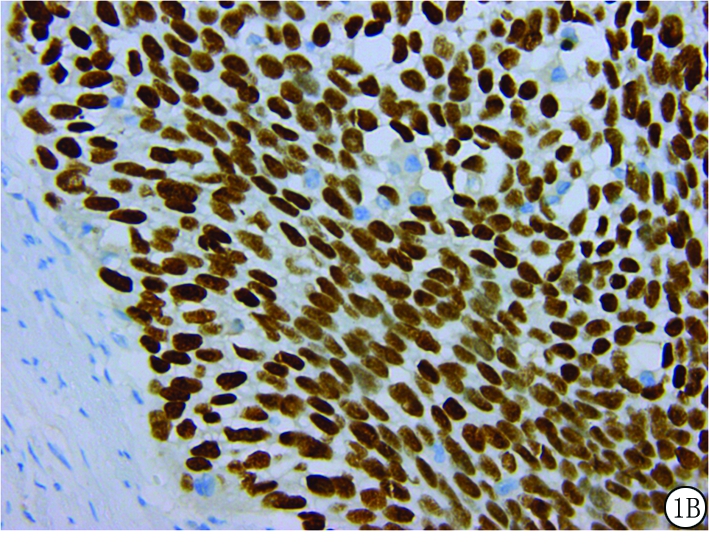
图1 免疫组织化学法检测TFCP2蛋白在ESCC组织中的表达
A.×200;B.×400
Figure 1 Expressions of TFCP2 protein in ESCC tissues detected by immunohistochemistry
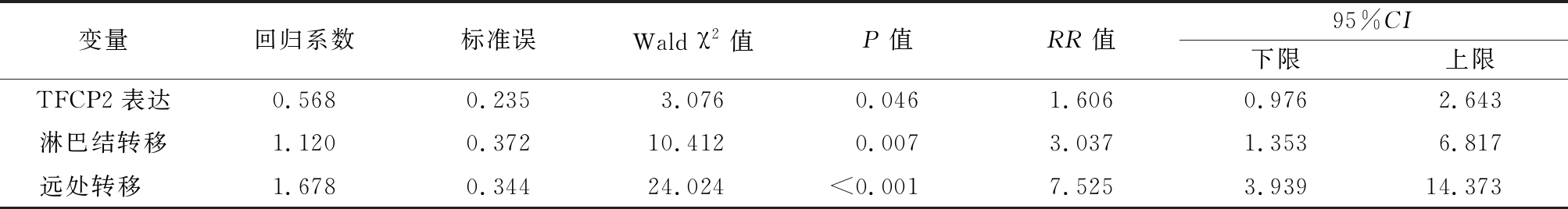
2.3 TFCP2蛋白表达与ESCC患者预后的关系 TFCP2蛋白高表达的ESCC患者总生存期显著低于TFCP2蛋白低表达的患者(图2)。以预后(存活=0,死亡=1)为因变量,以TFCP2蛋白表达(阴性=0,阳性=1)、临床分期(Ⅰ~Ⅱ期=0,Ⅲ~Ⅳ期=1)、淋巴结转移(无=0,有=1)和远处转移(无=0,有=1)为自变量进行多因素Cox模型分析,结果显示,TFCP2蛋白表达、淋巴结转移和远处转移是ESCC患者预后的影响因素。见表2。
表1 不同临床病理参数ESCC患者TFCP2 蛋白高表达率比较
Table 1 Correlations of high expression of TFCP2 in ESCC tissuses with clinciopathological features (例数,%)
参数例数TFCP2蛋白高表达χ2值P值性别 男性 女性631725(39.7)9(52.9)0.9630.326年龄 <50岁 ≥50岁413919(46.3)15(38.5)2.5480.110UGIC家族史 无 有483223(47.9)11(34.4)1.4410.230组织学分级 Ⅰ~Ⅱ级 Ⅲ级572323(40.4)11(47.8)0.3750.540临床分期 Ⅰ~Ⅱ期 Ⅲ~Ⅳ期364410(27.8)24(54.4)5.8050.016肿瘤大小 ≤5 cm3 >5 cm3453519(42.2)15(42.9)0.0030.955淋巴结转移 无 有19613(15.8)31(50.8)7.2750.007远处转移 无 有40409(22.5)25(62.5)13.095<0.001
表2 ESCC患者5年生存率预后因素的多因素分析
Table 2 Multivariate analysis of prognostic factors for 5 year survival in ESCC patients
变量回归系数标准误Wald χ2值P值RR值95%CI下限上限TFCP2表达0.5680.2353.0760.0461.6060.9762.643淋巴结转移1.1200.37210.4120.0073.0371.3536.817远处转移 1.6780.34424.024<0.0017.5253.93914.373
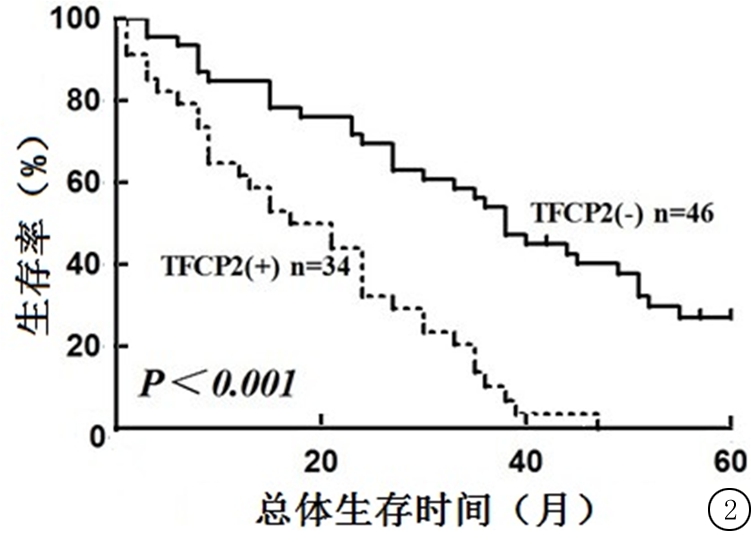
图2 ESCC患者总体生存率与TFCP2蛋白表达的Kaplan-Meier生存曲线
Figure 2 Kaplan-Meier survival curve of overall survival rate and TFCP2 expression in ESCC patients
3 讨 论
长期以来,ESCC是世界上最常见的恶性肿瘤,中位生存时间<1年[8]。随着早期诊断水平的提高和新技术的应用,5年生存率显著提高[9]。值得注意的是,内镜技术的应用,包括内镜黏膜切除术、内镜黏膜下剥离术和射频消融术,改善了早期食管病变的预防和治疗[10]。新辅助化疗和放化疗能提高ESCC患者的整体生存率。尽管有许多标志物与ESCC的进展有关,但临床上尚无可靠的预后标志物[11-16]。因此,寻找新的ESCC预后标志物至关重要。
基因的表达受到严格且精细的调控,基因的激活或抑制在个体发育中起着重要作用。细胞的基因表达程序受表观遗传调控机制和序列特异性转录因子活性的调控。转录因子通过与基因启动子区的特定序列结合,促进或抑制基因的表达。转录因子表达异常影响细胞的多种生物学作用。在肿瘤发生发展的过程中,转录因子异常表达影响肿瘤细胞的增殖、凋亡、分化、侵袭和转移等生物学特性。Chang等[17]报道,转录因子E2F8可通过CCND1/p21促进ESCC增殖。Zhao等[18]研究表明,转录因子LEF1可促进ESCC发展,并激活转化生长因子β(transforming growth factor-β,TGF-β)信号通路。一些转录因子的表达与肿瘤患者的预后密切相关。如KLF5过表达与胰腺癌的不良预后相关[19]。转录因子F2Fs过表达和肝癌患者的预后密切相关[20]。因此,调控或降解转录因子的表达是肿瘤靶向治疗的策略之一。
TFCP2能调节多种细胞和病毒基因的启动子,影响细胞周期进程和细胞存活。TFCP2可以通过与Snail诱导的纤维连接蛋白启动子结合参与上皮细胞的间质转化,促进前列腺癌的发生发展[5]。研究表明,TFCP2通过转录上调骨桥蛋白、基质金属蛋白酶9和补体因子H和纤连蛋白1等来增强肝肿瘤血管生成,促进肝细胞癌的发生发展[6]。宫颈癌人乳头瘤病毒(human papilloma virus,HPV)阳性细胞中高表达TFCP2,表明该蛋白可能参与TSG101基因启动子的下调和HPV依赖性宫颈癌的发生[21]。TFCP2 在食管癌、肝癌、宫颈癌及结直肠癌等多种实体肿瘤中的表达明显高于癌旁正常组织,且其表达水平与肿瘤增殖水平呈正相关[6-7,21]。肿瘤中TFCP2高表达与淋巴结转移和远处转移等恶性生物学行为密切相关[4-7,21]。
本研究采用免疫组织化学技术检测TFCP2蛋白在ESCC组织的表达情况,结果发现TFCP2蛋白在ESCC组织中的高表达率为42.5%(34/80),与TFCP2蛋白在其他肿瘤中的表达一致[22-23]。T临床分期Ⅲ~Ⅳ期、有淋巴结转移、有远处转移ESCC患者TFCP2蛋白高表达率高于临床分期Ⅰ~Ⅱ期、无淋巴结转移、无远处转移ESCC患者(P<0.05或<0.01);不同性别、年龄、上消化道肿瘤家族史、组织学分级和肿瘤大小ESCC患者TFCP2蛋白高表达率差异无统计学意义(P>0.05)。多因素Cox模型分析结果显示,淋巴结转移和远处转移是ESCC患者预后的影响因素。这与一项研究结果相似,结直肠癌中TFCP2高表达与肿瘤大小、晚期AJCC分期和高Ki-67指数显著相关[4]。
本研究结果提示,TFCP2蛋白阳性表达的ESCC患者总生存期显著低于TFCP2蛋白阴性表达患者,提示TFCP2蛋白可作为ESCC预后不良的判断指标。将TFCP2蛋白表达、淋巴转移及远处转移纳入Cox风险回归模型,结果显示TFCP2表达是ESCC患者预后的影响因素。由此考虑TFCP2可能成为ESCC患者预测预后的理想标志物。
综上所述,TFCP2蛋白表达与ESCC发生发展、淋巴结转移和远处转移有关,TFCP2蛋白高表达与ESCC患者不良预后相关,可作为临床评价ESCC预后的指标。
[1] Siegel RL,Miller KD,Jemal A. Cancer statistics,2018[J]. CA Cancer J Clin,2018,68(1):7-30.
[2] Chen W,Zheng R,Baade PD,et al. Cancer statistics in China,2015[J]. CA Cancer J Clin,2016,66(2):115-132.
[3] Zheng R,Zeng H,Zhang S,et al. Estimates of cancer incidence andmortality in China,2013[J]. Cancer J Clin,2017,36(1):66.
[4] Jiang H,Du J,Jin J,et al. LSF expression an its prognostic implication in colorectal cancer[J]. Int J Clin Exp Pathol,2014,7(9):6024-6031.
[5] Yuedi D,Yuankun C,Jiaying Z,et al. TFCP2 activates beta-catenin/TCF signaling in the progression of pancreatic cancer[J].Oncotarget,2017,8(41):70538-70549.
[6] Xu X,Liu Z,Zhou L,et al. Characterization of genome-wide TFCP2 targets in hepatocellular carcinoma:implication of targets FN1 and TJP1 in metastasis[J]. J Exp Clin Cancer Res,2015,34:6.
[7] Liu SN,Liu F,Huang WN,et al. MAGE-A11 is activated through TFCP2/ZEB1 binding sites de-methy-lation as well as histone modification and facilitates ESCC tumor growth[J]. Oncotarget,2018,9(3):3365-3378.
[8] Smyth EC,Lagergren J,Fitzgerald RC,et al. Oesophageal cancer[J]. Nat Rev Dis Primers,2017,3:17048.
[9] Lagergren J,Smyth E,Cunningham D,et al. Oesophageal cancer[J]. Lancet,2017,390(10110):2383-2396.
[10] Blom RL,Lagarde SM,van Oudenaarde K,et al. Survival after recurrent esophageal carcinoma has not improved over the past 18 years[J]. Ann Surg Oncol,2013,20(8):2693-2698.
[11] Ueda M,Iguchi T,Masuda T,et al. Somatic mutations in plasma cell-free DNA are diagnostic markers for esophageal squamous cell carcinoma recurrence[J]. Oncotarget,2016,7(38):62280-62291.
[12] Li J,Zhang BZ,Qin YR,et al. CD68 and interleukin 13,prospective immune markers for esophageal squamous cell carcinoma prognosis prediction[J]. Oncotarget,2016,7(13):15525-15538.
[13] Ge XS,Ma HJ,Zheng XH,et al. HOTAIR,a prognostic factor in esophageal squamous cell carcinoma,inhibits WIF-1 expression and activates Wnt pathway[J]. Cancer Sci,2013,104(12):1675-1682.
[14] Moghbeli M,Abbaszadegan MR,Farshchian M,et al. Association of PYGO2 and EGFR in esophageal squamous cell carcinoma[J]. Med Oncol,2013,30(2):516.
[15] Zhang JX,Tong ZT,Yang L,et al. PITX2:a promising predictive biomarker of patients′ prognosis and chemoradioresistance in esophageal squamous cell carcinoma[J]. Int J Cancer,2013,132(11):2567-2577.
[16] Li Y,Chen L,Nie CJ,et al. Downregulation of RBMS3 is associated with poor prognosis in esophageal squamous cell carcinoma[J]. Cancer Res,2011,71(19):6106-6115.
[17] Chang H,Song J,Wu J,et al. E2F transcription factor 8 promotes cell proliferation via CCND1/p21 in esophageal squamous cell carcinoma[J]. Onco Targets Ther,2018,11:8165-8173.
[18] Zhao Y,Zhu J,Shi B,et al. The transcription factor LEF1 promotes tumorigenicity and activates the TGF-β signaling pathway in esophageal squamous cell carcinoma[J]. J Exp Clin Cancer Res,2019,38(1):304.
[19] Li Y,Kong R,Chen H,et al. Overexpression of KLF5 is associated with poor survival and G1/S progression in pancreatic cancer[J]. Aging(Albany NY),2019,11(14):5035-5057.
[20] Huang YL,Ning G,Chen LB,et al. Promising diagnostic and prognostic value of E2Fs in human hepatocellular carcinoma[J]. Cancer Manag Res,2019,11:1725-1740.
[21] Broniarczyk JK,Warowiicka A,Kwa niewwska A,et al. Expression of TSG101 protein and LSF transcription factor in HPV-positive cervical cancer cells[J]. Oncol Lett,2014,7(5):1409-1413.
niewwska A,et al. Expression of TSG101 protein and LSF transcription factor in HPV-positive cervical cancer cells[J]. Oncol Lett,2014,7(5):1409-1413.
[22] Santhekadur PK,Rajasekaran D,Siddiq A,et al. The transcription factor LSF:a novel oncogene for hepatocellular carcinoma[J]. Am J Cancer Res,2012,2(3):269-285.
[23] Kim JS,Son SH,Kim MY,et al. Diagnostic and prognostic relevance of CP2c and YY1 expression in hepatocellular carcinoma[J]. Oncotarget,2017,8(15):24389-24400.