阴道重建术是解决无阴道患者性生活和性角色的主要方法。目前最常用的重建方法是在膀胱和直肠之间造穴并以各种不同组织衬里覆盖创面重建阴道,组织衬里的选择在很大程度上决定了手术效果。近年来随着组织工程学的发展,组织工程衬里的构建为阴道重建提供了新的思路。骨髓间充质干细胞(mesenchymal stem cells,MSCs)来源充足,分离培养方法成熟,易于培养,有多向分化和旁分泌功能。小肠黏膜下基质(small intestinal submucosa,SIS)来源广泛,制作方法相对简单,含有多种生长因子[1],已被用于多种组织工程,是一种比较理想的支架材料。已有研究证实,MSCs与SIS复合能促进创伤的修复[2],重建食管能促进食管上皮化和肌肉再生[3],与SIS复合后修补胃壁缺损能促进胃壁肌层的修复[4],还可用于心血管重建[5]。研究显示,MSCs复合SIS能促进大鼠重建阴道的修复[6-7],但修复效果欠佳。本研究旨在优化MSCs与SIS的复合方法,改善大鼠重建阴道的修复效果。
1 材料与方法
1.1 实验动物及主要试剂 雄性Sprague-Dawley大鼠,2~5周,由河北医科大学实验动物中心提供[实验动物质量合格证号1403076,许可证号 SCXY(冀) 2013-1-003]。DMEM/F12培养基(Hyclone),胎牛血清(Fetal Bovine Serum,FBS)(Hyclone),青霉素钠(80万U)和链霉素钠(100万U)(华北制药),胰蛋白酶溶液(0.25%Trypsin/1 mmol/L EDTA)(GIBICO),L-谷氨酰胺(L-Glutamine)(Sangon),四甲基偶氮唑盐(MTT)(Sigma)。
1.2 SIS的制备[8] 取一段新鲜的猪小肠(空肠段尤宜),用水反复冲洗,清除小肠内外壁黏附的物质,褪下浆膜和肌层沿小肠的纵轴翻转剩余的小肠,使黏膜向外,用同样的方法褪下黏膜,沿纵轴切开成片状。用机械方法制得的SIS依次浸泡于含100 mmol/L EDTA和10 mmol/L NaOH的溶液(pH 11~12)中16 h。含1 mol/L HCl和1 mol/L NaCl的溶液(pH 0~1)中6~8 h,含1 mol/L NaCl和10 mmol/L PBS溶液中(pH 7~7.4)16 h,PBS溶液中2 h,含0.1%过氧乙酸的20%乙醇溶液中浸泡8 h杀菌。每次更换溶液均需用去离子水彻底冲洗干净。长期储存时先冷冻干燥,储存于-80 ℃; γ射线照射,剂量25~35 kGy,使用前在室温下用PBS溶液浸泡解冻。新鲜制备的、干燥后、复水后的SIS进行石蜡包埋、切片、HE染色,镜下观察。干燥的SIS行扫描电镜观察。
1.3 大鼠MSCs的培养 大鼠颈椎脱臼处死后充分浸泡于75%酒精中5 min。仰卧位固定于手术台上分离双侧胫骨、股骨,注意保持骨髓腔完整。放在盛有PBS清洗液的60 mm玻璃培养皿中,移入超净台。用PBS清洗液充分清洗数次,10 mL 75%酒精浸泡5 min,移入另一个干净培养皿中,PBS清洗液充分清洗数次。剪去2侧骨骺端,移入另一个盛有DMEM/F12培养基的培养皿中,用DMEM/F12 培养基冲洗骨髓腔。以上操作均在冰上进行。获得的细胞悬液移入离心管1 000 r/min离心5 min。弃上清,3 mL DMEM/F12 完全培养基重悬,70 μm细胞筛过滤细胞悬液,接种于25 cm2细胞培养瓶中,补充培养液至5 mL,置于37 ℃,5%CO2 饱和湿度细胞培养箱中培养。72 h首次换液,之后隔日换液1次。待细胞70%~80%融合时用胰蛋白酶溶液传代。此为第1代细胞,4~6 d即可融合,第3代细胞用于后续实验。
1.4 大鼠MSCs与SIS复合条件的筛选
1.4.1 大鼠MSCs与SIS复合浓度及复合时间对复合效果的影响 将SIS按96孔板培养孔大小剪成圆形,尽量适形后黏膜面朝上置于孔底,加DMEM/F12完全培养基置恒温箱内预湿24 h待用。第3代MSCs消化重悬于DMEM/F12完全培养基中,调整细胞浓度为4×106/mL、2×106/mL、1×106/mL。分别接种于96孔板中的预湿后小肠黏膜下层上,每孔100 μL(每个浓度12个孔)。24 h后首次换液,此后隔日换液1次。分别于复合后1,3,5,7 d取3孔用MTT法检测细胞活性。
1.4.2 大鼠MSCs与SIS复合次数对复合效果的影响 第3代MSCs消化,重悬于DMEM/F12完全培养基中,调整细胞浓度为4×106/mL、2×106/mL、1×106/mL,分别接种于96孔板中的预湿后小肠黏膜下层上,每孔100 μL(4×106/mL 12个孔,2×106/mL,1×106/mL每个浓度21个孔)。24 h后首次换液,此后隔日换液1次。复合后第2天2×106/mL,1×106/mL浓度中的9个孔以相同细胞浓度重复接种1次,分别于复合后1,3,5,7d取3孔用MTT法检测细胞活性。
1.4.3 SIS的预处理方法对复合效果的影响 将SIS按96孔板培养孔大小剪成圆形,尽量适形后黏膜面朝上置于孔底。新法:预湿24 h后吸净培养基使SIS贴附与培养孔底,尽量排净SIS与培养孔底之间的气泡,将培养板置于超净台中静置30 min,待SIS干燥,完全贴附于培养孔底部后再次加入DMEM/F12完全培养基预湿24~48 h待用。旧法:加DMEM/F12完全培养基置恒温箱内预湿24 h待用。第3代MSCs融合达90%后,消化重悬于DMEM/F12完全培养基中,调整细胞浓度为4×106/mL、2×106/mL。分别接种于96孔板中的预湿后小肠黏膜下层上,每孔100 μL(每个浓度,每种预湿方法3个孔)。24 h后用MTT法检测细胞活性。
1.5 光学显微镜 扫描电镜观察复合情况。
1.6 统计学方法 应用SPSS 16.0 统计软件处理数据。计量资料比较采用两独立样本的t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 SIS大体及镜下观察 新鲜制备的SIS为乳白色,HE染色镜下见疏松的胶原组织,无细胞残留(图1A)。冷冻干燥后的SIS呈淡黄色薄膜状,HE染色镜下见胶原组织结构变致密,胶原组织间无明显空隙(图1B),厚度为(6.80±1.10) μm。复水后胶原组织再次呈现疏松结构(图1C),厚度为(25.79±11.00) μm。扫描电镜观察见SIS浆膜面光滑,黏膜面粗糙(图2 A,B)。

图1新鲜(A),冷冻干燥(B)和复水后(C) SIS(HE ×200)
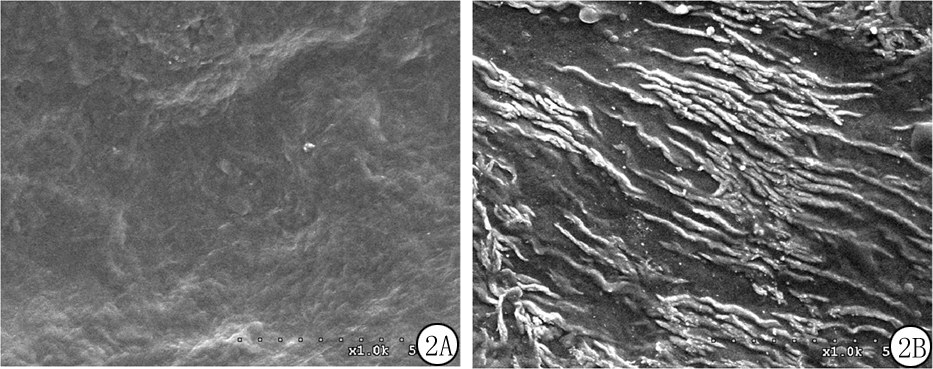
图2 扫描电镜下观察SIS(×1 000)
A.浆膜面;B.黏膜面
2.2 不同方法对复合效果的影响
2.2.1 大鼠MSCs与SIS复合浓度及复合时间对复合效果的影响 4×106/mL MSCs与SIS复合后第1天黏附率较低,复合后3 d最高,以后逐渐降低。2×106/mL MSCs与SIS复合后第1天黏附率最高,以后逐渐降低。1×106/mL MSCs与SIS复合后黏附率先下降,第5天有所回升,其后又降低(图3)。
2.2.2 大鼠MSCs与SIS复合次数对复合效果的影响 复合后同一时间,4×106/mL MSCs与SIS复合后的黏附率不及2×106/mL MSCs与SIS分2次复合后的黏附率,2×106/mL MSCs与SIS复合后的黏附率不及1×106/mL MSCs与SIS分2次复合后的黏附率。但2次复合后的黏附率并不比高浓度单次复合后1 d的黏附率高。随时间延长各组的黏附率均降低(图4)。
2.2.3 SIS的预处理方法对复合效果的影响 2×106/mL MSCs与新法预处理的SIS复合后其黏附率高于旧法,差异有统计学意义(P<0.05)。4×106/mL MSCs新法与旧法预处理的SIS复合后其黏附率差异无统计学意义(P>0.05)。见表1,图5。
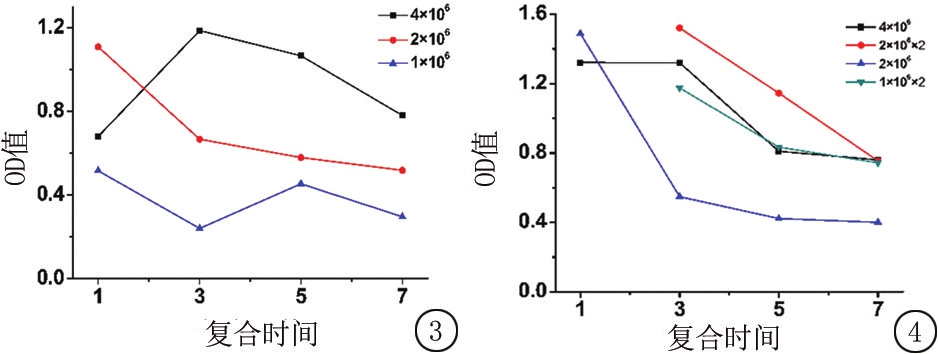
图3 细胞浓度和复合时间对复合效果的影响
图4 细胞浓度和复合次数对复合效果的影响
表1 预处理方法对复合效果的影响![]()

方法4×1062×106新法1.306±0.1292.013±0.049 旧法1.415±0.0581.684±0.156 t值1.3383.481P值0.2520.025
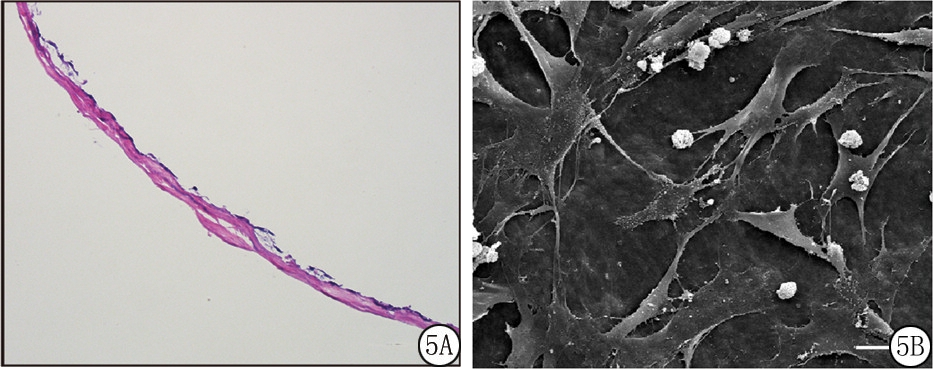
图5 复合MSCs后的SIS
A.标尺=100 μm ;B.标尺=25 μm
3 讨 论
先天畸形及后天疾病均可导致阴道缺失,给患者带来躯体的痛苦和巨大的精神心理压力,严重影响生活质量,因此重建一个结构和功能均接近生理状态的阴道显得尤为重要。目前最常用的重建方法是在膀胱和直肠之间造穴,并以各种不同的组织衬里覆盖创面重建阴道,组织衬里的选择在很大程度上决定了手术效果,常用的组织衬里有腹膜、皮片、皮瓣、腔黏膜、头皮等自体组织及羊膜、胎儿皮肤等异体组织,自体组织重建阴道给患者带来新的创伤且存在自体取材受限的问题,异体组织又可能感染外源性疾病,均非理想的组织衬里材料,近年来随着组织工程学的发展为阴道重建提供了新思路。Zhu等[9]用脱细胞真皮基质,Ding等[10]用小肠黏膜下基质作为衬里施行阴道重建术均获得了比较满意的结果,但是单纯应用支架组织仍有一定的弊端,如术后阴道黏膜鳞化速度较慢使患者开始性生活的时间较长等[11]。种子细胞与支架材料复合能促进重建阴道各种组织成分的再生,可能构建一个更接近生理状态的阴道。
SIS主要由猪的小肠制备,含有多种因子,如成纤维细胞生长因子,血管内皮生长因子和转化生长因子β等[1],能促进组织的修复,相容性好[12],利于细胞的附着和生长,使其成为组织工程支架的最佳选择,已经应用于多种组织的重建。本研究采用Abraham等[8]的方法制备SIS,HE染色后未发现有细胞残留,MSCs在制备SIS上生长状态良好,扫描电镜下可见细胞附着在SIS表面,呈长梭形或不规则形状。
目前用于阴道重建的种子细胞主要有阴道上皮细胞、颊黏膜上皮细胞、阴道平滑肌细胞[13-14]。虽然复合这些细胞可以促进阴道上皮和肌层再生,但是上皮细胞、平滑肌细胞培养条件苛刻,不利于大量培养和临床应用。MSCs来源充足,分离培养方法成熟,易于培养,且有多向分化能力。最近研究发现,干细胞可向神经细胞分化[15],有利于神经再生,非常适合作为种子细胞与SIS复合后重建阴道。
前期研究显示,MSCs复合SIS能促进重建阴道的修复[6-7],但修复效果不甚理想。局部干细胞的数量可能影响治疗效果,复合条件的筛选尤为重要。MSCs与SIS复合情况主要与MSCs的复合浓度、复合时间、复合次数及SIS的预处理方法有关。关于接种密度和复合时间各文献报道不一,细胞接种密度从2×105个/cm2[16],5×105个/cm2[2],8×105个/cm2[17]、1×106个/cm2[18]均有报道。复合时间有24 h者[19]、48 h者[16],也有复合5 d[19]、1周[17]者。为了确定合理的接种密度和复合时间,本研究采用MTT法检测了不同密度和不同复合时间后的吸光度,结果显示,2×105个/孔(约5×105个/cm2)最适合细胞黏附。细胞密度过大可能影响细胞展开黏附,或营养不足影响细胞活性和黏附率。细胞密度过小虽能保证黏附但总的细胞附着数量有限。本研究还比较了复合次数对复合情况的影响,分2次复合并不比单次复合后1 d的附着率高,因此最终确定以2×105个/孔复合1 d效果最佳。由于SIS在培养基中复水后漂浮于培养基中,细胞接种后不能有效地覆盖于SIS上,将SIS在培养基中复水24 h后吸净培养基排除SIS与培养孔底之间的气泡,使SIS完全贴附于培养孔底部,静置干燥后SIS于培养孔底黏附较紧,再次添加培养基复水后仍能黏附于孔底,使细胞能有效地覆盖于SIS上,利于细胞附着。2×105个/孔的MSCs与经过处理后的SIS复合时黏附率高于单纯预湿的SIS。4×105个/孔的MSCs与经过处理后的SIS复合时黏附率低于单纯预湿的SIS,进一步证实过高浓度不利于细胞附着。
本研究探讨了MSCs与SIS最佳的复合方法,最终确定采用新的预湿方法,以2×106/mL的浓度与SIS复合1 d后用于移植,为后续的研究奠定了基础。
[1] Wang W,Zhang X,Chao NN,et al. Preparation and characterization of pro-angiogenic gel derived from small intestinal submucosa[J]. Acta Biomater,2016,29:135-148.
[2] Guo X,Xia B,Lu XB,et al. Grafting of mesenchymal stem cell-seeded small intestinal submucosa to repair the deep partial-thickness burns[J]. Connect Tissue Res,2016,57(5):388-397.
[3] Kanetaka K,Kobayashi S,Eguchi S. Regenerative medicine for the esophagus[J]. Surg Today,2018,48(8):739-747.
[4] Nakatsu H,Ueno T,Oga A,et al. Influence of mesenchymal stem cells on stomach tissue engineering using small intestinal submucosa[J]. J Tissue Eng Regen Med,2013,9(3):296-304.
[5] Chang CW,Petrie T,Clark A,et al. Mesenchymal stem cell seeding of porcine small intestinal submucosal extracellular matrix for cardiovascular applications[J]. PLoS One,2016,11(4):e0153412.
[6] Li Y,Liu F,Zhang Z,et al. Bone marrow mesenchymal stem cells could acquire the phenotypes of epithelial cells and accelerate vaginal reconstruction combined with small intestinal submucosa[J]. Cell Biol Int,2015,39(11):1225-1233.
[7] Zhang N,Qin X,Zhang J,et al. Bone marrow mesenchymal stem cells accelerate the morphological and functional recovery of neovaginas[J]. Artif Organs,2018[Epub ahead of print].
[8] Abraham GA,Murray J,Billiar K,et al. Evaluation of the porcine intestinal collagen layer as a biomaterial[J]. J Biomed Mater Res,2000,51(3):442-452.
[9] Zhu L,Zhou H,Sun Z,et al. Anatomic and sexual outcomes after vaginoplasty using tissue-engineered biomaterial graft in patients with Mayer-Rokitansky-Kuster-Hauser syndrome:a new minimally invasive and effective surgery[J]. J Sex Med,2013,10(6):1652-1658.
[10] Ding JX,Chen LM,Zhang XY,et al. Sexual and functional outcomes of vaginoplasty using acellular porcine small intestinal submucosa graft or laparoscopic peritoneal vaginoplasty:a comparative study[J]. Hum Reprod,2015,30(3):581-589.
[11] 陈丽梅,丁景新,张英,等.人工阴道成形术中生物补片代阴道与腹腔镜下腹膜代阴道的比较[J].现代妇产科进展,2014,23(7):541-544.
[12] 王亮,刘梅宝,陈双.猪小肠黏膜下层脱细胞组织基质材料的制备与体内相容性的检验[J/CD].中华疝和腹壁外科杂志(电子版),2016,10(2):89-93.
[13] 章艺群,丁景新,华克勤.组织工程技术在人工阴道成形术的应用新进展[J].现代妇产科进展,2015,24(7):556-558.
[14] 张明乐,黄向华,李雅钗,等.原位与体内构建小鼠组织工程阴道的实验研究[J].实用妇产科杂志,2013,29(4):277-281.
[15] 李鹏涛,高志红,段晓亮,等.黄芪甲苷Ⅳ诱导SAMR1小鼠骨髓间充质干细胞分化为神经细胞的实验研究[J].河北医科大学学报,2018,39(11):1338-1343.
[16] Wang D,Ding X,Xue W,et al. A new scaffold containing small intestinal submucosa and mesenchymal stem cells improves pancreatic islet function and survival in vitro and in vivo[J]. Int J Mol Med,2017,39(1):167-173.
[17] Tan B,Wei RQ,Tan MY,et al. Tissue engineered esophagus by mesenchymal stem cell seeding for esophageal repair in a canine model[J]. J Surg Res,2013,182(1):40-48.
[18] Pokrywczynska M,Jundzill A,Bodnar M,et al. Do mesenchymal stem cells modulate the milieu of reconstructed bladder wall?[J]. Arch Immunol Ther Exp(Warsz),2013,61(6):483-493.
[19] Lam MT,Nauta A,Meyer NP,et al. Effective delivery of stem cells using an extracellular matrix patch results in increased cell survival and proliferation and reduced scarring in skin wound healing[J]. Tissue Eng Part A,2013,19(5/6):738-747.