目前癌症已成为严重威胁人类生存和社会发展的重大疾病之一,其中我国乳腺癌发病率明显增高,增速超过发达国家,位列世界首位[1]。手术是乳腺癌治疗中的重要手段,而化疗及内分泌治疗的合理应用也能对预后起着举足轻重的作用。脂肪性肝病是患者化疗和内分泌治疗期间的常见并发症,一般认为是抗癌药物引起的,但是化疗及内分泌治疗期间的加强饮食措施是否为造成脂肪性肝损害的另一原因?为明确上述两类药物及高脂饮食在乳腺癌治疗过程中所伴发的肝损害尤其是脂肪性肝损害所起的作用,本研究进行了相应的动物实验加以证实。
1 材 料 与 方 法
1.1 实验动物 选用北京兴隆实验动物公司提供的40只普通级健康雌性新西兰白兔[动物生产许可证号SCXK(京)2016-0003],体重(2.3±0.1) kg,随机分为4组,每组10只,在恒温饲养室[温度(20±3)℃,湿度(55±5)%]单笼喂养1周,以适应实验环境。
1.2 实验方法 A 组给予普通饲料+淀粉喂养6个月,B组给予高脂饲料喂养6个月,C组给予化疗药(表阿霉素2.8 mg/kg+环磷酰胺28 mg/kg)+内分泌药(三苯氧胺0.6 mg/kg)+普通饲料喂养,D组给予化疗药(表阿霉素2.8 mg/kg+环磷酰胺28 mg/kg)+内分泌药(三苯氧胺0.6 mg/kg)+高脂饲料喂养。 C组和D组家兔每3周兔耳缘静脉给予化疗药1次,6个周期后,再予以三苯氧胺灌胃3个月,1次/d。每组均于实验前、实验结束时耳缘静脉取血检测天冬氨酸转氨酶(aspartate aminotransferase,AST) 、丙氨酸转氨酶(alanine aminotransferase,ALT)、总胆固醇(total cholesterol,TC)、三酰甘油(triglyceride,TG),同时行肝脏超声检查及肝实质声辐射力脉冲成像(acoustic radiation force impulse imaging,ARFI)检测,即剪切波速度测量。实验结束时腹腔注射氨基甲酸乙酯处死家兔,剖腹取肝做标本,4%多聚甲醛溶液固定,请两名高年资病理主任医师观察切片,病理所见与肝脏声像图进行对照研究。
本研究由河北大学实验动物福利伦理审查委员会批准。
1.3 超声检查 应用德国Siemens S2000彩超仪,选择高频(4.0~9.0 MHz)线阵探头扫查。使实验兔仰卧,腹部去毛,涂耦合剂后做超声扫查,首先观察兔肝的大小、形态、包膜光滑度、内部实质回声、肝内外管道走行、管径变化及管壁回声强度等情况,然后启动剪切波速度测定功能,在右肋间门脉长轴切面距体表2.0 cm处,避开肝内管道系统测量肝实质的剪切波速度值,随机取3个等深点测量,每个等深点测3次,共计9个数值平均后进行统计处理。
1.4 统计学方法 应用SPSS22.0统计软件处理数据。计量资料比较采用配对t检验、F检验和SNK-q检验。P<0.05为差异有统计学意义。
2 结 果
2.1 肝功能比较 实验前A、B、C、D四组间AST值与ALT值差异均无统计学意义(P>0.05);实验后AST值A、B、C、D四组间差异有统计学意义(P<0.05),进一步两两比较,B、C、D组均高于A组,C、D两组均高于B组,差异均有统计学意义(P<0.05),但C、D两组间差异无统计学意义(P>0.05);实验后ALT值A、B、C、D四组间差异有统计学意义(P<0.05),进一步两两比较,B、C、D组均高于A组,C、D两组均高于B组,D组高于C组,差异均有统计学意义(P<0.05);AST值与ALT值除A组实验前后差异无统计学意义(P>0.05)外,其余各组实验前后差异均有统计学意义(P<0.05)。见表1。
表1 四组实验前后肝功能比较
Table 1 Comparison of liver function pre and post experiment among four groups ![]()

组别AST实验前实验后ALT实验前实验后A组25.19±0.7323.96±2.5629.77±0.9129.11±1.62B组25.81±0.9188.41±2.32*☆29.66±1.0675.66±1.19*☆C组26.04±1.38100.16±4.62*#☆29.88±1.2591.62±1.01*#☆D组25.88±1.11100.35±3.56*#☆29.67±1.0994.10±1.02*#△☆F值0.0991 086.0170.1265 927.220P值0.906<0.0010.882<0.001
*P值<0.05与A 组比较 #P值<0.05与B组比较 △P值<0.05与C组比较(SNK-q检验) ☆P值<0.05 与实验前比较(配对t检验)
2.2 血脂比较 实验前A、B、C、D四组间TC值与TG值差异均无统计学意义(P>0.05);实验后TC值A、B、C、D四组间差异有统计学意义(P<0.05),进一步两两比较,B、C、D组均高于A组,D组高于B组,B、D两组均高于C组,差异均有统计学意义(P<0.05);实验后TG值A、B、C、D四组间差异有统计学意义(P<0.05),两两比较发现,B、C、D组均高于A组,B、D两组均高于C组,差异均有统计学意义(P<0.05);TC值与TG值除A组实验前后差别无统计学意义(P>0.05)外,其余各组实验前后差异均有统计学意义(P<0.05)。见表2。
表2 四组实验前后血脂比较
Table 2 Comparison of serum lipids pre and post experiment among four groups ![]()

组别TC实验前实验后TG实验前实验后A组1.52±0.321.50±0.431.56±0.081.42±0.25B组1.53±0.22 101.79±0.59*△☆1.57±0.122.23±0.13*△☆C组1.46±0.23 2.32±0.47*☆1.55±0.13 1.67±0.19*☆D组1.43±0.32 105.35±0.56*#△☆1.59±0.122.14±0.14*#△☆F值0.398128 577.7710.29041.606P值0.676 <0.0010.750<0.001
*P值<0.05与A组比较 #P值<0.05与B组比较 △P值<0.05与C组比较(SNK-q检验) ☆P值<0.05与实验前比较(配对t检验)
2.3 超声结果比较 A组实验前后声像图无明显异常变化;实验后B组显示肝体积稍增大,包膜光滑,肝实质回声致密增强(图1);C组显示肝体积无明显增大,肝包膜欠光滑,肝实质回声稍增强,欠均匀,肝内外胆管及门脉无扩张,但胆管壁及门脉管壁回声稍增强(图2);D组除了C组超声表现外,还可见肝实质致密增强表现(图3)。实验前A、B、C、D各组间剪切波速度值差异无统计学意义(P>0.05);实验后A、B、C、D各组间剪切波速度值差异有统计学意义(P<0.05),进一步两两比较,B、C、D组均明显高于A组,其差异均有统计学意义(P<0.05);剪切波速度值除A组实验前后差异无统计学意义(P>0.05)外,其余各组实验前后差异均有统计学意义(P<0.05)。见表3。
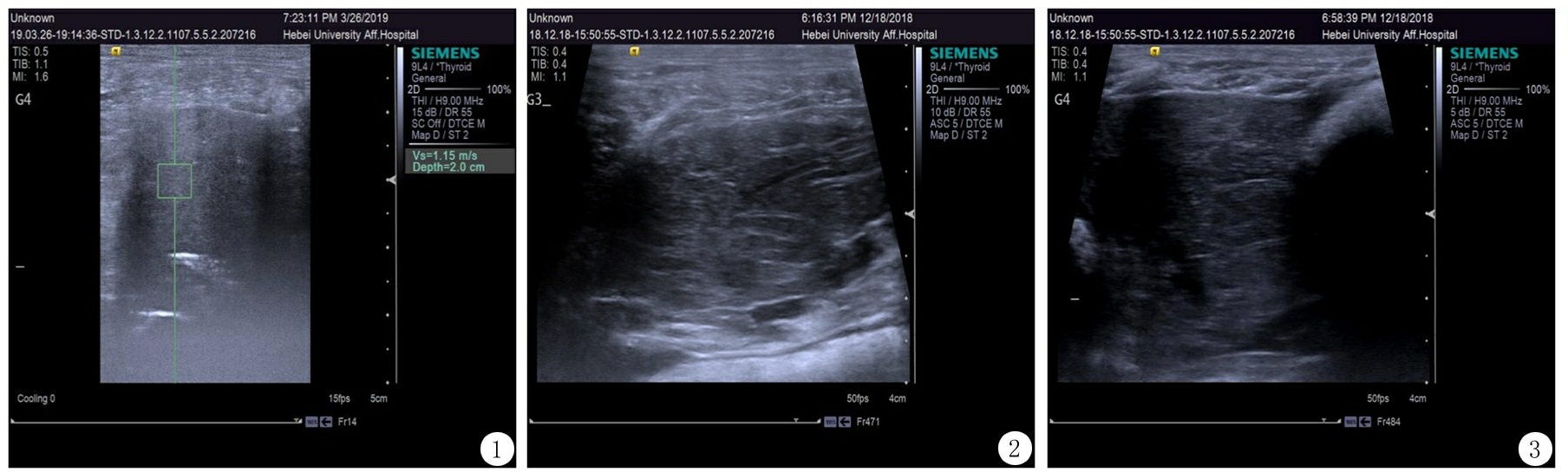
图1 B组兔实验后肝体积稍增大,包膜光滑,肝实质回声致密增强
Figure 1 In group B, the volume of liver increased slightly, the envelope was smooth, and the echo of liver parenchyma was dense and enhanced
图2 C组兔实验后肝包膜欠光滑,肝实质回声稍增强,欠均匀,胆管及门脉管壁回声稍增强
Figure 2 In group C, the liver capsule was not smooth, the echo of liver parenchyma was slightly enhanced and uneven, and the echo of bile duct and portal vein wall was slightly enhanced
图3 D组兔实验后肝体积稍大,肝包膜欠光滑,肝实质回声稍增强致密,胆管及门脉管壁回声稍增强
Figure 3 In group D, the liver volume was slightly larger, the liver capsule was not smooth, the echo of liver parenchyma was slightly enhanced and dense, and the echo of bile duct and portal vein wall was slightly enhanced
表3 四组实验前后剪切波速度比较
Table 3 Comparison of ARFI pre and post experiment among four groups![]()
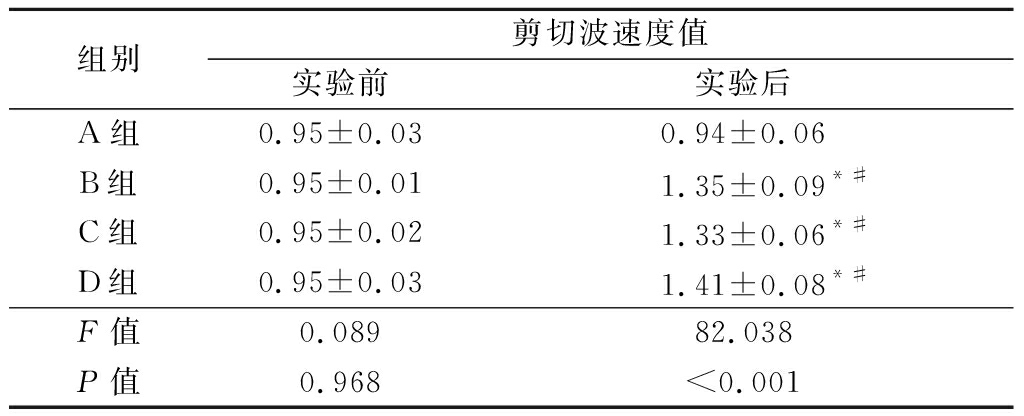
组别剪切波速度值实验前实验后A组0.95±0.030.94±0.06B组0.95±0.011.35±0.09*#C组0.95±0.021.33±0.06*#D组0.95±0.031.41±0.08*#F值0.08982.038P值0.968<0.001
*P值<0.05 与 A 组比较(SNK-q 检验) #P值<0.05 与实验前比较(配对t检验)
2.4 四组实验后病理检查结果 A组实验后未见异常改变;B组可见中-重度脂肪变性、轻-中度水肿(图4),少量局限性炎细胞浸润;C组可见轻度脂肪变性,中至重度水肿,局灶性淤血及淤胆,少-中量炎细胞浸润,部分炎细胞浸润胆管壁及血管壁,肝细胞点片状坏死,少量局灶性纤维化(图5,6);D组可见中至重度脂肪变性,中至重度水肿,局灶性淤血及淤胆,少-中量炎细胞浸润,肝细胞点片状坏死,少量局灶性纤维化,还可见肝结节再生(图7)。
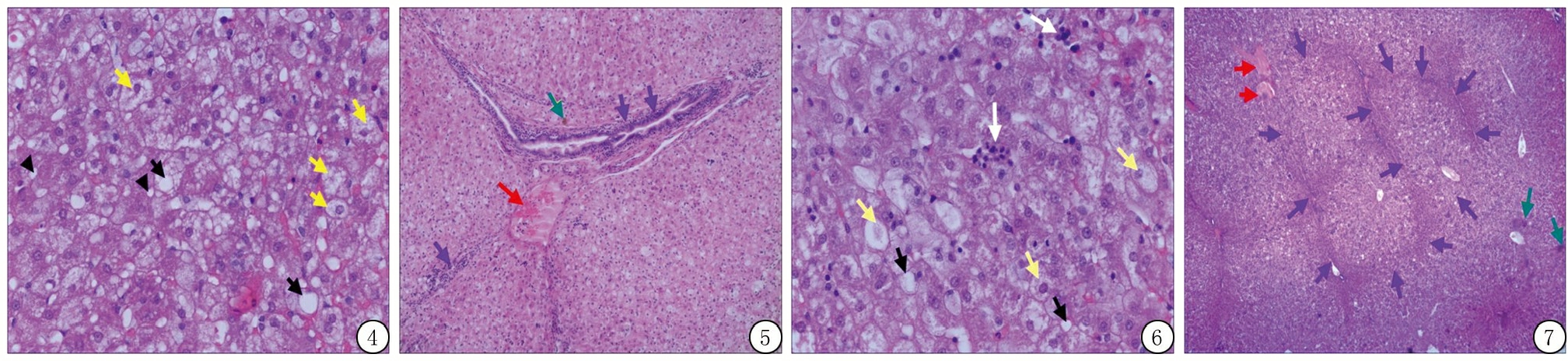
图4 B组兔肝显示较多大泡状及小泡状脂肪变性(黑箭头),及肝细胞水肿(黄箭头)(HE ×400)
Figure 4 Pathological findings of rabbit's liver in group B(HE ×400)
图5 C组兔肝可见汇管区炎细胞浸润(蓝箭头)、血管内淤血(红箭头)及淤胆(绿箭头)(HE ×100)
Figure 5 Pathological findings of rabbit's liver in group C(HE ×100)
图6 C组兔肝可见细胞点片状坏死(白箭头)、脂肪变性(黑箭头)及细胞水肿(黄箭头)(HE ×400)
Figure 6 Pathological findings of rabbit's liver in group C(HE ×400)
图7 D组兔肝可见肝结节再生及纤维隔(紫箭头),还可见淤血(红箭头)及淤胆(绿箭头)(HE ×100)
Figure 7 Pathological findings of rabbit's liver in group D(HE ×100)
3 讨 论
近些年来,我国女性恶性肿瘤中乳腺癌的发病率及病死率均居前列,手术治疗联合术后适当的化疗以及内分泌治疗是非常重要的治疗手段[2]。但是,临床上发现在化疗及内分泌治疗过程中,患者除了出现常见的肝肾损害、胃肠道反应和血液系统问题外,还会出现不同程度的脂肪性肝损伤,超声检查时显示为类似脂肪肝的声像图表现,且肝功能及血脂检查常出现异常,乳腺癌患者所用化疗药物及其内分泌药物多数具有不同程度的肝脏毒性,会损伤肝细胞,发生脂肪变性,其机制为:①如烷化剂环磷酰胺等可活化微粒体细胞色素CY450酶,从而产生代谢产物磷酰胺氮芥和丙烯醛,后者触发活性氧产生,活性氧又导致脂质过氧化及蛋白质羰基化,从而造成慢性肝损伤并产生脂肪代谢障碍,最终引起脂肪肝[3];②表阿霉素(epirubicin,EPI)等化疗药对肿瘤细胞杀伤的同时,在肝内代谢,影响了谷胱甘肽的合成,削弱了抗氧化能力,从而产生过多自由基,干扰了脂肪酸的氧化过程[4];③三苯胺在体内能抑制脂蛋白脂肪酶和肝脏三酰甘油脂肪酶活性,从而抑制三酰甘油水解成脂肪酸,使三酰甘油升高[5],此外可增强肝脂质合成,抑制肝线粒体脂肪酸氧化[6],使脂肪组织增生标志物Ki67 mRNA高表达,使血脂增高[7-8]。根据全肝中脂肪变性的的肝细胞所占的比例,脂肪肝病理分级标准为:正常,肝细胞脂肪变性<5%;轻度,肝细胞脂肪变性为5%~33%;中度,肝细胞脂肪变性为34%~66%;重度,肝细胞脂肪变性>66%[9]。随着脂肪变性程度加重,随后出现的功能障碍导致了氧化应激增强,包括炎性细胞因子释放,炎细胞的动员可引起星状细胞活化,伴随细胞外基质产生,随后的细胞性事件(cellular events),如线粒体释放的活性氧(reactive oxygen species,ROS)和(或)促炎性细胞因子的释放可导致更为严重的情况——脂肪性肝炎[10],所以,脂肪肝及肝细胞损害如果不控制,会影响化疗及内分泌药物治疗的进行,从而影响原发肿瘤治疗。美国国家癌症研究所对药物性肝损害分了5级,1级为AST大于1倍正常高限值~2.5倍正常高限值,ALT大于1倍正常高限值~3倍正常高限值;2级为AST大于2.5倍高限值~5倍正常高限值,ALT大于3倍正常高限值~5倍正常高限值,门脉血流减少;3级为AST和ALT均大于5倍正常高限值~20倍正常高限值,为轻度肝损害,出现扑翼样震颤,反向门脉血流,及静脉曲张或腹水;4级为AST和ALT均大于20倍正常高限值,为中至重度肝损害,生命受到威胁,需紧急干预;5级为死亡[11]。Azad等[12]对284例泌尿系癌症应用化疗药2年以上的患者引起肝损害的情况进行了研究,18.9%患者出现药物性肝损害(定义为ALT>3×正常高限值),其中59%的患者调整了治疗方案。本研究中B组喂养高脂饲料后血脂明显升高,转氨酶也轻度升高,超声上出现肝体积稍大,实质回声致密增强,肝内管道走形欠清晰,肝功能也有轻度受损,说明兔肝出现了一定程度的脂肪变性或脂肪性肝炎。C组应用了6个周期化疗药和3个周期内分泌药,转氨酶升高(ALT及AST均>1倍~2倍正常高限值),说明化疗药加上后继的内分泌药对肝功损害还是比较明显的。C组血脂也轻度升高,与用药前比较虽然差异有统计学意义,但均未超过临床标准,所以没有实际意义。D组在应用和C组相同药物的基础上改喂高脂饲料,以模拟乳腺癌患者在化疗及内分泌治疗中补充高脂营养素的情况,结果显示D组的肝功能及血脂均异常,且肝功能较B组和C组均高,血脂高于C组,说明应用化疗药+内分泌药+高脂饲料后较单纯化疗药+内分泌药对肝脏的损害更为明显;B组、D组血脂较A组和C组均明显增高,可能与喂食高脂饲料有关。化疗药物及内分泌药物导致肝损害的主要机制包括:①化疗药物中间代谢产物与肝细胞成分通过共价键结合产生新的抗原,导致免疫反应,产生特异性抗体,从而造成肝细胞损伤,干扰肝脏线粒体功能[13];②化疗药物代谢产物可以形成氧自由基导致脂质过氧化,还能耗竭肝脏谷胱甘肽储备,间接引起肝损害[14];③应用环磷酰胺后产生的活性氧/活性氮(reactive nitrogen species,RNS)可导致应激信号传递和激活促炎通路,从活化的库普弗细胞释放的促炎趋化因子和细胞因子趋化中性粒细胞和其他炎性细胞,最终导致细胞凋亡或坏死,局灶纤维化[3];④他莫昔芬作为抗雌激素类内分泌药可造成脂肪酸蓄积,从而导致CYP4A1表达亢进,线粒体受氧化应激作用引发过氧化脂质蓄积而导致线粒体功能不全,进而引起肝细胞凋亡[15]。由上述致病机制可造成肝脏脂肪变性、细胞水肿、细胞质空泡化、炎细胞浸润、局灶纤维化甚至坏死,肝再生结节生成、胆管损害及血管性损害等[16]。本研究中病理结果显示B组可见中-重度脂肪变性、轻-中度水肿,炎细胞浸润,可能是较长时间喂养高脂饲料造成肝细胞脂肪浸润,进而诱发氧化应激反应及促炎细胞因子释放导致炎细胞浸润[17];C组可见轻度脂肪变性,中至重度水肿,局灶性淤血及淤胆,少-中量炎细胞浸润,肝细胞点片状坏死,局灶性纤维化。因本组应用了化疗药继而使用内分泌药,对肝脏损害较明显;D组除了出现C组的主要病理改变,脂肪变性更明显,还可见肝结节再生。本组除了应用化疗药、内分泌药外还加了高脂饲料,因此对肝脏损害最为明显。超声检查是基于组织器官的结构形成的反射界面而显像的诊断技术,界面规整,实质组织均匀则反射回来的超声波平滑,清晰。A组因肝组织结构正常,超声也呈正常图像表现。B组喂食高脂饲料导致了脂肪浸润,肝体积稍增大,在超声上表现为肝厚径增大,肝包膜尚光滑,肝实质内部回声由于脂肪沉积显示为回声致密增强,呈脂肪肝超声表现。C组应用化疗药和内分泌药,脂肪变性较轻,以其他损害为主,致使肝结构回声界面杂乱,所以体积不大,但包膜欠光滑,实质回声欠均匀,管壁欠光滑,可能与炎细胞浸润、管壁受损、淤胆、淤血、坏死及纤维化有关。D组除了应用化疗药和内分泌药外,还加了高脂饲料,所以病理损害最为明显,除了C组超声表现外,还有脂肪肝的超声表现。综上所述,D组血生化结果、超声表现及病理所见与临床上经过几个化疗及内分泌治疗周期后乳腺癌患者出现的脂肪肝相吻合。大多数乳腺癌患者术后化疗及内分泌治疗过程中要遵照医嘱,食用较多高营养饮食以加强营养,引起营养物质过剩,同本实验中D组家兔模拟实验的条件相似。有研究表明[18]化疗及内分泌治疗的过程中所摄入的过多脂肪物质是化疗后形成脂肪肝的一个因素。所以,患者过剩的营养物质会造成过多脂肪沉积于肝内引起脂肪肝。
ARFI是超声弹性成像的一种,因其在检查中可无创评估组织的硬度,在鉴别肿瘤良恶性病变及肝脏纤维化硬化诊断中有较好的应用价值[19]。其原理是ARFI探头发出一个短阵脉冲,同时产生一个沿超声波走行的剪切波,遇到声阻抗介质时产生一个定量的剪切波回波,其速度值与组织弹性相关,弹性好(硬度小)速度慢,弹性差(硬度大)速度快[20]。林甲育等[21]利用ARFI技术对97例慢性乙型肝炎和120例健康对照组肝脏进行了检测,并行肝组织活检,以病理结果为金标准,结果显示SWV值在正常对照组为(1.12±0.21) m/s,肝病组(非硬化组)组为(1.62±0.34) m/s,肝硬化组为(2.41±0.49) m/s,各病理分期存在明显变化,随肝组织纤维化和硬化的产生而上升。本研究用ARFI对4组兔肝脏进行了测定,实验后B组、C组及D组家兔肝脏平均剪切波速度较实验前有所增加,超过正常范围,但未到明显纤维化和硬化的程度。本研究病理结果显示B组、C组及D组兔肝实质及汇管区均发生一定程度的炎细胞浸润、纤维化和再生结节使硬度相对增加,通过对比SWV值与病理结果,与上述文献报道基本一致。这表明ARFI除了对纤维化和硬化以外的其他肝脏疾病(如脂肪性肝损害、化疗性肝损害)的评估也有一定的应用价值。
本动物实验中C组应用了6个周期的化疗药物及3个周期的内分泌药物,常规超声检查兔肝时没有出现明显的脂肪肝声像图表现,血TC、TG检查仅轻度升高,兔肝病理仅出现轻度脂肪变性,超声上未出现明显的脂肪肝表现,而应用同样化疗药和内分泌药的D组,加了高脂饲料,实验兔出现了明显的脂肪肝声像图表现,同时生化检查中TC、TG明显升高,病理也显示中-重度脂肪变性。B组单纯给予高脂饲料,也出现了脂肪肝的超声表现。本实验表明,仅给化疗药及内分泌药的肝脏虽出现脂肪变性及其他病理改变,但不会出现明显的脂肪肝超声图像改变,这与部分学者认为的“化疗性脂肪肝”[22]不太符合,这也可能是物种差异或药物用时较短所致,但从本实验所得结果来看,笔者认为临床上应用化疗药和内分泌药治疗期间或之后超声上显示出来的的脂肪肝可能主要是由于患者治疗期间补充大量营养物质所致,并非单纯只由化疗药及内分泌药物引起,也可能是多种因素综合作用的结果,这需要进一步研究。
[1] 王宁,刘硕,杨雷,等.2018全球癌症统计报告解读[J/CD].肿瘤综合治疗电子杂志,2019,5(1):87-97.
[2] 中国抗癌协会乳腺癌专业委员会.中国抗癌协会乳腺癌诊治指南与规范(2019年版)[J]. 中国癌症杂志,2019,29(8):609-679.
[3] Aladaileh SH,Abukhalil MH,Saghir SAM,et al. Galangin activates nrf2 signaling and attenuates oxidative damage,inflammation,and apoptosis in a rat model of cyclophosphamide-induced hepatotoxicity[J]. Biomolecules,2019,9(8):346-364.
[4] Jing X,Sun C,Chen H,et al. Protection of paeonol against epirubicin-induced hepatotoxicity:a metabolomic study[J]. Biosci Trends,2019,13(3):253-260.
[5] Tey TT,Maung AC,Lim KW,et al. Acute pancreatitis caused by tamoxifen-induced severe hypertriglyceridemia after 4 years of tamoxifen Use[J]. ACG Case Rep J,2019,6(2):1-3.
[6] Hozumi Y,Kawano M,Saito T,et al. Effect of tamoxifen on serum lipid metabolism[J]. J Clin Endocrinol Metab,1998,83(5):1633-1635.
[7] Hesselbarth N,Pettinelli C,Gericke M,et al. Tamoxifen affects glucose and lipid metabolism parameters,causes browning of subcutaneous adipose tissue and transient body composition changes in C57BL/6NTac mice[J]. Biochem Biophys Res Commun,2015,464(3):724-729.
[8] Zhao L,Wang B,Gomez A,et al. Even a low dose of tamoxifen profoundly induces adipose tissue browning in female mice[J]. Int J Obes(Lond),2020,44(1):226-234.
[9] 中华医学会肝病学分会脂肪肝和酒精性肝病学组. 中国非酒精性脂肪性肝病诊疗指南(2010 年修订版)[J/CD].中国医学前沿杂志(电子版),2012,4(7):4-10.
[10] Pavlik L,Regev A,Ardayfio PA,et al. Drug-induced steatosis and steatohepatitis: the search for novel serum biomarkers among potential biomarkers for non-alcoholic fatty liver disease and non-alcoholic steatohepatitis[J].Drug Saf,2019,42(6):701-711.
[11] National Cancer Institute.Cancer therapy evaluation program.common terminology criteria for adverse events(CTCAE)v5.0(2017)[EB/OL].(2017-11-27)[2020-01-22].https://ctep.cancer.gov/protocolDevelopment/electronic_applications/ctc.htm.
[12] Azad A,Chang P,Devuni D,et al.Real world experience of drug induced liver injury in patients undergoing chemotherapy[J]. J Clin Gastroenterol Hepatol,2018,2(3): 18-32.
[13] Vincenzi B,Armento G,Ceruso MS,et al. Drug-induced hepatotoxicity in cancer patients-implication for treatment[J].Expert Opin Drug Saf,2016,15(9):1219-1238.
[14] Dara L,Liu ZX,Kaplowitz N. Mechanisms of adaptation and progression in idiosyncratic drug induced liver injury,clinical implications[J]. Liver Int,2016,36(2):158-165.
[15] Gao H,Cao Y,Xia H,et al. CYP4A11 is involved in the development of nonalcoholic fatty liver disease via ROS induced lipid peroxidation and inflammation[J]. Int J Mol Med,2020,45(4):1121-1129.
[16] Kleiner DE. Drug-induced liver injury: the hepatic pathologist′s approach[J]. Gastroenterol Clin North Am,2017,46(2): 273-296.
[17] Roh YS,Seki E. Chemokines and Chemokine receptors in the development of NAFLD[J]. Adv Exp Med Biol,2018,1061:45-53.
[18] 张亦琳,赵万红,张王刚,等. 非霍奇金淋巴瘤化疗后脂肪肝形成临床研究[J].现代肿瘤医学,2018,26(24):4004-4007.
[19] Lin Y,Li H,Jin C,et al. The diagnostic accuracy of liver fibrosis in non-viral liver diseases using acoustic radiation force impulse elastography:a systematic review and meta-analysis[J].PLoS One,2020,15(1):e0227358.
[20] Urban MW. Production of acoustic radiation force using ultrasound: methods and applications[J]. Expert Rev Med Devices,2018,15(11): 819-834.
[21] 林甲育,王朋会,吴锡新.慢性乙型肝炎肝纤维化瞬时弹性成像和声脉冲辐射力成像技术诊断与病理的对比研究[J].河北医科大学学报,2013,34(2):216-218.
[22] 戎黛琳,杨秋霞,许淑霞,等. 乳腺癌化疗及内分泌治疗相关性脂肪肝的影像学定量评估[J]. 国际医学放射学杂志,2017,40(1): 51-55.