腕管综合征(carpal tunnel syndrome,CTS)是常见的周围神经卡压性疾患之一,也是骨科医生最常进行手术治疗的周围神经疾病。CTS的病理基础是正中神经在腕管内受卡压,其单纯行手术松解术后,常因正中神经再生恢复不完全,遗留手部畸形,神经感觉、运动等功能部分障碍,不同程度影响患者生活,因此,其损伤后的再生修复成为临床上的一大难题。自体富血小板血浆(platelet-rich plasma,PRP)是由自体新鲜全血提取的富含血小板的血浆,其含有大量各种生长因子,能促进组织再生的功效,在临床中得到多方证实[1-2],这些生长因子参与受损周围神经的再生与修复过程,可以促进和诱导周围神经的功能恢复,甚至还可促进神经肌肉单元的恢复[3]。目前PRP在临床中多被用于促进骨组织和软组织的损伤修复[4],在周围神经系统疾病的治疗上用于治疗面神经和坐骨神经损伤,均取得良好效果。但目前国内尚未见其有关CTS松解术后对正中神经功能恢复的研究。笔者在治疗CTS时,行腕管切开减压正中神经松解术后,于神经卡压处注射PRP,观察正中神经功能恢复情况,临床疗效满意,现报告如下。
1 资 料 与 方 法
1.1 一般资料 选择2016年6月—2018年6月在河北医科大学第一医院治疗的CTS的患者40例,按随机数字表法分为对照组和PRP注射组各20例。对照组男性7例,女性13例,年龄35~65岁,平均(45.43±6.71)岁。病程为30 d~1.5年。其中手工业者7例,家庭主妇10例,电脑操作者3例,糖尿病患者1例;均为单侧发病,其中左侧6例,右侧14例。PRP注射组男性4例,女性16例,年龄33~67岁,平均(44.21±7.23)岁。病程为40 d~1.5年。其中手工业者5例,家庭主妇11例,电脑操作者4例,糖尿病患者0例;均为单侧发病,其中左侧5例,右侧15例。两组一般资料差异无统计学意义(P>0.05),具有可比性。
所有患者没有神经系统疾病,正中神经连续性正常,临床表现为拇指、示指、中指和环指桡侧半感觉麻木,可出现大鱼际最桡侧肌肉萎缩,拇指不灵活,外展力量减弱,与其他手指对捏的力量下降甚至不能完成对捏动作。
本研究经医院院伦理委员会批准,所有患者均知情同意并签署知情同意书。
1.2 方法 对照组行腕管切开减压正中神经松解术,在臂丛神经阻滞麻醉起效后,上臂根部上气囊止血带,自鱼际纹的近端部分至腕横纹尺侧做S形切口,切开皮肤、皮下组织并向两侧牵开直达腕横韧带,切开腕横韧带,显露正中神经,寻找受压原因并予以解除,正中神经若受压增厚,可用显微操作方法切除增厚的外膜,松止血带后,逐层关闭切口。PRP注射组行腕管切开减压正中神经松解+PRP注射术,在手术开始时静脉采血50 mL,注入专用试管,放入离心机以250 g离心10 min,取出试管,吸取上清液至液面下3 mm,移至另一试管,放入离心机,以离心力1 000 g离心10 min,以移液枪缓慢吸取透明血浆,留取下层血浆,白膜层及红细胞层混匀即为PRP。将获得的PRP保存好备用。腕管切开减压正中神经松解同对照组,区别在于关闭切口前将制备的约2 mL PRP注射于松解的正中神经周围。采用退针注射技术,将套盒所带30 G长针头与1 mL注射器连接固定,针头深入正中神经周围,由深至浅,由远及近,边退边注射,力求均匀弥散分布。待血浆凝固后,逐层缝合切口,术后加压包扎。两组患者均指导功能锻炼,出院时嘱其定期复查。
1.3 观察指标 分别于术后1、3、6、12个月评估正中神经功能恢复情况。采用视觉模拟疼痛量表(Visual Analogue Scales,VAS)评价神经感觉恢复情况;以肌力6级分级法评价神经运动恢复情况;以感觉神经传导速度(sense nerve conduction velocity,SNCV)和运动神经传导速度(motor nerve conduction velocity,MNCV)作为肌电图评价指标。
1.4 统计学方法 应用 SPSS 18.0 统计学软件分析数据。计量资料比较采用重复测量方差分析。P<0.05为差异有统计学意义。
2 结 果
共有31例患者得到随访,对照组有4例患者失访,PRP注射组有5例患者失访,均随访12个月以上。2组术后1、3、6和12个月的VAS评分、肌力分级、正中神经SNCV和MNCV在组间、时点间、组间和时点间的交互作用差异均有统计学意义(P<0.01),见表1。术后12个月正中神经感觉和运动功能恢复与对照组差异无统计学意义(P>0.05),术后均无明显不良反应。
表1 两组患者术后VAS评分、肌力分级、SNCV 和 MNCV 的比较
Table 1 Comparison of postoperative VAS score,muscle strength classification,SNCV and MNCV between two groups ![]()
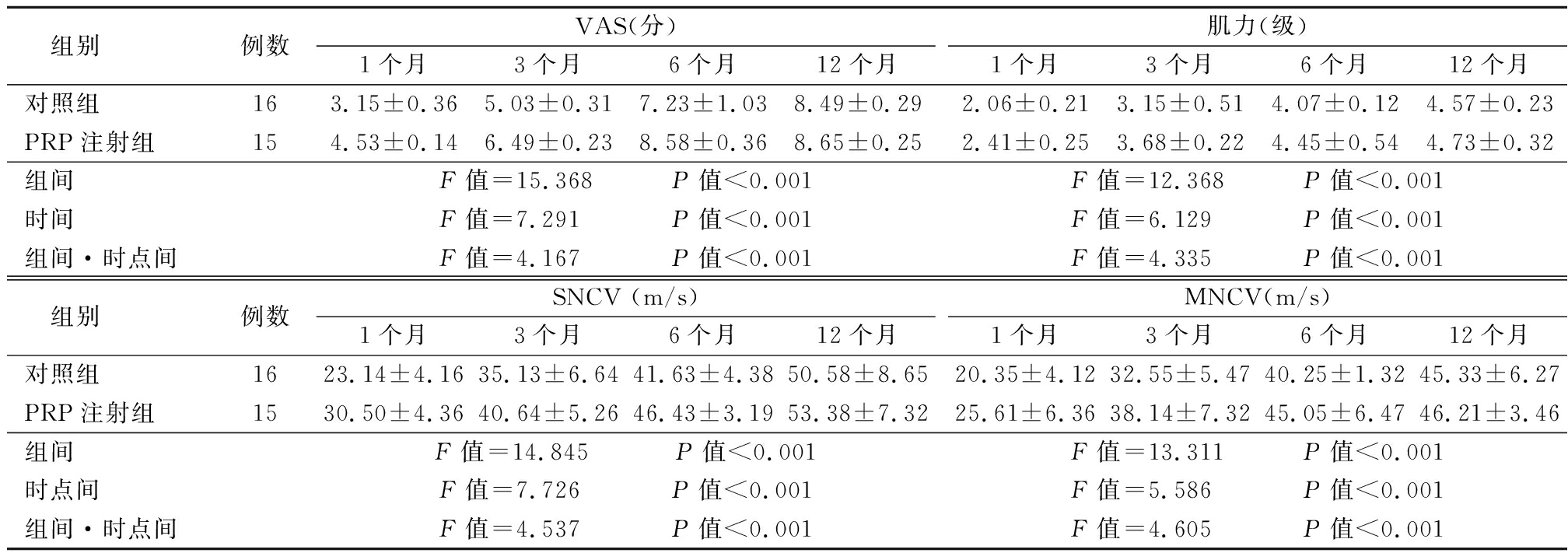
组别例数VAS(分)1个月3个月6个月12个月肌力(级)1个月3个月6个月12个月对照组163.15±0.365.03±0.317.23±1.038.49±0.292.06±0.213.15±0.514.07±0.124.57±0.23PRP注射组154.53±0.146.49±0.238.58±0.368.65±0.252.41±0.253.68±0.224.45±0.544.73±0.32组间F值=15.368 P值<0.001F值=12.368 P值<0.001时间F值=7.291 P值<0.001F值=6.129 P值<0.001组间·时点间F值=4.167 P值<0.001F值=4.335 P值<0.001 组别例数SNCV (m/s)1个月3个月6个月12个月MNCV(m/s)1个月3个月6个月12个月对照组1623.14±4.1635.13±6.6441.63±4.3850.58±8.6520.35±4.1232.55±5.4740.25±1.3245.33±6.27PRP注射组1530.50±4.3640.64±5.2646.43±3.1953.38±7.3225.61±6.3638.14±7.3245.05±6.4746.21±3.46组间 F值=14.845 P值<0.001F值=13.311 P值<0.001时点间 F值=7.726 P值<0.001F值=5.586 P值<0.001组间·时点间F值=4.537 P值<0.001F值=4.605 P值<0.001
3 讨 论
CTS是由多种原因导致的腕管内周径缩小,压迫正中神经,引起手指麻木或刺痛、发绀、手指活动不灵敏,甚至大小鱼际肌肉萎缩、患指溃疡等为表现的病症。CTS是骨科周围神经疾病的常见病、多发病,女性发病多于男性,目前治疗的方法为腕管减压及正中神经松解。然而,这些治疗方法无法重建合适的神经修复细胞和分子微环境,加之正中神经是运动和感觉的混合神经,神经再生缓慢、神经肌肉萎缩及运动终板退化变性等多种因素,均影响损伤神经的修复及靶器官的功能恢复,所以,神经损伤的功能恢复是不完全的[5-6]。
周围神经损伤后神经再生是一个非常复杂的过程,损伤局部的微环境发挥非常重要的作用,重建神经再生微环境将有利于保护受损神经元[7],促进轴突的生长和功能恢复[8]。已有大量实验表明,周围神经损伤早期在受损局部微环境中导入外源性生长因子有助于神经损伤再生修复,降低术后并发症的发生率[9-10]。
3.1 PRP与组织修复 有研究证实,PRP浓缩了血液中3~8倍的血小板,血小板的激活可释放血小板源性生长因子AA(platelet derived growth factor AA,AA)、血小板源性生长因子BB(platelet derived growth factor BB,BB)、血小板源性生长因子AB(platelet derived growth factor AB,AB)、血管内皮生长因子(vascular endothelial growth factor,VEGF)、表皮生长因子(epidermal growth factor,EGF)等多种血小板源性生长因子,以及转化生长因子β1、转化生长因子β2、胰岛素样生长因子、表皮生长因子和血管内皮生长因子等。这些生长因子比例接近人的生理状态,且在PRP中的浓度很高,促进组织细胞增殖、分化、趋化,促进创面愈合[11]。李洋等[12]将自体富血小板血浆应用于兔软组织缺损,证实可以促进游离皮瓣组织的微血管新生,从而加快游离皮瓣成活。一项针对猪自体移植皮片的研究表明,PRP可促进猪自体移植皮片生长[13]。该研究认为,PRP通过激活诱导VEGF的释放,实现小血管内皮细胞和基质细胞的转移,同时刺激血管平滑肌、血管内皮细胞等的分裂和增生,促进自体移植皮片的成活和生长。
3.2 神经修复中PRP的应用 在对神经的修复治疗中,血小板激活释放的相关因子参与早期炎症反应,促进组织修复;可能对施旺细胞起到调控作用,促进神经轴突的再生,从而实现神经结构和功能的恢复[14-16]。亦有实验表明富含血小板的纤维蛋白管可替代自体神经移植修复周围神经[17]。一项以兔坐骨神经断裂损伤修复为内容的研究发现,局部注射PRP可以增加微环境中VEGF、胰岛素样生长因子1(insulin-like growth factor 1,IGF-1)的含量,促进神经复合神经动作电位(compound nerve action potential,CNAP )的恢复及乙酰胆碱的合成和释放,有利于周围神经的再生及功能恢复[16]。在急性坐骨神经损伤动物模型中,实施神经缝合术的同时在吻合口应用PRP缝合薄膜,不仅可作为生物活性蛋白源,也引导神经生长抑制疤痕增生,显著改善神经再生进程[18]。研究表明PRP在对后路颈椎减压术后C5神经损伤的治疗中亦有明显效果[19]。本研究中,PRP注射组在术后6个月内正中神经感觉、肌力、感觉传导速度及运动传导速度恢复方面均优于对照组,进一步证实,PRP能有效促进损伤正中神经的功能恢复。其原因可能是自体PRP组织内含有多种生长因子,可调控受损正中神经周围的施旺细胞,促进轴突再生,实现正中神经的功能恢复。
有研究表明血小板及其多种生长因子在体内的平均寿命一般在5 d以内,加上凝血酶持续释放时间也仅7 d,因此对组织修复全过程可能需要多次使用PRP[20-23]。有动物实验研究也表明不同时间点多次应用PRP对兔坐骨神经损伤模型的恢复效果更明显[17]。本研究结果显示,术后12个月PRP注射组正中神经感觉和运动功能恢复与对照组无明显差异。可能与PRP中的生长因子消耗殆尽,作用减弱,期间需要反复注射有关,有待进一步研究证实。
应用PRP促进CTS松解术后正中神经的功能恢复有以下几点需要注意:①在显微镜下无创松解正中神经受压增厚的外膜,动作要轻柔,不可360 °完全去除神经外膜,以免神经缺血;②神经松解要充分,解除神经所有的卡压点,以免影响疗效或术后症状复发;③PRP注射时要充分包裹松解的神经节段,以实现充分接触和浸润,保证治疗效果;④不可在PRP凝固过早关闭伤口,以免PRP流失,造成有效剂量减少;⑤注意多次注射,保证治疗效果。本研究纳入患者较少,缺乏大样本试验,患者多样性差,均是研究存在的不足。后期应扩大样本,以及进行药物联合治疗等进一步研究。有研究认为,PRP对于轻度至中度CTS患者效果较好。
总之,PRP能促进CTS术后正中神功能的早期恢复,改善早期生活质量,后期可能需要反复注射。虽然其具体机制还有待研究,但这是一种可供选择的促进正中神经功能恢复的安全、有效的方法,有良好的临床应用前景。
[1] 石盼丽,苗勇,杜丽娟,等.富血小板血浆在美容医学领域的应用进展[J].中华整形外科杂志,2019,35(11):1156-1160.
[2] 董海鹏,高石军,窦砚,等.富血小板血浆对软骨修复的生物力学研究[J].河北医科大学学报,2014,35(6):635-638.
[3] 吴昭君,葛建华,季星利,等.自体富血小板血浆在周围神经损伤修复中的潜在价值[J].西南军医,2016,18(5):471-474.
[4] Kemmochi M,Sasaki S,Takahashi M,et al.The use of platelet-rich fibrin with platelet-rich plasma support meniscal repair surgery[J]. J Orthop,2018,15(2):711-720.
[5] S nchez M,Garate A,Delgado D,et al. Platelet-rich plasma,an adjuvant biological therapy to assist peripheral nerve repair[J]. Neural Regen Res, 2017,12(1):47-52.
nchez M,Garate A,Delgado D,et al. Platelet-rich plasma,an adjuvant biological therapy to assist peripheral nerve repair[J]. Neural Regen Res, 2017,12(1):47-52.
[6] 叶钢,李玉红.干细胞在周围神经再生中的应用研究进展[J].中华全科医学,2019,17(10):1736-1741,1772.
[7] 李牧,李东朋,宋迪,等.人脐带沃顿胶薄片对大鼠面神经损伤后髓鞘的修复作用[J].郑州大学学报(医学版),2019,54(3):367-372.
[8] Alsmadi NZ,Bendale GS,Kanneganti A,et al. Glial-derived growth factor and pleiotrophin synergistically promote axonal regeneration in critical nerve injuries[J]. Acta Biomater, 2018,78:165-177.
[9] Sarker MD,Naghieh S,McInnes AD,et al. Regeneration of peripheral nerves by nerve guidance conduits: Influence of design,biopolymers,cells,growth factors,and physical stimuli[J]. Prog Neurobiol,2018,171:125-150.
[10] Mirzakhani N,Farshid AA,Tamaddonfard E,et al. Carnosine improves functional recovery and structural regeneration after sciatic nerve crush injury in rats[J]. Life Sci,2018,215:22-30.
[11] Mahmoudian-Sani MR,Rafeei F,Amini R,et al. The effect of mesenchymal stem cells combined with platelet-rich plasma on skin wound healing[J]. J Cosmet Dermatol,2018,17(5):650-659.
[12] 李洋,郑健生,王彪.自体富血小板血浆对游离皮瓣修复兔软组织缺损的影响[J].中华烧伤杂志,2019,35(9):683-689.
[13] 郑健生,胡君玲,陈文.富血小板血浆对猪自体移植皮片成活和生长的影响[J].中华烧伤杂志,2016,32(2):112-116.
[14] 刘颜芬,张雪晶,段晓琴,等.富血小板血浆对周围神经损伤修复的研究现状[J].中国实验诊断学,2018,22(1):145-148.
[15] Giorgetti M,Siciliano G. Platelet-rich plasma: the role in neural repair[J]. Neural Regen Res,2015,10(12):1920-1921.
[16] Xia B,Lv Y. Dual-delivery of VEGF and NGF by emulsion electrospun nanofibrous scaffold for peripheral nerve regeneration[J]. Mater Sci Eng C Mater Biol Appl,2018,82:253-264.
[17] Roth F,Fernandes M,Valente SG,et al. Platelet-rich fibrin conduits as an alternative to nerve autografts for peripheral nerve repair[J]. J Reconstr Microsurg,2017,33(8):549-556.
[18] 张德绸,葛建华,吴昭君.自体富血小板血浆对周围神经损伤修复微环境影响的实验研究[J].四川医学,2018,39(8):846-850.
[19] Giannessi E,Coli A,Stornelli MR,et al. An autologously generated platelet-rich plasma suturable membrane may enhance peripheral nerve regeneration after neurorraphy in an acute injury model of sciatic nerve neurotmesis[J]. J Reconstr Microsurg,2014,30(9):617-626.
[20] 王兴平.富血小板血浆在后路颈椎减压后C5神经麻痹治疗中的价值[J].中国组织工程研究,2016,20(46):6930-6936.
[21] 季锋,许华.富血小板血浆用于软组织炎症及损伤治疗的研究进展[J].中国疼痛医学杂志,2017,23(2):135-138.
[22] 胡刚,魏思明.富血小板血浆(PRP)与脂肪移植的基础研究及临床应用进展[J].医学与哲学,2014,35(3):22-25,35.
[23] Hou X,Yuan J,Aisaiti A,et al. The effect of platelet-rich plasma on clinical outcomes of the surgical treatment of periodontal intrabony defects:a systematic review and meta-analysis[J]. BMC Oral Health,2016,16(1):71.