膀胱癌是临床泌尿系统最为常见的一种恶性肿瘤,浅表性膀胱癌发病率最高,约占80%[1],目前临床上多采用手术治疗,但开放手术存在较多缺点,如创伤大、恢复效果欠佳等。随着医疗科技迅速发展,临床主要采用微创手术治疗。经尿道钬激光膀胱肿瘤切除术(holmium laser resection of bladder tumors,HOLBT)不仅能有效避免膀胱功能受损,而且术后并发症少、创伤小、恢复快,逐渐受到广泛重视[2]。但是,部分患者术后会出现复发,严重影响治疗效果,甚至造成病情加重。研究表明术后给予膀胱药物灌注,可明显降低术后复发率[3]。吉西他滨是一种前体药物,为新一代胞嘧啶核苷衍生物,能破坏细胞复制,临床主要用于各种晚期癌症的治疗。秦文等[4]研究显示,经尿道等离子电切术联合膀胱灌注吉西他滨,可明显降低浅表性膀胱癌的术后复发率,疗效确切。近年来,研究发现通过检测某些尿液指标可以对膀胱癌患者术后复发情况进行筛查,其中核基质蛋白22(nuclear matrix protein 22,NMP22)最受关注[5]。宋广智等[6]研究发现,血清趋化因子配体5(chemokine ligand-5,CXCL5)对外科治疗膀胱癌复发有较理想的预测价值。本研究旨在探讨吉西他滨灌注联合HOLBT对浅表性膀胱癌患者血清CXCL5及尿NMP22水平的影响,为该疾病临床治疗提供参考。
1 资 料 与 方 法
1.1 一般资料 选取2012年6月—2014年6月在我院接受治疗的浅表性膀胱癌患者104例作为研究对象,根据随机数字表法分为对照组和观察组各52例。对照组男性29例,女性23例;年龄50~77岁,平均(64.8±4.6)岁;多发肿瘤17例,单发肿瘤35例;病理分期Ta 31例,T1 21例;肿瘤平均直径(3.2±0.9) cm;肿瘤分级G1 39例;G2 13例。观察组男性32例,女性20例;年龄51~79岁,平均(65.1±4.2)岁;多发肿瘤19例,单发肿瘤33例;病理分期Ta 34例,T1 18例;肿瘤平均直径(3.0±0.8) cm;肿瘤分级G1 37例;G2 15例。2组性别、年龄、肿瘤类型、病理分期、肿瘤大小、肿瘤分级差异无统计学意义(P>0.05),具有可比性。
本研究经医院伦理委员会批准通过,患者及家属均知情同意并签署知情同意书。
1.2 纳入标准和排除标准 纳入标准:①经病理检查确诊为浅表性膀胱癌;②由经验丰富的同一医师完成手术;③年龄>50岁;④治疗后随访3年未脱落。排除标准:①伴有精神状况障碍者;②其他类型肿瘤者;③意识及行为功能不全者;④对本研究所用药物过敏或禁忌者;⑤伴有凝血功能不全、心肾等重要器官功能障碍者。
1.3 治疗方法 对照组给予HOLBT治疗,采用截石位,进行硬膜外麻醉,操作镜经过尿道伸进膀胱内,持续灌注0.9%生理盐水,明确肿瘤部位;钬激光光纤通过膀胱镜操作孔置入膀胱,调整钬激光能量1.0~2.0 J,功率20~40 W,频率15~20 Hz;钬激光光纤在距离肿瘤基底1 cm左右时再行切割,采取推进式对肌肉层进行切割,并通过结合水流将肿瘤组织掀起;若肿瘤偏大、蒂过小,先将遮挡肿瘤基底部的瘤体进行处理,并及时吸出瘤体切除后的肿瘤组织,再将肿瘤基底部用激光进行切除,制止暴露出正常的肌纤维;如果肿瘤较多,手术难以操作,在瘤体切除后,可通过激光将肿瘤周围2 cm以内的正常组织黏膜汽化,再行操作;手术完成后需留置导尿管。
观察组在对照组基础上联合吉西他滨灌注治疗,首先将1.0 g吉西他滨与50 mL 0.9%生理盐水进行混合,完全溶解后通过导尿法将混合液灌注进入膀胱内,每15 min变换体位1次。必须确保吉西他滨混合液在体内保留时间超过1 h后自行排出体外,前2个月,患者需要每周进行1次膀胱灌注治疗,之后每月进行1次灌注治疗,共行10次治疗[7]。
1.4 观察指标 ①治疗后对所有患者进行为期3年的随访,记录2组术后1年和术后3年复发率,比较2组平均生存时间和首次复发时间。②分别于治疗前和治疗后2周抽取空腹外周静脉血10 mL,离心法采集上清液,离心温度4 ℃,离心速度2 000 g,离心时间20 min,采用酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)测量成纤维细胞生长因子(fibroblast growth factor,FGF)水平(包括αFGF和βFGF)和血管内皮生长因子(vascular endothelial growth factor,VEGF)水平。③剩余血清通过ELISA检测CXCL5水平,检测试剂盒购自R&D Systems公司,所有操作均有同一位资深医生完全根据说明书要求完成。④于治疗前和治疗后收集尿液,通过电化学发光法检测肿瘤标志物NMP22水平。
1.5 统计学方法 应用PEMS 3.2统计软件分析数据。计量资料比较采用独立样本的t检验和配对t检验,计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 2组预后情况比较 观察组术后1年和术后3年复发率低于对照组,平均复发时间和平均生存时间长于对照组,差异有统计学意义(P<0.05或P<0.01)。见表1。
表1 2组预后情况比较
Table 1 Comparison of clinical outcomes between two groups (n=52)
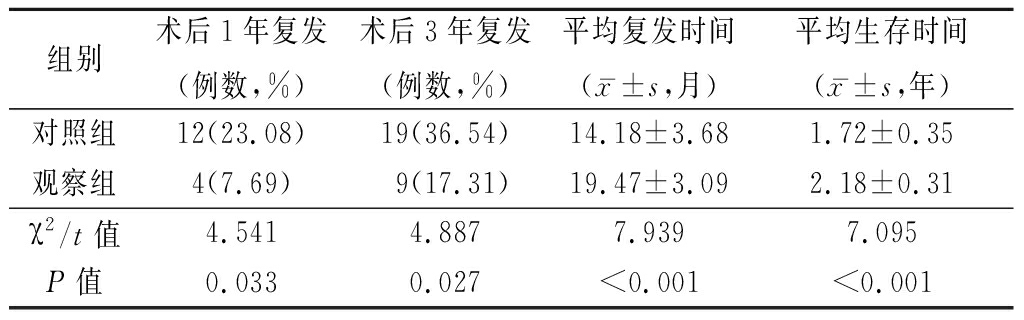
组别术后1年复发(例数,%)术后3年复发(例数,%)平均复发时间(x-±s,月)平均生存时间(x-±s,年)对照组12(23.08)19(36.54)14.18±3.681.72±0.35观察组4(7.69)9(17.31)19.47±3.092.18±0.31χ2/t值4.5414.8877.9397.095P值0.0330.027<0.001<0.001
2.2 2组治疗前后VEGF、αFGF和βFGF水平比较 治疗前,2组血清VEGF、αFGF和βFGF水平差异无统计学意义(P>0.05);治疗后,2组血清VEGF、αFGF和βFGF水平均低于治疗前,观察组血清VEGF、αFGF和βFGF水平均低于对照组,差异有统计学意义(P<0.01)。见表2。
表2 2组治疗前后血清VEGF、αFGF和βFGF水平比较
Table 2 Comparison of VEGF,αFGF and βFGF before and after treatment between two groups ![]()
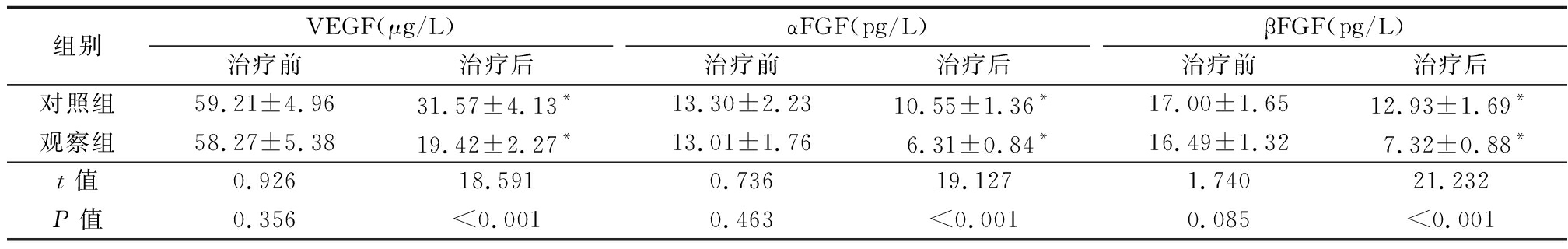
组别VEGF(μg/L)治疗前治疗后αFGF(pg/L)治疗前治疗后βFGF(pg/L)治疗前治疗后对照组59.21±4.9631.57±4.13*13.30±2.2310.55±1.36*17.00±1.6512.93±1.69*观察组58.27±5.3819.42±2.27*13.01±1.766.31±0.84*16.49±1.327.32±0.88*t值0.92618.5910.73619.1271.74021.232P值0.356<0.0010.463<0.0010.085<0.001
*P值<0.05与治疗前比较(配对t检验)
2.3 2组治疗前后血清CXCL5和尿NMP22水平比较 治疗前,2组血清CXCL5和尿NMP22水平差异无统计学意义(P>0.05);治疗后,2组血清CXCL5和尿NMP22水平低于治疗前,观察组血清CXCL5和尿NMP22水平低于对照组,差异有统计学意义(P<0.01)。见表3。
表3 2组治疗前后血清CXCL5和尿NMP22水平比较
Table 3 Comparison of CXCL5 and NMP22 levels in urine before and after treatment between two groups ![]()
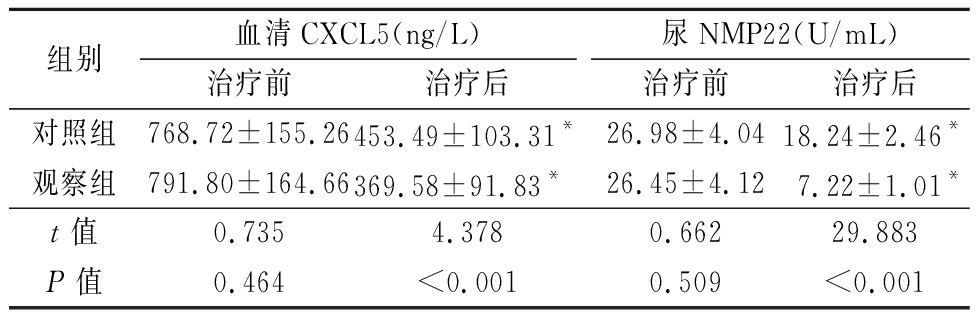
组别血清CXCL5(ng/L)治疗前治疗后尿NMP22(U/mL)治疗前治疗后对照组768.72±155.26453.49±103.31*26.98±4.0418.24±2.46*观察组791.80±164.66369.58±91.83*26.45±4.127.22±1.01*t值0.7354.3780.66229.883P值0.464<0.0010.509<0.001
*P值<0.05与治疗前比较(配对t检验)
3 讨 论
膀胱癌是泌尿系统发病率最高的恶性肿瘤,其中约有75%为浅表性膀胱癌,其诱因十分复杂,且中老年人群发病率最高[8]。随着医疗科技迅速发展,近年来微创技术越来越受到重视,HOLBT和经尿道膀胱肿瘤电切术(transurethral resection of baldder tumor,TURBT)逐渐广泛应用于临床,目前已成为浅表性膀胱癌常用的治疗方式。与TURBT相比,HOLBT特点主要包括:①钬激光能更精确地控制切割深度,可最大程度地切除残存肿瘤组织,避免二次电切对患者造成更大伤害;②自肿瘤基底部开始切割,能将肿瘤完整切除,基本不需要分多次切除,更彻底;③在手术切割过程中,膀胱组织深层淋巴管及毛细血管封闭,可大大降低癌细胞扩散率,在很多程度上减少肿瘤转移的可能,术后复发率较低[9]。许志斌等[10]研究发现,与TURBT相比,HOLBT用于浅表性膀胱癌的疗效更为显著,安全性更高,不仅对患者术后血清白细胞介素6、肿瘤坏死因子α等炎症因子水平影响较小,且术后复发率较低。
浅表性膀胱癌患者在接受HOLBT治疗后仍存在一定的复发率,如何有效避免术后病情复发,是目前临床的一个难点问题。在预防浅表性膀胱癌患者术后复发方案中,化疗药物膀胱灌注具有显著效果,通过将药物直接灌注于病灶位置,以发挥理想疗效。目前临床上膀胱灌注常用药物多采用吡柔比星,但是该药物对于大部分患者术后病情控制并不理想,容易复发,且不良反应发生率较高,这些都严重影响治疗效果。与吡柔比星不同的是,吉西他滨为前体药物,需要在人体细胞中磷酸化发挥治疗作用。吉西他滨膀胱灌注治疗浅表性膀胱癌能直接作用于肿瘤细胞DNA合成期,有效阻断癌细胞增殖,还能长时间滞留在癌细胞内,有效降低术后复发率[11]。因此本研究选择吉西他滨灌注联合HOLBT治疗。结果显示,观察组术后1年和术后3年复发率低于对照组,平均复发时间和术后生存时间长于对照组。
远处转移及无限增殖是膀胱癌最主要的生物学特征,恶性生物学特征主要依靠新生血管输送养分和氧气来完成。目前对血管新生功能有明确促进作用的细胞因子是VEGF,其作为肿瘤组织内部新生血管形成必不可少的物质,可通过结合细胞膜上VEGF受体激活AKT、EKR和磷脂酰肌醇-3激酶 (phosphatidylinositol 3-kinase,PI3K)等信号通路,促进血管新生[12]。FGF是一种多肽类物质,对成纤维细胞生长有显著促进作用,主要包括αFGF、βFGF两种亚型,通过促进体内血管内皮细胞增殖、游走促进肿瘤血管的形成[13]。因此,可通过监测肿瘤患者血清VEGF和FGF水平,判定治疗效果[14]。本研究结果显示,治疗前,2组血清VEGF、αFGF和βFGF水平差异无统计学意义(P>0.05);治疗后,2组血清VEGF、αFGF和βFGF水平均低于治疗前,观察组血清VEGF、αFGF和βFGF水平均低于对照组(P<0.05),说明浅表性膀胱癌患者接受吉西他滨灌注联合HOLBT治疗,可有效地遏制肿瘤组织内新生血管的形成,有效防止术后残存肿瘤细胞增殖,降低术后复发率。
炎症对于多种癌症的发生与发展有十分重要的影响,其中趋化因子是肿瘤组织内炎性细胞的重要介质,不仅能够诱导炎性细胞对肿瘤细胞浸润,而且可以促进癌细胞增殖和血管形成。研究证实,CXCL5在膀胱癌内呈现高表达,在临床上具有一定的研究价值[6]。CXCL5主要存在于成熟外周B细胞内,少量分布于T细胞亚型,其不仅能够诱导炎症发生,对粒细胞也具有一定趋化作用,促进血管形成,还可通过与G蛋白偶联受体结合,起到促进肿瘤发生发展的作用。NMP22在机体内主要参与构成核基质,并对DNA的双螺旋结构有很好的支撑作用,促进RNA合成及翻译,同时对DNA复制和转录也具有促进作用,可以调节多种基因表达过程[5]。正常生理状态下,NMP22在上皮细胞中的表达量非常低,但若细胞出现癌变,细胞增殖能力大大提升、分裂状态十分活跃,NMP22的表达量将显著升高。研究指出,NMP22在膀胱癌细胞内的表达量明显增加,且以可溶性多肽片段或复合物形式通过尿液排出体外,目前尿液NMP22水平已被国内外众多专家证实可作为尿路上皮肿瘤诊断的重要标志物[15]。梁安坡等[16]研究显示,浅表性膀胱癌患者尿NMP22水平显著高于健康者,且癌细胞分化程度越低尿NMP22含量越高,尿NMP 22水平升高与浅表性膀胱癌发生及术后复发密切相关。本研究结果显示,治疗后,2组血清CXCL5和尿NMP22水平均低于治疗前,观察组血清CXCL5和尿NMP22水平均低于对照组(P<0.05)。
综上所述,吉西他滨灌注联合HOLBT治疗浅表性膀胱癌,能够显著降低血清VEGF、αFGF、βFGF、CXCL5和尿NMP22水平,有效降低术后复发率,延长平均复发时间和生存时间,值得临床推广应用。但本研究还存在一些不足,未能充分考虑地区差异,未能对吉西他滨灌注联合HOLBT有效降低血清CXCL5和尿NMP22水平的机制进行深入探究,有待进一步扩大样本量并进行多中心临床研究。
[1] Martin-Doyle W,Kwiatkowski DJ. Molecular biology of bladder cancer[J]. Hematol Oncol Clin North Am,2015,29(2):191-203.
[2] D′souza N,Verma A. Holmium laser transurethral resection of bladder tumor:our experience[J]. Urol Ann,2016,8(4):439-443.
[3] 张小红,谭靖,姚鲲,等.抗肿瘤药物灌注预防表浅性膀胱癌术后复发的临床效果研究[J].中国医师杂志,2015,17(7):1043-1045.
[4] 秦文,彭光华,曾旻,等.二次电切加吉西他滨膀胱灌注治疗浅表性膀胱肿瘤[J].医学信息,2015,28(46):348.
[5] Wang Z,Que H,Suo C,et al. Evaluation of the NMP22 bladder chek test for detecting bladder cancer: a systematic review and meta-analysis[J]. Oncotarget,2017,8(59):100648-100656.
[6] 宋广智,袁海霞.血清趋化因子配体5预测膀胱癌外科治疗后复发的价值[J].实用临床医药杂志,2017,21(17):22-25.
[7] 钟隆飞,李巧星,王勇,等.吉西他滨与顺铂辅助化疗联合手术治疗浸润性膀胱癌的疗效分析[J].临床医药实践,2017,26(5):338-341.
[8] 马力,王朋新,武立伟,等.经尿道二次电切在非肌层浸润性膀胱肿瘤治疗中的应用评价[J].河北医科大学学报,2017,38(9):1079-1082.
[9] 王善龙,贺利明,张永升,等.经尿道钬激光切除术与等离子电切术治疗非肌层浸润性膀胱肿瘤的疗效及安全性对比[J].实用癌症杂志,2017,32(8):1345-1347.
[10] 许志斌,王江平,焦勇.经尿道钬激光切除与电切治疗浅表性膀胱癌的疗效对比[J].川北医学院学报,2017,32(4):567-569.
[11] Lai IL,Chou CC,Lai PT,et al. Targeting the warburg effect with a novel glucose transporter inhibitor to overcome gemcitabine resistance in pancreatic cancer cells[J]. Carcinogenesis,2014,35(10):2203-2213.
[12] 周浴,何敏,贾洪涛,等.不同膀胱灌注疗法预防浅表性膀胱癌术后复发及对血清VEGF影响的临床观察[J].中国现代医学杂志,2015,25(4):75-78.
[13] 韩兴涛,杨锦建,霍庆祥,等.电切术联合吡柔比星膀胱灌注对浅表性膀胱癌疗效[J].中国内镜杂志,2015,21(5):494-497.
[14] 王良义,林尤冠.腹腔镜肝癌切除术效果及其对患者血清VEGF、FGF水平和免疫功能的影响[J].山东医药,2017,57(34):33-35.
[15] Pichler R,Tulchiner G,Fritz J,et al. Urinary UBC rapid and NMP22 test for bladder cancer surveillance in comparison to urinary cytology: results from a prospective single-center study[J]. Int J Med Sci,2017,14(9):811-819.
[16] 梁安坡,张玉香,张金庄.尿NMP22及Cox-2蛋白含量检测对浅表性膀胱癌电切术后复发的预判价值研究[J].海南医学院学报,2015,21(12):1716-1719.