老年白内障又称为年龄相关性白内障,随年龄增长发生率增加,目前在我国人群基数庞大,可能与老年人群代谢率减慢等所致退行性变相关,部分患者可因晶状体浑浊而影响视力、严重影响老年群体的身心健康及生活质量[1-2]。细胞凋亡及氧化损伤是目前认可的老年白内障发病机制,明确与上述2点密切相关的分子可能在后续疾病分子靶向治疗方面具有重要意义。硫氧还蛋白2(Thioredoxin 2,Trx-2)是一种小分子蛋白质,仅存在于线粒体中,在抗氧化及调节线粒体凋亡中具有重要作用[3-4]。细胞研究发现,Trx-2在氧化损伤的人晶状体上皮细胞中表达异常,调节其表达可能是拮抗白内障过程中氧化应激诱导晶状体上皮细胞凋亡的重要手段之一[5]。但目前白内障组织在体试验关于Trx-2的研究不多,Trx-2在白内障患者病情进展过程中发挥的具体作用有待进一步核实。本研究检测老年白内障患者晶状体前囊膜中Trx-2的表达情况,分析其在疾病进展中发挥的作用,旨在进一步明确疾病机制,为后续靶向治疗等提供更多临床依据。
1 资 料 与 方 法
1.1 一般资料 选择2018年8月—2019年8月我院诊断为年龄相关性白内障并行超声乳化术吸出白内障的老年患者40例40眼为研究组,其中男性23例23眼,女性17例17眼,年龄62~79岁,平均(72.10±4.88)岁。纳入标准:①符合中华医学会眼科学分会白内障及人工晶状体学组制定的《中国多焦点人工晶状体临床应用专家共识(2019年)》[6]对年龄相关性白内障的诊断;②患者年龄≥60周岁;③心肝肾功能基本正常。排除标准:①合并可影响疾病治疗的其他疾病,如肿瘤、严重自身免疫性疾病、糖尿病等;②既往眼部手术史;③合并青光眼、眼外伤等其他眼部疾病。另取同期在我院因外伤行透明晶状体取出术的非白内障老年患者20例20眼为对照组,其中男性12例12眼,女性8例8眼,年龄60~77岁,平均(71.94±4.06)岁,均无眼科手术史、糖尿病史,重要脏器功能基本正常。2组性别、年龄差异无统计学意义(P>0.05),具有可比性。
本研究经医院伦理委员会审核通过,入组研究对象均由本人签署知情同意书。
1.2 标本处理 2组均行患侧眼表面麻醉及下行隧道切口,将黏弹剂注入前房后撕取直径约为5 mm的晶状体前囊膜标本,置入经焦碳酸二乙酯(diethyl pyrocarbonate,DEPC)处理的无菌冻干管中并保存于深低温冰箱(-80 ℃)中。
1.3 晶状体前囊膜标本中Trx-2的表达情况 使用免疫组织化学染色法测定晶状体前囊膜标本中Trx-2的表达情况,丙酮固定冰冻切片5 min;PBS洗涤3次后滴加一抗、4 ℃冰箱过夜;PBS洗涤3次后滴加二抗、室温条件下反应20 min;PBS洗涤3次后滴加三抗、室温条件下反应20 min;PBS洗涤3次后DAB显色(中位反应时间为4 min),经苏木精洗染后镜下观察并计算各组阳性细胞表达率。阳性标准为细胞质中出现棕褐色细微颗粒,每张切片随机选择5个400倍视野并计数50个细胞,统计阳性细胞数量,计算阳性百分率作为结果。具体分级,阳性细胞≤5%为阴性(-),阳性细胞≥6%为阳性(+)。
1.4 Western-blot测定晶状体前囊膜标本中凋亡相关分子的表达情况 取晶状体前囊膜组织标本,用蛋白裂解液提取组织中蛋白样本,用BCA试剂盒(购自北京普利莱基因技术有限公司)测定蛋白含量后取30 μg蛋白样本进行Western-blot检测,聚丙烯酰胺凝胶中加入蛋白样本后进行电泳、电转NC膜,NC膜在5%脱脂牛奶中室温封闭1 h,而后在P53、Bcl-2、ASK1的一抗中4 ℃孵育过夜;次日,NC膜放入P53、Bcl-2、ASK1二抗中、室温孵育2 h,使用美国BIO-RAD伯乐ChemiDoc XRS+凝胶成像仪显影得到蛋白条带,根据对应条带的灰度值计算相对表达水平。
1.5 晶状体前囊膜标本中氧化应激指标含量的检测 以常规消化法对标本进行消化、离心并去上清液,用超声波细胞粉碎机破碎细胞后,经5 000 r/min离心10 min,留取上清液后使用酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)试剂盒测定超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)活性及谷胱甘肽(glutathione,GSH)、丙二醛(malondialdehyde,MDA)含量。
1.6 统计学方法 应用SPSS 19.0统计软件分析数据。计量资料比较采用独立样本的t检验,计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 2组晶状体前囊膜标本中Trx-2的表达情况比较 对照组Trx-2表达阳性率为65.0%(13/20),研究组Trx-2表达阳性率为12.50%(5/40),研究组Trx-2表达阳性率显著低于对照组,差异有统计学意义(χ2=17.500,P<0.01)。见图1。
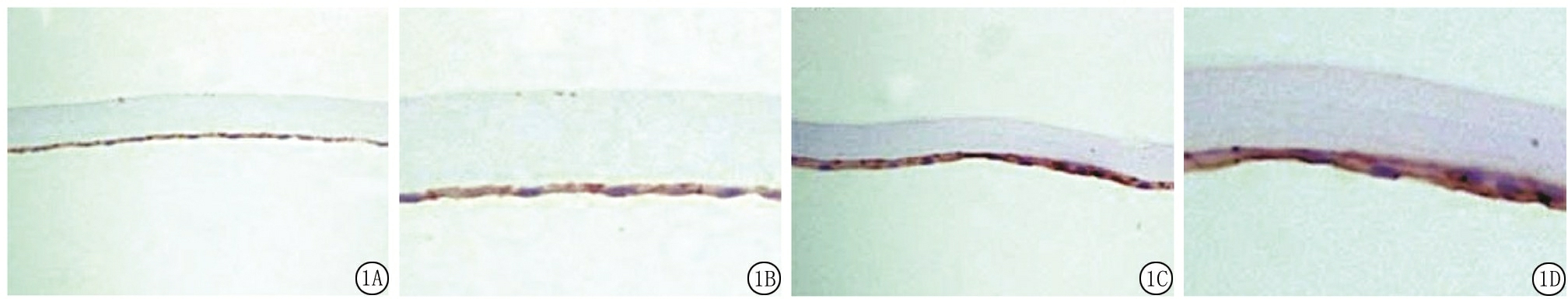
图1 晶状体前囊膜标本中Trx-2的表达情况
A.研究组晶状体前囊膜标本(免疫组织化学染色 ×200);B.研究组晶状体前囊膜标本(免疫组织化学染色 ×400);C.对照组晶状体前囊膜标本(免疫组织化学染色 ×200);D.对照组晶状体前囊膜标本(免疫组织化学染色 ×400)
Figure 1 Immunohistochemical staining of Trx-2 in anterior capsular lens of aged cataract
2.2 2组晶状体前囊膜标本中凋亡相关分子的表达情况比较 研究组晶状体前囊膜标本中P53、ASK1的蛋白表达量高于对照组,Bcl-2的蛋白表达量低于对照组,差异有统计学意义(P<0.01)。见图2,表1。

图2 晶状体前囊膜标本中凋亡相关分子的蛋白条带
Figure 2 Protein bands of apoptosis-related molecules in the anterior capsule specimens
表1 2组晶状体前囊膜标本中凋亡相关分子表达情况比较
Table 1 Comparison of apoptosis-related molecules expression in anterior capsule of the lens between two groups ![]()
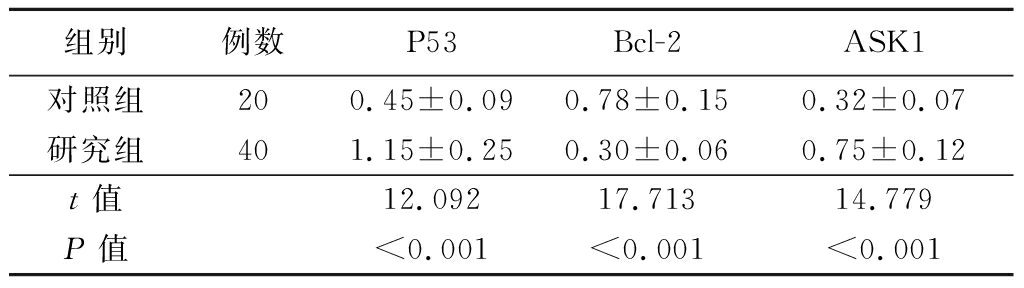
组别例数P53Bcl-2ASK1对照组200.45±0.090.78±0.150.32±0.07研究组401.15±0.250.30±0.060.75±0.12t值12.09217.71314.779P值<0.001<0.001<0.001
2.3 研究组不同Trx-2表达晶状体前囊膜标本中凋亡相关分子的表达情况比较 Trx-2(+)晶状体前囊膜标本中P53、ASK1的蛋白表达量低于Trx-2(-),Bcl-2的蛋白表达量高于Trx-2(-),差异有统计学意义(P<0.01)。见图3,表2。

图3 研究组不同Trx-2表达者凋亡相关分子的蛋白条带
Figure 3 Protein bands of apoptosis-related molecules in study group with different Trx-2 expression
表2 研究组不同Trx-2表达者凋亡相关分子表达情况比较
Table 2 Comparison of apoptosis-related molecules expression in study group with different trx-2 expression ![]()
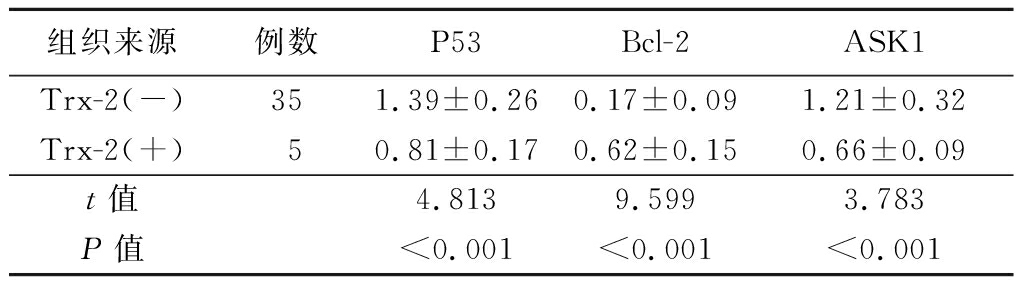
组织来源例数P53Bcl-2ASK1Trx-2(-)351.39±0.260.17±0.091.21±0.32Trx-2(+)50.81±0.170.62±0.150.66±0.09t值4.8139.5993.783P值<0.001<0.001<0.001
2.4 2组晶状体前囊膜标本中SOD、CAT活性及GSH、MDA含量比较 研究组标本上清液中SOD、CAT活性和GSH含量低于对照组,MDA含量高于对照组,差异有统计学意义(P<0.01)。见表3。
表3 2组晶状体前囊膜标本中SOD、CAT活性及GSH、MDA含量比较
Table 3 Comparison of SOD,CAT activity and GSH、MDA contents in anterior capsule of lens between two groups ![]()
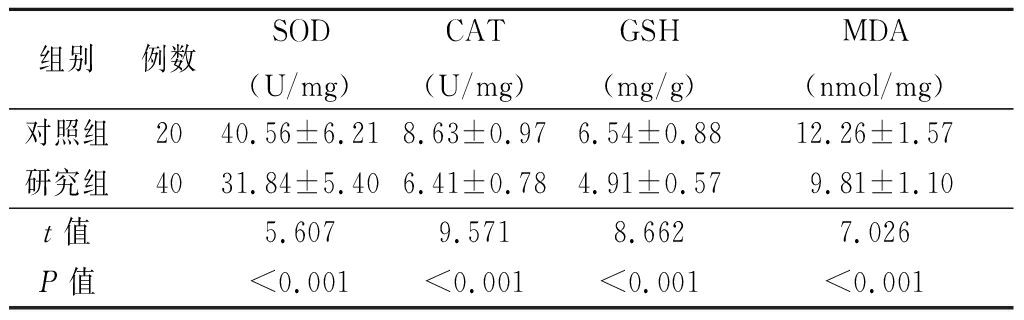
组别例数SOD(U/mg)CAT(U/mg)GSH(mg/g)MDA(nmol/mg)对照组2040.56±6.218.63±0.976.54±0.8812.26±1.57研究组4031.84±5.406.41±0.784.91±0.579.81±1.10t值5.6079.5718.6627.026P值<0.001<0.001<0.001<0.001
2.5 研究组不同Trx-2表达晶状体前囊膜标本中SOD、CAT活性及GSH、MDA含量比较 Trx-2(+)的标本上清液中SOD、CAT活性和GSH含量高于Trx-2(-),MDA含量低于Trx-2(-),差异有统计学意义(P<0.05或P<0.01)。见表4。
表4 研究组不同Trx-2表达者SOD、CAT活性及GSH、MDA含量比较
Table 4 Comparison of SOD,CAT GSH and MDA activity in study group with different Trx-2 expression ![]()
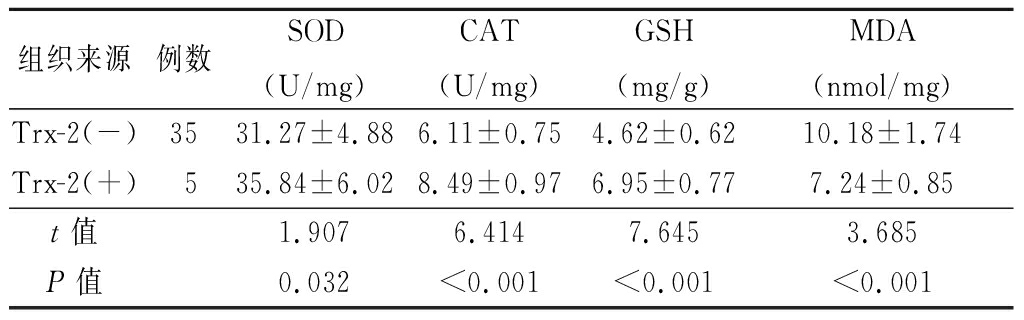
组织来源例数SOD(U/mg)CAT(U/mg)GSH(mg/g)MDA(nmol/mg)Trx-2(-)3531.27±4.886.11±0.754.62±0.6210.18±1.74Trx-2(+)535.84±6.028.49±0.976.95±0.777.24±0.85t值1.9076.4147.6453.685P值0.032<0.001<0.001<0.001
3 讨 论
老年白内障是临床首要致盲性眼病,由于手术费用、对手术的心理恐惧等因素,导致该病的临床就诊率不高,故揭示白内障发病机制、探索可能的非手术防治手段十分有必要。Trx-2是一种广泛存在于原核及真核生物中的小分子蛋白质,由4个β折叠和3个α螺旋组成,参与氧化还原反应中的活性位点Cys-Gly-Pro-Cys。Trx-2仅存在于线粒体中,在维持细胞内蛋白质还原状态、对抗细胞氧化应激等方面有重要作用,鉴于氧化应激反应在白内障发生发展中扮演的重要角色,推测Trx-2表达变化可能参与其中。白内障患者房水中Trx-2的浓度明显降低,且在白内障细胞模型中进一步明确其表达减少,提示Trx-2的表达改变可能是白内障发生发展的因素之一[7]。本研究结果显示,研究组标本中Trx-2表达阳性率低于对照组。因此进一步在老年白内障患者的晶状体前囊膜组织标本中探索Trx-2影响老年白内障病情的具体机制。
有研究对正常晶状体上皮细胞的凋亡情况进行检测并发现其几乎不见凋亡现象[8],而在白内障模型大鼠的晶状体上皮细胞中凋亡频发[9],推测晶状体上皮细胞凋亡是促进白内障形成的重要因素之一。Li等[10]研究指出,Trx-2可通过抑制H9c2心肌细胞的凋亡来保护缺血再灌注损伤。关于老年白内障患者晶状体前囊膜细胞的凋亡情况,通过检测凋亡分子P53、Bcl-2、ASK1蛋白表达的形式间接反映。P53是典型抑癌基因,可促进细胞凋亡;Bcl-2属于Bcl-2家族,在恶性肿瘤细胞中表达增加、具有抗凋亡作用;ASK1在细胞凋亡途径中发挥中间枢纽作用,可通过不同途径活化p38MAPKs并促进细胞凋亡[11-12]。本研究结果显示,研究组标本组织中P53、ASK1的蛋白表达量较高,Bcl-2的蛋白表达量较低,说明在老年白内障晶状体前囊膜中存在促凋亡基因的高表达及抗凋亡基因的低表达,提示凋亡旺盛现象存在。进一步根据Trx-2表达阳性情况进行分组并发现, Trx-2(-)表达的老年白内障患者晶状体前囊膜组织中以上凋亡相关分子的表达变化进一步加剧,推测Trx-2表达减少或缺失可能是导致晶状体前囊膜细胞凋亡旺盛的重要原因之一。车选义等[5]在其细胞研究中证实,过表达Trx-2可减少H2O2诱导的晶状体细胞凋亡,进一步从在体研究层面明确了Trx-2的抗凋亡作用,佐证了Trx-2表达改变在白内障病情进展过程中发挥的作用。
既往相关研究证实,各种因素刺激氧自由基过度产生是白内障发病的重要因素,氧化应激损伤持续加重并超过机体的抗氧化能力时,可引起严重氧化应激反应并导致细胞衰老、凋亡[13-14]。有研究指出白内障患者房水中H2O2含量明显增加,且H2O2可导致晶状体上皮凋亡、晶状体浑浊,故推测氧化应激是白内障发生的重要起始环节[15]。SOD、CAT、GSH、MDA均是与机体氧化应激状态、抗氧化能力密切相关的分子,其中SOD、CAT、GSH均具有抗氧化作用,MDA是典型的氧化代谢产物,当氧自由基大量产生并促使MDA合成增加时,可消耗SOD、CAT、GSH破坏机体氧化/抗氧化机制,引起全身氧化应激反应。本研究结果显示,研究组患者晶状体前囊膜组织上清液中SOD、CAT、GSH水平较低,MDA水平较高,提示老年白内障眼内局部存在明显氧化应激反应;且Trx-2(-)表达者以上氧化/抗氧化因子失衡更为严重,与Forred等[16]研究所述Trx-2可促进线粒体氧化剂的解毒和凋亡信号传导,以及Holzerova等[17]发现的Trx-2缺乏损害线粒体氧化还原稳态、导致早发性神经变性等结果吻合,提示Trx-2缺乏可能通过抗氧化应激作用减弱参与白内障患者晶状体前囊膜细胞凋亡及疾病进展。
综上所述,老年白内障患者晶状体前囊膜组织中Trx-2表达减少,使其抗凋亡及抗氧化应激作用减弱,可能是疾病发生发展的重要因素之一。但受限于入组病例数相对较少、可能使数据存在一定偏倚,有待大样本临床研究的进一步开展。关于Trx-2靶向干预对老年白内障患者具体病情的影响等有待临床实践深入探索。
[1] 毕艳,甘源,高岚,等.云南省某农村地区白内障患者手术利用影响因素病例对照[J].昆明医科大学学报,2019,40(1):34-39.
[2] 何晓静,刘红梅.老年糖尿病眼底病变患者白内障术后的黄斑囊样水肿及预后[J].中国老年学杂志,2019,39(7):1578-1580.
[3] Hu C,Zhang H,Qiao Z,et al. Loss of thioredoxin 2 alters mitochondrial respiratory function and induces cardiomyocyte hypertrophy[J]. Exp Cell Res,2018,372(1): 61-72.
[4] Kang JW,Choi HS,Lee SM. Resolvin D1 attenuates liver ischaemia/reperfusion injury through modulating thioredoxin 2-mediated mitochondrial quality control[J]. Br J Pharmacol,2018,175(12):2441-2453.
[5] 车选义,赵清侠,李迪.硫氧还蛋白-2在氧化损伤的人晶状体上皮细胞中的表达及其意义[J].中南大学学报(医学版),2018,43(3):253-259.
[6] 中华医学会眼科学分会白内障及人工晶状体学组.中国多焦点人工晶状体临床应用专家共识(2019年)[J].中华眼科杂志,2019,55(7):491-494.
[7] 姜凌峰,石栋,阎启昌.2型糖尿病合并皮质性白内障患者房水中Txnip、Trx的定量检测及相关性分析[J].眼科新进展,2017,37(8):736-738,742.
[8] 朱丽华,李佳,李兵.核因子E2相关因子2在晶状体上皮细胞抗氧化损伤中的作用[J].中国现代医学杂志,2019,29(11):25-30.
[9] 王真艳,陈为民.糖尿病性白内障晶状体上皮细胞凋亡及P53、Bcl-2的表达分析[J].现代医药卫生,2019,35(8):1140-1142.
[10] Li YY,Xiang Y,Zhang S,et al. Thioredoxin-2 protects against oxygen-glucose deprivation/reperfusion injury by inhibiting autophagy and apoptosis in H9c2 cardiomyocytes[J]. Am J Transl Res,2017,9(3):1471-1482.
[11] Xu W,Zhang L,Zhang Y,et al. TRAF1 exacerbates myocardial ischemia reperfusion injury via ASK1-JNK/p38 signaling[J]. J Am Heart Assoc,2019,8(21):e012575.
[12] Challa TD,Wueest S,Lucchini FC,et al. Liver ASK1 protects from non-alcoholic fatty liver disease and fibrosis[J]. EMBO Mol Med,2019,11(10):e10124.
[13] Labiris G,Panagiotopoulou EK,Ntonti P,et al. Corneal ectasia following cataract extraction surgery in a patient with keratoconus: a case report[J]. J Med Case Rep,2019,13(1):296.
[14] Soni P,Choudhary R,Bodakhe SH. Effects of a novel isoflavonoid from the stem bark of Alstonia scholaris against fructose-induced experimental cataract[J]. J Integr Med,2019,17(5):374-382.
[15] 张华,冯媛,席玉慧,等.葡萄籽原花青素调节MAPK对H2O2诱导的人晶状体上皮细胞的保护作用[J].哈尔滨医科大学学报,2018,52(6):521-524.
[16] Forred BJ,Daugaard DR,Titus BK,et al. detoxification of mitochondrial oxidants and apoptotic signaling are facilitated by thioredoxin-2 and peroxiredoxin-3 during hyperoxic injury[J]. PLoS One,2017,12(1):e0168777.
[17] Holzerova E,Danhauser K,Haack TB,et al. Human thioredoxin 2 deficiency impairs mitochondrial redox homeostasis and causes early-onset neurodegeneration[J]. Brain,2016,139(Pt 2):346-354.