痤疮是一种常见的慢性炎症性皮肤病,该病的病因与特定因素密切相关,包括角质化异常、细菌定植和炎症[1-2]。尽管痤疮的确切病理生理机制尚不清楚,但是众所周知,革兰阳性厌氧细菌丙酸杆菌在炎症的发生和发展中起着重要的作用[3-4]。研究发现,转化生长因子β(transforming growth factor-β,TGF-β)/Smad途径在炎症的发病机制中起到重要的作用[5-6]。蒲公英甾醇(taraxasterol)是一种从蒲公英中分离出来的五环三萜,具有抗炎作用[7-8]。本研究探讨蒲公英甾醇是否通过TGF-β/Smad信号通路对痤疮有改善作用,对炎症因子是否有调节作用,进一步探讨其作用机制,为临床上治疗治疗痤疮提供新的理论依据。
1 材 料 与 方 法
1.1 动物来源 60只SPF级C57BL/6小鼠,雄性,体重(20±2) g,购自中国医科大学动物实验中心。将实验小鼠饲养于动物房,温度为(23±2)℃,湿度为50%~60%,光照/黑暗周期为12 h。两周适应环境,正常饮水饮食。
1.2 药物和试剂 蒲公英甾醇(HPLC≥98%)购自上海源叶生物科技有限公司。苏木素-伊红(HE)试剂盒、3-二氨基联苯胺(diaminobezidin,DAB)显色盒和免疫组织化学试剂盒购自北京索莱宝生物科技有限公司。小鼠血清白细胞介素1β(interleukin-1β,IL-1β)试剂盒和小鼠血IL-8试剂盒购自南京凯基生物科技有限公司。放射免疫沉淀分析裂解液(radio immunoprecipitation assay lysis buffer,RIPA)、2,2-联喹啉-4,4-二甲酸二钠(butyleyanoacrylate,BCA)试剂盒购自美国Abcam公司。兔抗肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)抗体、兔抗转化生长因子β1(transforming growth factor-β1,TGF-β1)抗体、兔抗Smad3抗体、兔抗甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体和山羊抗兔IgG抗体购自美国Cell Signaling Technology公司。
1.3 方法
1.3.1 大鼠痤疮模型制备 C57BL/6小鼠经10%水合氯醛麻醉后,按照文献[9]复制小鼠耳廓痤疮模型,用PBS溶液配置浓度为 6×107 cfu/μL的丙酸杆菌菌液,并皮内注射到小鼠的左耳,若出现肉眼可见的耳部肿胀、发红和红斑即停止造模。
1.3.2 分组及给药 60只SPF级C57BL/6小鼠分为4组:对照组(A组)、模型组(B组)、蒲公英甾醇低剂量组(C组)和蒲公英甾醇高剂量组(D组),每组15只,除A组不造模,其余组都造模。A组小鼠耳廓皮内处注射等体积的生理盐水,B组、C组、D组按1.3.1进行相应剂量的耳廓皮内处注射。给药:模型成功后给药,给药方式为灌胃。A组:无菌生理盐水,20 mL/kg;B组:无菌生理盐水,20 mL/kg;C组:5 mg/kg蒲公英甾醇;D组:10 mg/kg蒲公英甾醇[10]。每天给药1次,连续21 d。
1.3.3 耳部观察 实验结束,对造模一侧小鼠的耳朵进行观察,并进行厚度测量。
1.3.4 HE 切取小块新鲜耳组织(胸腺组织),经固定、常规脱水、透明、浸蜡、石蜡包埋,并制成4 μm的石蜡切片。切片放入苏木素染液中5 min,自来水清洗后,置于1%的盐酸酒精分化数秒,并用流水冲洗。切片放入伊红染液中染色3 min,流水稍洗。之后切片置于梯度酒精(70%、80%、90%、100%)中脱水,各5 min,再放入二甲苯Ⅰ、Ⅱ中透明,分别5 min。将切片取出,用滤纸轻轻拭干切片上残余的二甲苯,在组织上滴加中性树胶封片,使用莱卡显微镜进行拍摄。
1.3.5 酶联免疫吸附剂测定(enzyme linked immunosorbent assay,ELISA) 实验结束后,各组小鼠经10%水合氯醛麻醉后,于心尖取血,并置于1.5 mL EP管中,3 000 r/min 离心15 min,吸取上层血清,按照ELISA试剂盒说明书进行操作,用酶联仪在450 nm波长依序测定各孔的光密度(补充英文全称,OD值),根据OD值所绘制的标准曲线查出血清中IL-1β、IL-8的表达。
1.3.6 免疫组织化学 切取小块新鲜耳组织,经固定、常规脱水、透明、浸蜡、石蜡包埋,并制成5 μm的石蜡切片。室温脱蜡、水化。切片在抗原修复液(96~98 ℃)中放置15 min。将切片放入新鲜配置3%的H2O2溶液中8 min,使内源性过氧化物灭活。接着滴加正常10%山羊血清封闭液,室温孵育20 min后,用滤纸吸取多余液体。滴加适量稀释的一抗,4 ℃孵育过夜。之后滴加相应的二抗,室温孵育2 h。取DAB显色试剂盒中的A、B、C试剂各1滴于切片上。室温显色后,于显微镜下观察,显色理想后将切片放置入纯净水中以终止显色。苏木素轻度复染胞核60 s,流水冲洗60 s,1%盐酸酒精分化3 s,流水冲洗2 min。梯度乙醇脱水,二甲苯透明,中性树胶封片,使用莱卡显微镜观察并采集图像。目标蛋白呈棕黄色,则为阳性表达。
1.3.7 Western blot 各组小鼠耳组织(100 mg)用RIPA裂解提取总蛋白,并经过BCA法进行蛋白质定量。将上清液与2×样品缓冲液混合,在95 ℃下煮沸5 min,用10% SDS-聚丙烯酰胺凝胶电泳分离,并转移到硝酸纤维素膜上。这些膜在室温下用5%脱脂奶封闭1 h,然后在4 ℃下与一抗孵育[兔抗 TGF-β1抗体(1∶2 000)、兔抗Smad3抗体(1∶2 000)和兔抗GAPDH抗体(1∶2 000)]过夜。用TBST洗涤3次后,将这些膜与二抗[山羊抗兔IgG抗体(1∶2 000)]在室温下孵育1 h,然后用TBST洗涤3次。最后显影曝光,用Image-Pro Plus图像分析系统对蛋白条带进行分析。
1.4 统计学方法 应用SPSS 19.0统计软件分析数据。计量资料比较采用单因素方差分析和LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 蒲公英甾醇对痤疮小鼠耳部变化的影响 从表型来看,对照组小鼠耳部皮肤,颜色粉红、质地柔软;模型组小鼠耳部肿胀、发红和红斑,质地干燥粗糙,可见脱屑及痂皮,说明造模成功;蒲公英甾醇低剂量组和蒲公英甾醇高剂量组小鼠耳部皮肤红斑减轻,质地有了很大改善,脱屑及痂皮也明显减少。见图1。
与对照组比较,模型组小鼠耳部厚度显著增厚(P<0.05);与模型组比较,蒲公英甾醇低剂量组和蒲公英甾醇高剂量组可明显降低小鼠耳朵厚度(P<0.05),且呈剂量依赖性。见表1。
表1 各组小鼠耳部厚度比较
Table 1 Mouse ear thickness in each group ![]()

组别 耳朵厚度对照组 2.011±0.053模型组 4.234±1.032*蒲公英甾醇低剂量组3.212±0.974#蒲公英甾醇高剂量组2.453±0.873△F值 54.342P值 <0.001
*P值<0.05与对照组比较 #P值<0.05与模型组比较 △P值<0.05与蒲公英甾醇低剂量组比较(LSD-t检验)
2.2 蒲公英甾醇对痤疮小鼠耳组织病理变化的影响 对照组大鼠耳组织中未见炎症细胞,表皮厚度未见增厚;模型组大鼠耳组织明显观察到炎症细胞和表皮增厚,在细菌注射部位可以发现许多浸润的炎症细胞;蒲公英甾醇经灌胃21 d后,炎症得到了有效缓解,并且浸润的炎症细胞数量明显减少,表皮增厚也减轻,其中蒲公英甾醇高剂量组效果更明显。见图2。
2.3 蒲公英甾醇对痤疮小鼠胸腺组织病理变化的影响 对照组小鼠胸腺小叶皮质,髓质边界清楚,皮质淋巴细胞正常;模型组小鼠胸腺小叶皮质,髓质边界清楚,皮质萎缩变薄,淋巴细胞明显减少;蒲公英甾醇低剂量组小鼠的皮质、胸腺小叶,边界清晰,皮质萎缩稀疏,淋巴细胞致密;蒲公英甾醇高剂量组小鼠,其皮质,胸腺髓小叶,边界清晰,皮质增厚,淋巴细胞致密。见图3。
与对照组相比,模型组胸腺皮质厚度和淋巴细胞数量显著减少(均P<0.001);与模型组相比,蒲公英甾醇低剂量组可增加小鼠痤疮模型胸腺皮质厚度和淋巴细胞数量(均P<0.05);蒲公英甾醇高剂量组明显增加了小鼠耳部痤疮模型的胸腺皮层厚度和淋巴细胞的数量(均P<0.05)。见表2。
表2 各组小鼠胸腺皮质厚度和胸腺中淋巴细胞数量比较
Table 2 The thickness of thymus cortex and the number of lymphocytes in the thymus of mice in each group ![]()
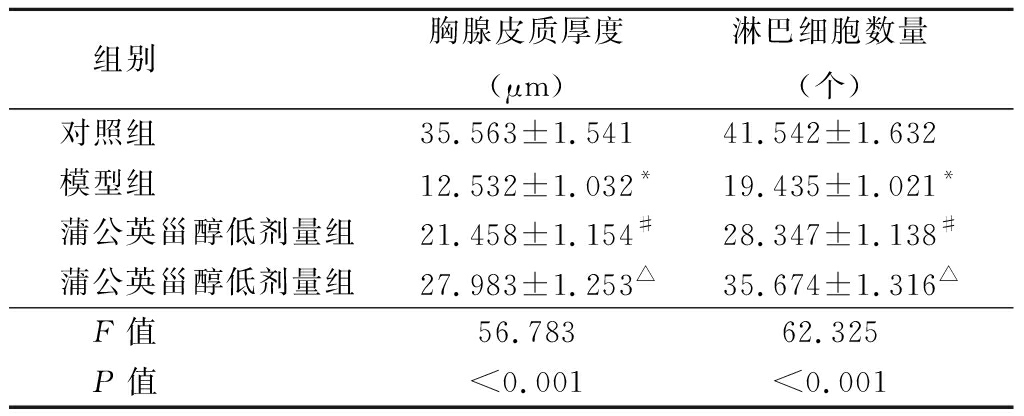
组别 胸腺皮质厚度(μm)淋巴细胞数量(个)对照组 35.563±1.54141.542±1.632模型组 12.532±1.032*19.435±1.021*蒲公英甾醇低剂量组21.458±1.154#28.347±1.138#蒲公英甾醇低剂量组27.983±1.253△35.674±1.316△F值 56.78362.325P值 <0.001<0.001
*P值<0.05与对照组比较 #P值<0.05与模型组比较 △P值<0.05与蒲公英甾醇低剂量组比较(LSD-t检验)
2.4 蒲公英甾醇对痤疮小鼠血清中IL-1β和IL-8表达水平的影响 与对照组相比,模型组小鼠血清中IL-1β和IL-8的表达水平显著上调(均P<0.05);与模型组相比,蒲公英甾醇低剂量组和蒲公英甾醇高剂量组小鼠血清中IL-1β和IL-8的表达水平下调(均P<0.05),其中蒲公英甾醇高剂量组作用更明显。见表3。
表3 各组小鼠血清中IL-1β和IL-8的表达水平比较
Table 3 Expression levels of IL-1β and IL-8 in the serum of mice in each group ![]()

组别 IL-1βIL-8对照组 9.342±1.23110.436±1.362模型组 26.784±2.563*31.753±2.356*蒲公英甾醇低剂量组18.126±2.032#23.672±1.574#蒲公英甾醇高剂量组13.853±1.074△16.532±1.020△F值 78.94364.983P值 <0.001<0.001
*P值<0.05与对照组比较 #P值<0.05与模型组比较 △P值<0.05与蒲公英甾醇低剂量组比较(LSD-t检验)
2.5 蒲公英甾醇对痤疮小鼠耳组织中TNF-α阳性细胞数量的影响 与对照组相比,模型组小鼠耳组织中TNF-α的阳性表达率显著增加(P<0.05);与模型组相比,蒲公英甾醇低剂量组和蒲公英甾醇高剂量组小鼠耳组织中TNF-α的阳性表达率减少(P<0.05),且呈剂量依赖性。见图4,表4。
表4 各组小鼠耳组织中TNF-α的阳性表达率
Table 4 Positive expression rate of TNF-α in mouse ear tissues of each group ![]()

组别 TNF-α阳性表达率对照组 4.562±0.963模型组 28.453±2.237*蒲公英甾醇低剂量组19.458±1.763#蒲公英甾醇高剂量组10.482±1.237△F值 89.348P值 <0.001
*P值<0.05与对照组比较 #P值<0.05与模型组比较 △P值<0.05与蒲公英甾醇低剂量组比较(LSD-t检验)
2.6 蒲公英甾醇对痤疮小鼠耳组织中TGF-β1、Smad3蛋白表达的影响 与对照组相比,模型组小鼠耳组织中TGF-β1、Smad3蛋白表达显著上调(P<0.05);与模型组相比,蒲公英甾醇低剂量组和蒲公英甾醇高剂量组小鼠耳组织中TGF-β1、Smad3蛋白表达下调(P<0.05),且呈剂量依赖性。见图5,表5。
表5 各组小鼠耳组织中TGF-β1、Smad3蛋白的表达
Table 5 TGF-β1,Smad3 protein expression in mouse ear tissues of each group ![]()
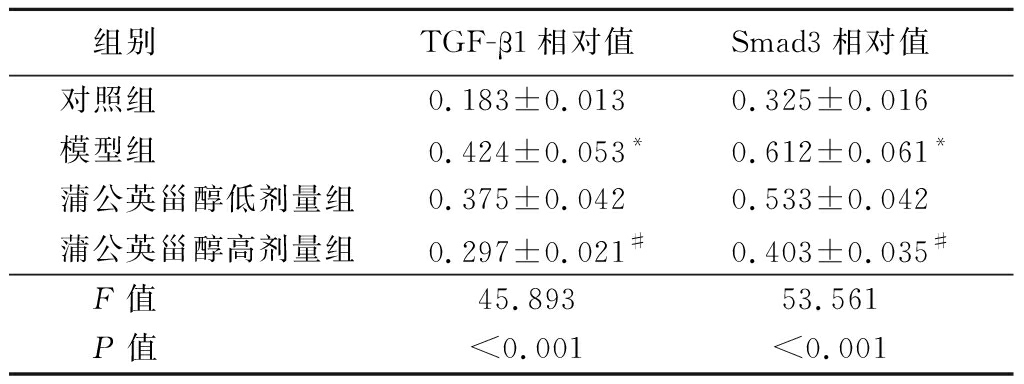
组别 TGF-β1相对值Smad3相对值对照组 0.183±0.0130.325±0.016模型组 0.424±0.053*0.612±0.061*蒲公英甾醇低剂量组0.375±0.0420.533±0.042蒲公英甾醇高剂量组0.297±0.021#0.403±0.035#F值 45.89353.561P值 <0.001<0.001
*P值<0.05与对照组比较 #P值<0.05与蒲公英甾醇低剂量组比较(LSD-t检验)
3 讨 论
痤疮通常发生在头和面部,也可能发生在胸部和颈部背面,可能会引起急性化脓性感染,很容易扩展到皮下组织,使皮肤受到不同程度的损害。根据相关统计,青春期痤疮的发病率高达82.7%,男性患病率高于女性[11]。目前治疗痤疮的方法之一是通过使用抗生素,但是这种方法可能会引起一定的治疗效果,抗生素药物的不良反应以及对肝脏和肾脏的强烈毒性[12]。本实验对小鼠耳部通过皮内注射丙酸杆菌菌液来复制痤疮模型,结果发现小鼠耳部出现肿胀、发红和红斑,即造模成功。
TNF-α主要由活化的单核/巨噬细胞产生,能杀伤和抑制肿瘤细胞,促进中性粒细胞吞噬,抗感染,引起发热,诱导肝细胞急性期蛋白合成,促进髓样白血病细胞向巨噬细胞分化,促进细胞增殖和分化,是重要的炎症因子,并参与某些自身免疫病的病理损伤。研究报道指出,痤疮丙酸杆菌可以刺激TNF-α的局部分泌,从而引起炎症发生[13]。随着对皮肤微生物组和共生细菌在驱动皮肤炎症中的作用的了解不断增强,痤疮丙酸杆菌通过非靶向靶向作用使TLR2激活[14],其在单核细胞上的激活释放促炎性细胞因子IL-6、IL-1β、IL-12和IL-8。 IL-8将中性粒细胞吸引到活动性病变部位,并触发中性粒细胞释放溶酶体酶,从而导致滤泡上皮破裂和进一步的炎症。为了进一步研究痤疮与免疫调节之间的关系,本研究观察了胸腺的局部组织病理学。结果表明,痤疮丙酸杆菌经小鼠耳部皮内注射后,小鼠血清中IL-1β、IL-8的表达水平上调,耳组织中TNF-α的阳性细胞数增加,胸腺皮质厚度和淋巴细胞数量减少。
总之,TGF-β/Smad在炎症中起重要作用,且TGF-β在细胞生长、分化、细胞外基质沉积和免疫反应中起关键作用[15],Smad3活性已被表明可以调节通过TGF-β/Smad途径引起炎症的发病机制[16]。本实验中,痤疮小鼠耳组织中TGF-β1和Smad3蛋白表达上调,与上述文献报道一致。
蒲公英是多年生草本植物,用于治疗急性结膜炎、皮肤溃疡和其他炎症[17]。蒲公英甾醇是一种从蒲公英中提取的活性化合物,其分子结构类似于类固醇激素,并已被证明在体内和体外均具有抗炎作用[8]。本研究显示蒲公英甾醇具有抗炎作用,与上述文献报道一致。痤疮小鼠耳部出现肿胀、发红和红斑情况减轻;血清中血清中IL-1β、IL-8的表达水平下调,耳组织中TNF-α的阳性细胞数减少,胸腺皮质厚度和淋巴细胞数量增加;TGF-β1和Smad3蛋白表达水平下调。
本研究结果显示,TGF-β/Smad途径与痤疮之间存在相关性。TGF-β/Smad通路在炎症中发挥至关重要的作用,蒲公英甾醇可抑制了TGF-β/Smad通路的激活并调节小鼠的血清中炎症因子的表达,从而改善痤疮的病情。(本文图见封三)
[1] Han R,Blencke HM,Cheng H,et al. The antimicrobial effect of CEN1HC-Br against Propionibacterium acnes and its therapeutic and anti-inflammatory effects on acne vulgaris[J]. Peptides,2018,99:36-43.
[2] 李東霖,吴文娟,邹丹丹,等.痤疮研究进展[J].昆明医科大学学报,2018,39(10):1-6.
[3] Omer H,McDowell A,Alexeyev OA. Understanding the role of Propionibacterium acnes in acne vulgaris: The critical importance of skin sampling methodologies[J]. Clin Dermatol,2017,35(2):118-129.
[4] Amano E,Uchida K,Ishihara T,et al. Propionibacterium acnes-associated chronic hypertrophic pachymeningitis followed by refractory otitis media: a case report[J]. BMC Neurol,2020,20(1):11.
[5] Gao M,Zheng J,Zheng C,et al. Theacrine alleviates chronic inflammation by enhancing TGF-β-mediated shifts via TGF-β/SMAD pathway in Freund’s incomplete adjuvant-induced rats[J]. Biochem Biophys Res Commun,2020,522(3):743-748.
[6] Ge Y,Cheng R,Sun S,et al. Fangxiao Formula alleviates airway inflammation and remodeling in rats with asthma via suppression of transforming growth factor-β/Smad3 signaling pathway[J]. Biomed Pharmacother,2019,119:109429.
[7] Xu L,Yu Y,Sang R,et al. Protective effects of taraxasterol against ethanol-induced liver injury by regulating CYP2E1/Nrf2/HO-1 and NF-κB signaling pathways in mice[J]. Oxid Med Cell Longev,2018,2018:8284107.
[8] Che L,Li Y,Song R,et al. Anti-inflammatory and anti-apoptosis activity of taraxasterol in ulcerative colitis in vitro and in vivo[J]. Exp Ther Med,2019,18(3):1745-1751.
[9] Hwang DH,Lee DY,Koh PO,et al. Rosa davurica Pall. improves propionibacterium acnes-induced inflammatory responses in mouse ear edema model and suppresses pro-inflammatory chemokine production via MAPK and NF-κB pathways in HaCaT cells[J]. Int J Mol Sci,2020,21(5):E1717.
[10] 刘馨宇.蒲公英甾醇对小鼠酒精性和免疫性肝损伤保护作用及机制研究[D].延安:延安大学,2018.
[11] Yin J,Hwang IH,Lee ME. Anti-acne vulgaris effect including skin barrier improvement and 5α-reductase inhibition by tellimagrandin I from Carpinus tschonoskii[J]. BMC Complement Alterm Med,2019,19(1):323.
[12] Dudareva M,Kümin M,Vach W,et al. Short or long antibiotic regimes in orthopaedics(SOLARIO): a randomised controlled open-label non-inferiority trial of duration of systemic antibiotics in adults with orthopaedic infection treated operatively with local antibiotic therapy[J]. Trials,2019,20(1):693.
[13] Saint-Georges V,Peternel S,Kašteln M,et al. Tumor necrosis factor antagonists in the treatment of pyoderma gangrenosum,acne,and suppurative hidradenitis(PASH) syndrome[J]. Acta Dermatovenrol Croat,2018,26(2):173-178.
[14] Jiao Y,Yuan Y,Lin Y,et al. Propionibacterium acnes induces discogenic low back pain via stimulating nucleus pulposus cells to secrete pro-algesic factor of IL-8/CINC-1 through TLR2-NF-κB p65 pathway[J]. J Mol Med(Berl),2019,97(1):25-35.
[15] Wang Q,Cai J,Fang C,et al. Mesenchymal glioblastoma constitutes a major ceRNA signature in the TGF-beta pathway[J]. Theranostics,2018,8(17):4733-4749.
[16] Ji X,Wang H,Wu Z,et al. Specific inhibitor of Smad3(SIS3) attenuates fibrosis,apoptosis,and inflammation in unilateral ureteral obstruction kidneys by inhibition of transforming growth factor β(TGF-β)/Smad3 signaling[J]. Med Sci Monit,2018,24:1633-1641.
[17] Che L,Li Y,Song R,et al. Anti inflammatory and anti apoptosis activity of taraxasterol in ulcerative colitis in vitro and in vivo[J]. Exp Ther Med,2019,18(3):1745-1751.