术后疼痛既给患者带来身心上的痛苦,亦对患者术后恢复造成极大的影响。患者静脉自控镇痛(patient-controlled intravenous analgesia,PCIA)是近年来临床常用于术后镇痛的一种方法,可取得良好的效果[1]。作为阿片受体激动剂之一,舒芬太尼具有镇痛、镇静及催眠的效果,且具有良好的安全性,是一种临床常用于术后镇痛的药物[2-3]。为此,本研究通过比较不同剂量舒芬太尼用于颌面部骨折内固定术后PCIA镇痛的镇静效果及安全性,从而为采用合适的镇痛剂量提供临床依据。
1 资 料 与 方 法
1.1 一般资料 选取2017年1月—2019年10月本院收治的73例择期全身麻醉行颌面部骨折内固定术的患者,给予不同剂量的舒芬太尼进行镇痛、镇静,随机分为A组(21例)、B组(27例)、C组(25例)。三组患者性别、年龄、体重指数(body mass index,BMI)、美国麻醉医师协会(American Society of Anesthesiologists,ASA)分级及手术时间的比较,差异均无统计学意义(P>0.05)。见表1。
表1 三组临床基线资料的比较
Table 1 Comparison of clinical baseline data of three groups
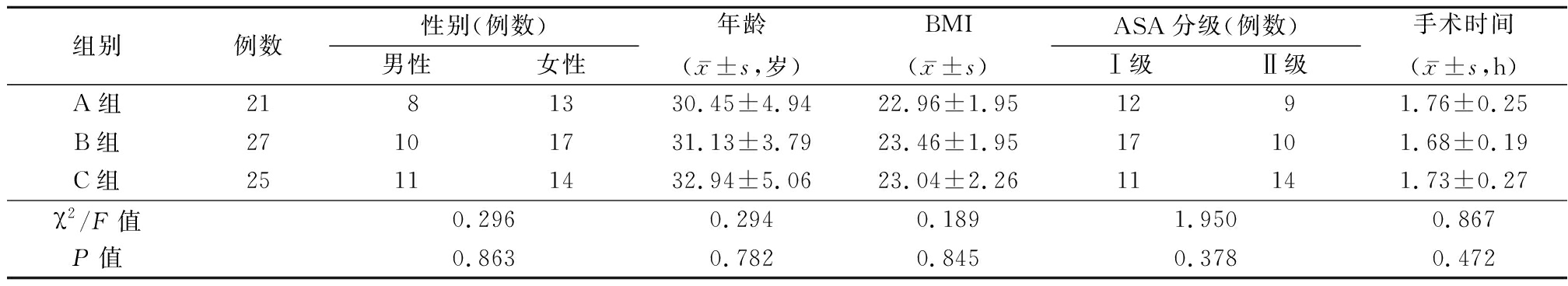
组别例数性别(例数)男性女性年龄(x-±s,岁)BMI(x-±s)ASA分级(例数)Ⅰ级Ⅱ级手术时间(x-±s,h)A组2181330.45±4.9422.96±1.951291.76±0.25B组27101731.13±3.7923.46±1.9517101.68±0.19C组25111432.94±5.0623.04±2.2611141.73±0.27χ2/F值0.2960.2940.1891.9500.867P值0.8630.7820.8450.3780.472
1.2 方法
1.2.1 麻醉方法 三组术前30 min均给予阿托品0.01 mg/kg肌肉注射,开放上肢静脉,接入多功能监护仪监测生命体征。麻醉诱导:给予舒芬太尼0.25 μg/kg、咪达唑仑0.06 mg/kg、苯磺酸顺阿曲库铵0.15 mg/kg、丙泊酚1.50 mg/kg进行静脉注射。麻醉维持:给予瑞芬太尼、丙泊酚进行持续静脉输注,同时持续静脉输注苯磺酸顺阿曲库铵维持肌肉松弛。
1.2.2 镇痛方法 三组均给予格拉司琼3 mg,A组给予舒芬太尼0.02 μg·kg-1·h-1、B组给予舒芬太尼0.04 μg·kg-1·h-1、C组给予舒芬太尼0.06 μg·kg-1·h-1,加入生理盐水制成药液100 mL装入电子镇痛泵中。术毕时,采用负荷剂量舒芬太尼0.20 μg/kg+格拉司琼3 mg行PCIA治疗,锁定0.50 mL/15 min。
1.3 观察指标 记录各时间点用药总量、视觉模拟评分[4](Visual Analogue Score,VAS)、视觉模拟疲劳评分[5](Visual Analogue Fatigue Score,VAFS)及White镇静评分[6],统计患者术后镇痛相关不良反应发生情况。
1.4 统计学方法 应用SPSS 23.0统计学软件处理数据。计量资料多组比较采用单因素方差分析,两两比较采用LSD-t检验,各时间点的比较采用重复测量数据的方差分析,计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 三组术后各时间点镇痛和镇静评分比较 B组和C组术后6 h、12 h、24 h、48 h时VAS和VAFS镇痛评分均明显低于A组(P<0.05);而B组与C组术后各时间点VAS和VAFS评分的比较差异无统计学意义(P>0.05);C组术后各时间点White镇静评分均明显高于A、B组(P<0.05);而A组与B组各时间点White评分的比较差异无统计学意义(P>0.05)。见表2。
表2 三组术后各时间点镇痛和镇静评分比较
Table 2 Comparison of analgesic and sedative scores of three groups at different time after operation ![]() 分)
分)
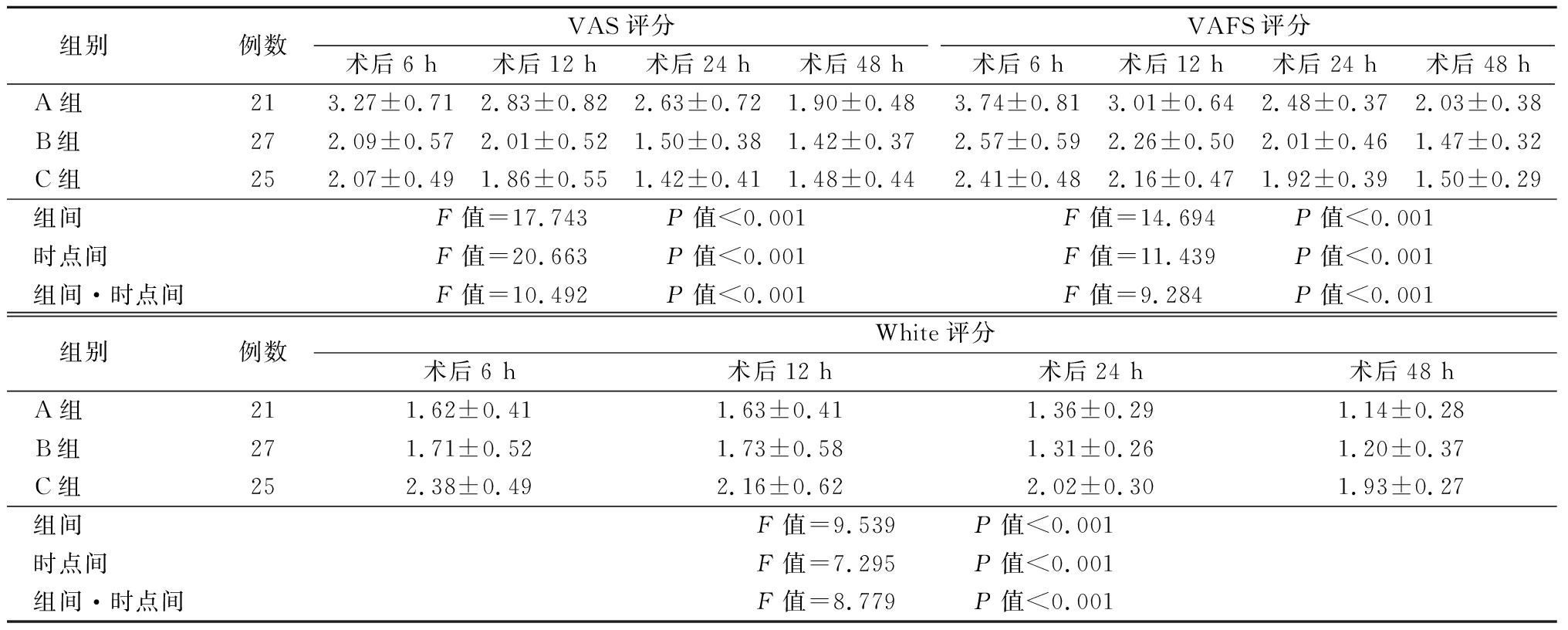
组别 例数VAS评分术后6 h术后12 h术后24 h术后48 hVAFS评分术后6 h术后12 h术后24 h术后48 hA组 213.27±0.712.83±0.822.63±0.721.90±0.483.74±0.813.01±0.642.48±0.372.03±0.38B组 272.09±0.572.01±0.521.50±0.381.42±0.372.57±0.592.26±0.502.01±0.461.47±0.32C组 252.07±0.491.86±0.551.42±0.411.48±0.442.41±0.482.16±0.471.92±0.391.50±0.29组间 F值=17.743 P值<0.001F值=14.694 P值<0.001时点间 F值=20.663 P值<0.001F值=11.439 P值<0.001组间·时点间F值=10.492 P值<0.001F值=9.284 P值<0.001组别 例数White评分术后6 h术后12 h术后24 h术后48 hA组 211.62±0.411.63±0.411.36±0.291.14±0.28B组 271.71±0.521.73±0.581.31±0.261.20±0.37C组 252.38±0.492.16±0.622.02±0.301.93±0.27组间 F值=9.539 P值<0.001时点间 F值=7.295 P值<0.001组间·时点间F值=8.779 P值<0.001
2.2 三组术后镇痛不良反应发生情况比较 A组与B组头晕、恶心及呕吐发生率明显低于C组(P<0.05);而A组与B组头晕、恶心及呕吐发生率的比较差异无统计学意义(P>0.05)。三组皮肤瘙痒、低血压及嗜睡发生率的比较差异无统计学意义(P>0.05)。见表3。
表3 三组术后镇痛不良反应发生情况比较
Table 3 Comparison of adverse reactions of postoperative analgesia in three groups (例数,%)
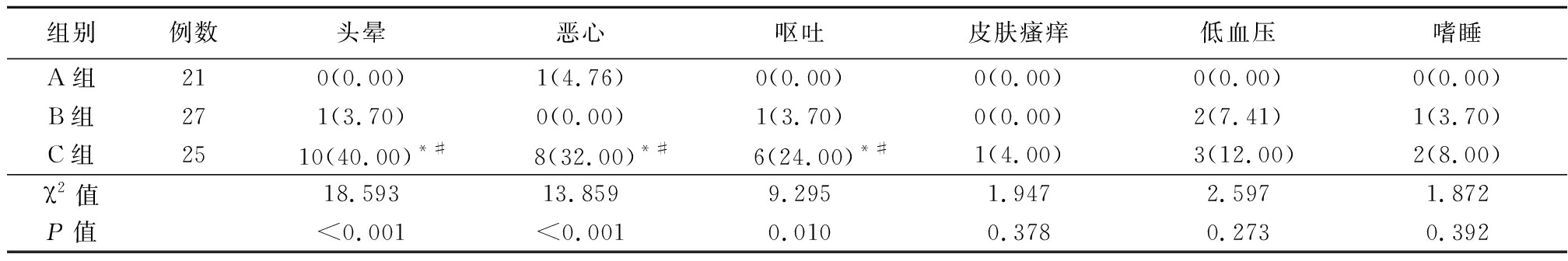
组别例数头晕恶心呕吐皮肤瘙痒低血压嗜睡A组210(0.00)1(4.76)0(0.00)0(0.00)0(0.00)0(0.00)B组271(3.70)0(0.00)1(3.70)0(0.00)2(7.41)1(3.70)C组25 10(40.00)*# 8(32.00)*# 6(24.00)*#1(4.00)3(12.00)2(8.00)χ2值18.59313.8599.2951.9472.5971.872P值<0.001<0.0010.0100.3780.2730.392
*P值<0.05与A组比较 #P值<0.05与B组比较(χ2检验)
3 讨 论
术后疼痛是机体受手术创伤而引起生理、心理和行为上的一系列应激反应,给患者身心造成双重伤害。术后镇痛不足则会使患者因疼痛而造成精神烦躁,重者会出现术后躁动,交感神经系统兴奋,进而造成呼吸急促、血压上升、心率加快,并进一步影响机体内消化系统和内分泌系统[7-8]。因颌面部骨折内固定术切口肿胀、疼痛,对患者吞咽功能和言语表达造成一定影响,加之口腔内分泌物的影响使患者疼痛加重,严重时可出现慢性缺氧,对生命安全造成极大的影响[9-10]。所以,颌面部骨折内固定术后使患者处在清醒镇静、镇痛状态,尽可能减轻手术创伤引起的一系列应激反应,以免恶心、呕吐等不良情况的发生,对降低术后感染发生率和促进切口愈合具有重要意义,同时良好的术后镇痛效果亦可体现出现代医疗技术的人道主义精神。
药物奏效迅速、镇痛作用无封顶效应、作用时间适中、安全性良好是PCIA所需的理想镇痛药物,而阿片类药物是目前临床常用的一类术后镇痛药,但其存在镇痛作用和不良反应均具有受体依赖性的特点[11-12],所以选择合适、有效、安全的用药剂量显得尤为重要。作为芬太尼的衍生物,舒芬太尼是一种人工合成的阿片类药物,亦是具有高选择性的μ受体激动剂,同时也是芬太尼家族中镇痛效果最佳的药物[13],其与μ1受体亲和力明显强于芬太尼,通过静脉给药可快速起效,安全阈较宽,明显高于吗啡和芬太尼,且具有稳定的血流动力学[14]。此外,舒芬太尼是芬太尼家族中镇痛作用最强的阿片类药物,具有较长的维持时间,其代谢产物去甲舒芬太尼与芬太尼相当,具有较强的镇痛效果、较长的镇痛时间、较好的可控性等优势[15-17],因此在围手术期镇痛方面的应用较广泛。同时,舒芬太尼与阿片受体结合具有特异性、可逆性及饱和性,具有较强的中枢抑制作用,可稳定血流动力学和心血管。此外,在安全剂量范围内,使用舒芬太尼并不会导致患者产生严重并发症(如呼吸抑制等),并且在临床使用过程中可依据患者耐受程度和敏感性适当调整药物用量,从而更好地获得显著的镇痛效果。
本研究结果发现,B组和C组术后6 h、12 h、24 h、48 h时VAS和VAFS镇痛评分均明显低于A组;C组术后各时间点White镇静评分均明显高于A、B组。此外,A组与B组头晕、恶心及呕吐发生率明显低于C组。术后恶心、呕吐是应用阿片类镇痛药物的常见不良反应[18],虽舒芬太尼具有较强的镇痛作用和较长的作用时间,在PCIA临床中的应用较广,但其可能会导致术后恶心、呕吐发生率提高[19-20]。所以,临床中可在镇痛泵中加入相应剂量的格拉司琼以免术后镇痛泵中持续泵入舒芬太尼所引起的恶心、呕吐等情况。本研究中,三组患者术后均未出现明显的呼吸抑制和循环抑制,提示舒芬太尼具有较轻的呼吸抑制和较强的镇痛效果,可用于颌面部骨折内固定术后PCIA。作为一种常用的阿片类镇痛药,虽舒芬太尼的不良反应发生率较低,但有研究指出舒芬太尼给药剂量过大可引起严重呼吸抑制[21]。而呼吸抑制是PCIA的主要危险因素,若未能及时发现并进行相应处理而可能会危及患者生命安全,所以临床中需重视术后监测,进行持续吸氧。本研究结果表明,A组镇痛作用相对较弱;B组用药总量较少,具有良好的镇痛、镇静效果,且头晕、恶心、呕吐等发生率较低;而C组存在较高的风险性,其术后不良反应发生率较高,结果提示高剂量的舒芬太尼0.06 μg·kg-1·h-1术后镇痛可能存在呼吸抑制的风险,随着药物浓度的提高,不良反应发生率可能会随之升高。有研究认为,虽舒芬太尼具有较强的镇痛效果和较长的药物作用时间,在PCIA临床应用中具有重要的作用,但可能会导致术后恶心、呕吐发生率升高,因此临床应用中在术后镇痛泵中可加入相应剂量的昂丹司琼以免持续泵入舒芬太尼而引起不良情况[22-25]。采取适宜、有效、安全的镇痛药剂量十分关键,而术后静脉持续输注舒芬太尼0.04 μg·kg-1·h-1在颌面部截骨整形术后PCIA中具有良好的镇痛和镇静效果,可明显减少给药次数和给药量,减轻患者术后疼痛程度,减少术后头晕、恶心、呕吐等不良反应的发生。
综上所述,静脉持续输注舒芬太尼0.04 μg·kg-1·h-1适宜用于颌面部骨折内固定术后PCIA,可获得良好的镇痛效果和较高的安全性。需要指出的是,虽舒芬太尼以免具有较高的安全性,但在临床应用中亦需引起重视,不宜过量使用舒芬太尼引起严重呼吸抑制,危及患者生命安全,需加强术后监测和持续吸氧。
[1] 杨静,张丽,刘丽,等.瑞芬太尼自控镇痛联合导乐仪用于产妇分娩镇痛的效果[J].中国临床研究,2017,30(11):1539-1541.
[2] 孙玉峰.不同剂量布托啡诺复合舒芬太尼用于腹腔镜子宫全切术后镇痛的临床研究[J].医学临床研究,2019,36(9):1796-1797.
[3] 郑均旗.罗哌卡因复合硬膜外不同剂量舒芬太尼对剖宫产产妇血流动力学及麻醉效果的影响[J].河北医学,2019,25(4):610-614.
[4] Coats E,Carden H,Zujovic L,et al. Qualifying the difficulty of embryo transfer with a visual analogue scale and assessing its impact on IVF outcomes[J]. Hum Fertil(Camb),2019,22(3): 177-181.
[5] Kos D,Raeymaekers J,Van Remoortel A,et al. Electronic visual analogue scales for pain,fatigue,anxiety and quality of life in people with multiple sclerosis using smartphone and tablet: a reliability and feasibility study[J]. Clin Rehabil,2017,31(9):1215-1225.
[6] Yao Y,Su Z,Chen Y,et al. Safety and efficacy of sufentanil combined with midazolam in bronchoscopy under conscious sedation: retrospective study of 11,158 cases[J]. J Thorac Dis,2019,11(10):4127-4134.
[7] An Y,Zhao L,Wang T,et al. Preemptive oxycodone is superior to equal dose of sufentanil to reduce visceral pain and inflammatory markers after surgery: a randomized controlled trail[J]. BMC Anesthesiol,2019,19(1):96.
[8] Hahn J,Yang S,Min KL,et al. Population pharmacokinetics of intravenous sufentanil in critically ill patients supported with extracorporeal membrane oxygenation therapy[J]. Crit Care,2019,23(1):248.
[9] Menon S,Sham ME,Kumar V,et al. Maxillofacial fracture patterns in road traffic accidents[J]. Ann Maxillofac Surg,2019,9(2):345-348.
[10] Luciana L,Oggy BAR,Wiargitha IK,et al. Management of maxillofacial fracture:experience of emergency and trauma acute care surgery department of sanglah general hospital denpasar bali[J]. Open Access Maced J Med Sci,2019,7(19):3245-3248.
[11] Peng K,Zhang J,Meng XW,et al. Optimization of postoperative intravenous patient-controlled analgesia with opioid-dexmedetomidine combinations:an updated meta-analysis with trial sequential analysis of randomized controlled trials[J]. Pain Physician,2017,20(7): 569-596.
[12] Abrolat M,Eberhart LHJ,Kalmus G,et al. Patient-controlled analgesia(PCA): an overview about methods,handling and new modalities[J]. Anasthesiol Intensivmed Notfallmed Schmerzther,2018,53(4):270-280.
[13] Katz P,Takyar S,Palmer P,et al. Sublingual,transdermal and intravenous patient-controlled analgesia for acute post-operative pain:systematic literature review and mixed treatment comparison[J]. Curr Med Res Opin,2017,33(5):899-910.
[14] Blancher M,Maignan M,Clapé C,et al. Intranasal sufentanil versus intravenous morphine for acute severe trauma pain:a double-blind randomized non-inferiority study[J]. PLoS Med,2019,16(7):e1002849.
[15] 陈学强,黄春贵,余丽鲜,等.帕瑞昔布钠-舒芬太尼患者皮下自控镇痛对脊柱手术患者术后谵妄的影响[J].昆明医科大学学报,2018,39(1):92-95.
[16] Väänänen A,Kuukasjärvi M,Tekay A,et al. Spinal and epidural sufentanil and fentanyl in early labour[J]. Acta Anaesthesiol Scand,2019,63(10):1413-1418.
[17] Yin S,Hong J,Sha T,et al. Efficacy and tolerability of sufentanil,dexmedetomidine,or ketamine added to propofol-based sedation for gastrointestinal endoscopy in elderly patients:a prospective,randomized,controlled trial[J]. Clin Ther,2019,41(9):1864-1877.
[18] De Boer HD,Detriche O,Forget P. Opioid-related side effects:postoperative ileus,urinary retention,nausea and vomiting,and shivering. A review of the literature[J]. Best Pract Res Clin Anaesthesiol,2017,31(4):499-504.
[19] Porela-Tiihonen S,Kokki M,Kokki H. Sufentanil sublingual formulation for the treatment of acute,moderate to severe postoperative pain in adult patients[J]. Expert Rev Neurother,2017,17(2):101-111.
[20] Han L,Su Y,Xiong H,et al. Oxycodone versus sufentanil in adult patient-controlled intravenous analgesia after abdominal surgery:a prospective,randomized,double-blinded,multiple-center clinical trial[J]. Medicine(Baltimore),2018,97(31):e11552.
[21] Strang J,Knight A,Baillie S,et al. Norbuprenorphine and respiratory depression:exploratory analyses with new lyophilized buprenorphine and sublingual buprenorphine[J]. Int J Clin Pharmacol Ther,2018,56(2):81-85.
[22] Oh SK,Lee IO,Lim BG,et al. Comparison of the analgesic effect of sufentanil versus fentanyl in intravenous patient-controlled analgesia after total laparoscopic hysterectomy: A randomized,double-blind,prospective study[J]. Int J Med Sci,2019,16(11):1439-1446.
[23] Feng M,Chen X,Liu T,et al. Dexmedetomidine and sufentanil combination versus sufentanil alone for postoperative intravenous patient-controlled analgesia: a systematic review and meta-analysis of randomized controlled trials[J]. BMC Anesthesiol,2019,19(1): 81.
[24] Lim L,Jang YE,Kim EH,et al. Comparison of the effects of sufentanil and fentanyl in intravenous patient-controlled analgesia after pediatric moyamoya surgery:a retrospective study[J]. Pediatr Neurosurg,2020,55(1):36-41.
[25] Lee HM,Kil HK,Koo BN,et al. Comparison of sufentanil-and fentanyl-based intravenous patient-controlled analgesia on postoperative nausea and vomiting after laparoscopic nephrectomy:a prospective,double-blind,randomized-controlled trial[J]. Int J Med Sci,2020,17(2):207-213.