肺炎支原体(mycoplasma pneumonia,MP)是引发人类支原体肺炎的一种病原体。主要经飞沫传播,学龄期儿童发病率最高[1]。一年四季均可发病,高发期为秋冬季节[2]。MP感染人体后经过2~3周的潜伏期,可出现发热、头痛、咽痛、阵发性刺激性干咳等轻度呼吸道症状,部分患者也可无症状。支原体肺炎的病理改变主要表现为间质性肺炎,可并发支气管肺炎,称为原发性非典型性肺炎。除呼吸系统表现外,支原体肺炎可并发多系统、多器官损害[3-4]。一直受到国内外学者们的广泛关注。支原体肺炎的临床表现和胸部X线检查的非特异性,使得临床医师无法及时准确地作出诊断。病原体检测为疾病的明确诊断和合理治疗提供了及时有效的依据。目前,国内MP检测的方法很多,但缺乏既快速又简便准确的方法,且标本类型也影响病原体检出率。为此,本研究采用实时荧光聚合酶链反应(polymerase chain reaction,PCR)和MP快速培养2种检测方法,对患儿痰和咽拭子标本进行检测并比较结果,旨在为病原体的检出和临床及时合理诊疗提供实验依据。报告如下。
1 资 料 与 方 法
1.1 一般资料 收集2017年10月1日—2018年1月30日在河北省唐山市妇幼保健院收治的拟诊为MP感染患儿622例,男性325例,女性297例,年龄2个月~14岁,平均(8.90±2.66)岁。临床表现为发热、头痛、咽痛、咳嗽少痰等。
本研究经医院伦理委员会批准。所有患儿家属知情同意并签署知情同意书。
1.2 标本采集 标本均在患儿入院后次日清晨采集。
1.2.1 咽拭子标本 用咽拭子适度用力拭抹咽后壁和两侧扁桃体部位,将拭子放入样本采集管(含1 mL生理盐水)中,密封用于PCR检测;同样方法采集另一份咽拭子标本置于无菌样本管中,密封立即送检用于MP快速培养。
1.2.2 痰标本 用一次性吸痰管经由患儿鼻腔5~8 cm,无菌吸取痰液2 mL于2个无菌样本管中,密封待检。
1.2.3 静脉血标本 分别于患儿入院24 h内和入院5~10 d后采集清晨空腹静脉血3 mL,离心分离血清,待检。
1.3 实验方法 其中1份咽拭子和痰标本均用于MP快速培养,MP快速培养基由郑州安图生物工程股份有限公司提供。另一份1份咽拭子和痰标本采用实时荧光PCR法进行MP DNA检测。试剂盒(荧光PCR法)由上海之江生物科技股份有限公司提供。仪器为美国伯乐CFX96实时荧光定量PCR仪。扩增条件设置为:37 ℃ 2 min,1个循环,94 ℃,2 min,1个循环,93 ℃ 15 s,60 ℃ 60 s,40个循环;荧光通道检测: FAM VIC Cal Red 610通道。血标本采用被动凝集法检测MP抗体IgM,试剂盒由日本富士瑞必欧株式会社提供。所有操作均按说明书严格进行。
1.4 结果判定标准
1.4.1 MP快速培养判定标准 培养瓶内培养基颜色由红色变为黄色且清亮为阳性,不变色为MP培养阴性。
1.4.2 MP-IgM抗体检测判定标准 效价≥1∶80为MP阳性。
1.4.3 实时荧光PCR 实验610通道Ct值≤38(且有明显S型扩增曲线)为阳性,否则为阴性。
1.5 诊断标准 以双份血清抗体效价呈4倍以上增长作为MP感染确诊的金标准,并结合临床症状、胸部X线片及其他实验室指标。MP诊断标准参照诸福棠《实用儿科学》(第7版)进行确诊。痰或咽拭子实时荧光PCR或MP快速培养检测有一项阳性即为MP阳性。
1.6 观察指标 比较实时荧光PCR、MP快速培养检测痰和咽拭子标本的MP阳性率。
1.7 统计学方法 应用SPSS 17.0统计学软件分析数据。计数资料比较采用χ2检验。采用受试者工作特征(receiver operating characteristic,ROC)曲线下面积计算检测方法的预测价值。P<0.05为差异有统计学意义。
2 结 果
2.1 MP-IgM凝集法检测血清中MP结果 MP-IgM凝集法(初次)检测阳性208例(33.44%),5~7 d后再次检测最终确定MP感染615例 (98.88%),其中男性321例,女性294例,平均年龄(8.89±2.65)岁。
2.2 2种方法检测MP比较 实时荧光PCR法检测痰标本中MP阳性592例(95.18%),咽拭子标本中MP阳性387例(62.22%),实时荧光PCR法检测痰标本中MP阳性率高于咽拭子标本,差异有统计学意义(χ2=201.511,P<0.01)。MP快速培养法检测痰标本中MP阳性328例(52.73%),咽拭子标本中MP阳性128例(20.58%),MP快速培养法检测痰标本中MP阳性率高于咽拭子标本,差异有统计学意义(χ2=138.480,P<0.01)。痰和咽拭子标本中实时荧光PCR法检测MP阳性率高于MP快速培养法,差异有统计学意义(χ2=290.868,222.272,P<0.01)。见表1。
表1 2种方法检测痰和咽拭子标本中MP比较 (n=622,例数)
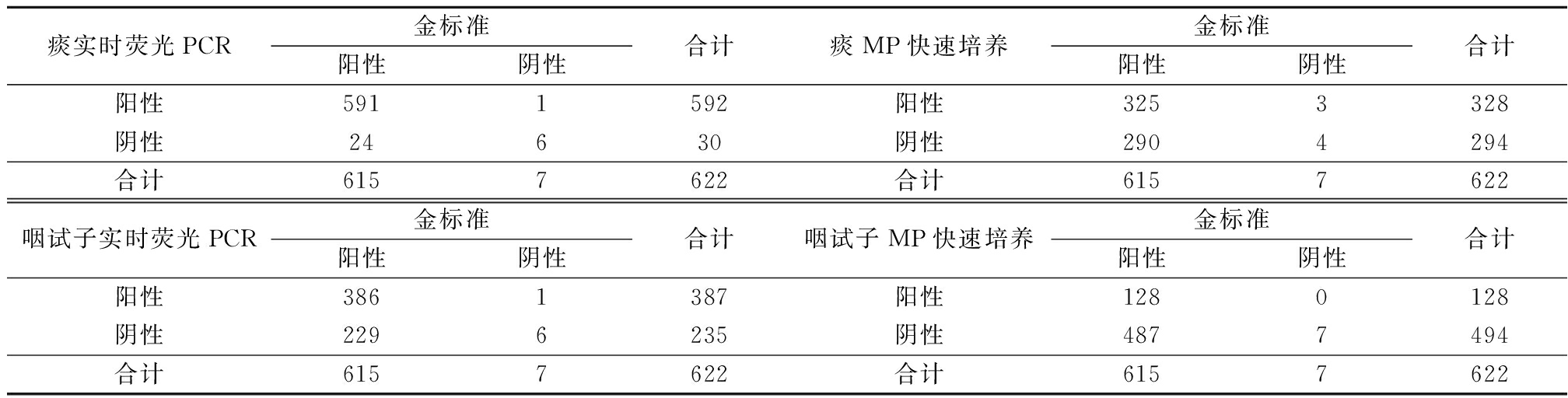
痰实时荧光PCR金标准阳性阴性合计痰MP快速培养金标准阳性阴性合计阳性5911592阳性3253328阴性24630阴性2904294合计6157622合计6157622咽试子实时荧光PCR金标准阳性阴性合计咽试子MP快速培养金标准阳性阴性合计阳性3861387阳性1280128阴性2296235阴性4877494合计6157622合计6157622
2.3 ROC曲线分析 绘制ROC曲线,比较2种方法对痰和咽拭子标本的预测价值,痰实时荧光PCR、咽拭子实时荧光PCR、痰MP快速培养、咽拭子MP快速培养的ROC曲线下面积分别为0.909、0.693、0.604和0.600,四项指标中敏感度和特异度最高的是实时荧光PCR检测痰标本中MP(P<0.01)。见表2,图1。
表2 2种检测方法对痰和咽拭子标本MP的预测价值
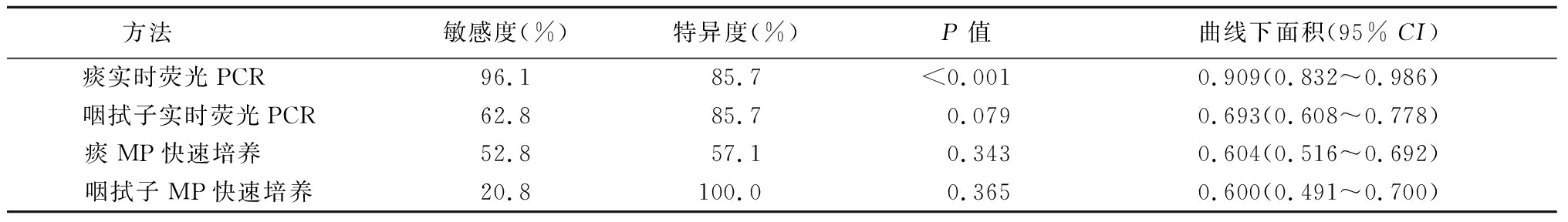
方法 敏感度(%)特异度(%)P值曲线下面积(95% CI)痰实时荧光PCR 96.185.7<0.0010.909(0.832~0.986)咽拭子实时荧光PCR62.885.70.0790.693(0.608~0.778)痰MP快速培养 52.857.10.3430.604(0.516~0.692)咽拭子MP快速培养20.8100.00.3650.600(0.491~0.700)
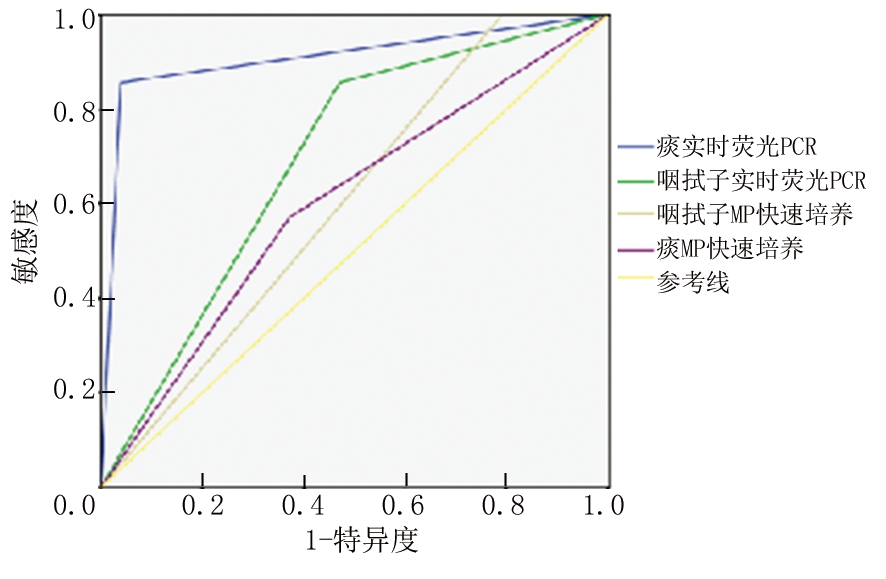
图1 ROC曲线分析
3 讨 论
MP是自然界最小的微生物,介于细菌和病毒之间,呈球形或丝形,无细胞壁,革兰染色阴性,基因组为环状双链DNA,能在培养基上生长。MP是引发儿童肺炎和其他呼吸道感染的重要病原体之一。MP感染无地域性[5-6],任何年龄均可发生,>5岁儿童及青少年多见,儿童与成人感染的临床表现不尽相同,主要通过飞沫且以气溶胶微粒的形式传播。
支原体肺炎起病缓慢,发病初期有咽痛、头痛、发热、乏力、肌肉酸痛、食欲减退、恶心、呕吐等症状。患者一般发热2~3 d,继而出现呼吸道症状,突出表现为刺激性干咳、咳少量黏痰或黏液脓性痰、痰中带血等临床症状,夜间较重,部分有呼吸困难、胸痛等临床表现,10%~15%患儿可发现少量胸腔积液。患者肺部X线检查病变可轻微,也可很广泛。近年来,由其引起的呼吸系统感染日趋增多,支原体肺炎可累及多系统、多器官损伤[7-9]。皮肤损伤表现为斑丘疹、结节性红斑、水疱疹等。胃肠道系统可发生呕吐、腹泻和肝功能等损伤。溶血性贫血是血液系统损伤较常见的并发症。中枢神经系统损伤可见于多发性神经根炎、脑膜脑炎以及小脑损伤等。心血管系统偶并发心肌炎及心包炎。MP感染人体后,首先通过顶端结构黏附于宿主细胞表面,并伸出微管插入细胞内摄取营养、损伤胞膜,然后释放核酸酶和过氧化氢等引起细胞溶解、上皮细胞肿胀坏死的代谢产物。诱发机体免疫系统产生的抗体也可能参与上述病理损伤。
目前,国内外检测MP的技术较多,每种检测方法都对实验标本有具体要求,所以检测技术、实验标本均会影响检验结果的符合度[10-11]。近年来,随着耐药株[12-13]不断出现,MP越来越受到国内外学者的广泛关注。因此,对检验方法的先进性、敏感度、特异度等指标的要求越来越高。
传统的MP分离培养法虽然是诊断MP感染的决定性方法,但耗时长,阳性率较低,对实验条件、环境和人员的要求较高,培养过程中易受细菌和真菌干扰[14],对于早期诊断意义不大,限制了其临床上的应用。MP快速培养所用培养基是一种专门用于培养支原体的培养基,其操作简单,耗时短,特异性较强。培养基内营养物质使MP快速生长繁殖,大量分解葡萄糖,使培养基内的pH值发生改变,导致培养基内指示剂颜色发生变化-由红变黄且清亮,因此可根据颜色变化来判断MP生长情况[15]。当培养基里有大量细菌或真菌生长时也会使培养基颜色由红变黄,同时培养基内液体也会变浑浊,判断MP快速培养结果时应注意鉴别。本研究将患儿痰标本和咽拭子标本同时进行MP快速培养,结果显示,痰标本检测MP阳性率高于咽拭子标本。可能原因为:①咽拭子标本取材过程操作不规范;②咽部细菌在培养过程中繁殖,影响MP结果判定。提示采集咽拭子标本时要规范操作,尽量采集患者痰标本,与咽拭子相比,痰标本是检测MP最佳的标本类型[16],其检测阳性率高有助于临床早期诊断和合理治疗。
PCR已广泛应用于医学诊断及生物学的各个领域。实时荧光PCR具有检测快、敏感度高、特异度高等优点[17-18],能够对病原体进行准确诊断,有利于临床及时诊疗。本研究结果显示,痰标本实时荧光PCR法检测MP阳性率为95.50%、敏感度为96.1%、特异度为85.7%,均明显高于MP快速培养法,提示实时荧光PCR技术可作为检测MP 的首选方法,有助于临床早期诊断,也降低联合检测的经济负担。但实时荧光PCR技术也存在一定的局限性[19],其检测MP的准确度与年龄有关[20]。本研究将进一步深入研究分析,为临床提供更加准确有效地诊断依据。
IgM分布于血清中,主要由脾脏和淋巴结中的浆细胞分泌合成,在5种免疫球蛋白中相对分子质量最大,占血清总Ig的5%~10%。IgM在体液免疫应答中发挥强大的杀菌、激活补体、免疫调理和凝集作用。IgM是机体初次体液免疫应答时最早出现的抗体,是机体抗感染的“先遣军”,因其持续时间不长,也常被认为是近期感染的标志。儿童感染MP 7~10 d后体内出现IgM抗体,3~4周达到高峰,所以临床上常常将MP-IgM抗体滴度>1∶160作为提示患儿处于急性期感染的依据。本研究中初次MP-IgM抗体检测阳性率仅为33.44%,而5~10 d后阳性率为95.98%,提示即使IgM抗体阴性,也不能否定MP感染,临床诊断还需动态监测IgM抗体并结合临床症状。有研究表明,动态监测MP抗体水平,在恢复期和急性期抗体效价呈≥4倍增高时可确诊MP感染[21]。MP-IgM抗体被动凝集法检测具有较高的敏感度和特异度,也是目前临床最常用的血清学检测方法。
综上所述,痰标本是检测MP最佳的标本类型;实时荧光PCR技术检测MP 时敏感度、特异度均高于MP快速培养法。采用实时荧光PCR方法检测痰标本中MP对临床早期诊断具有重要意义。
[1] 刘文渊,卢文波.312例社区获得性肺炎住院患儿肺炎支原体感染状况分析[J].中国卫生检验杂志,2011,21(3):736-737.
[2] 林耀威,汤翠霞,陈世豪,等.肺炎支原体咽拭子培养结果分析[J]. 现代医院,2016,16(3):390-391.
[3] 王继红.小儿支原体肺炎早期心肌酶改变临床分析[J/CD].世界最新医学信息文摘(连续型电子期刊),2015,15(35):50,53.
[4] 王爱荣.浅析进行生化检验对诊断小儿支原体肺炎合并肝损伤、心肌损伤的价值[J].当代医药论丛,2015,13(18):57-58.
[5] Carrim M,Wolter N,Benitez AJ,et al.Epidemiology and molecular identification and characterization of mycoplasma pneumoniae,south africa,2012-2015[J]. Emerg Infect Dis,2018,24(3):506-513.
[6] Copete AR,Aguilar YA,Rueda ZV,et al. Genotyping and macrolide resistance of mycoplasma pneumoniae identified in children with community-acquired pneumonia in Medellín,Colombia[J]. Int J Infect Dis,2018,66:113-120.
[7] Søndergaard MJ,Friis MB,Hansen DS,et al.Clinical manifestations in infants and children with mycoplasma pneumoniae infection[J]. PLoS One,2018,13(4):e0195288.
[8] Kheiri B,Alhesan NA,Madala S,et al. Mycoplasma pneumoniae-associated Fuchs syndrome[J]. Clin Case Rep,2017,6(2): 434-435.
[9] Magun R,Verschoor CP,Bowdish DM,et al. Mycoplasma pneumoniae,a trigger for weston hurst syndrome[J]. Neurol Neuroimmunol Neuroinflamm,2016,3(1):e187.
[10] Chaudhry R,Valavane A,Sreenath K,et al. Detection of mycoplasma pneumoniae and legionella pneumophila in patients having community-acquired pneumonia: a multicentric study from new delhi,india[J]. Am J Trop Med Hyg,2017,97(6):1710-1716.
[11] Dash S,Chaudhry R,Dhawan B,et al. Clinical spectrum and diagnostic yields of mycoplasma pneumoniae as a causative agent of community-acquired pneumonia[J]. J Lab Physicians,2018,10(1):44-49.
[12] Kim YJ,Shin KS,Lee KH,et al. Clinical characteristics of macrolide-resistant mycoplasma pneumoniae from children in Jeju[J]. J Korean Med Sci,2017,32(10):1642-1646.
[13] Smith S,Adamson PJ,Sadlon TA,et al. Prevalence of macrolide-resistant mycoplasma pneumoniae in south australia[J]. Pathology,2016,48(6):639-642.
[14] 吴焕云.培养法检测支原体肺炎假阳性存在因素及临床价值[J/CD].转化医学电子杂志,2014,3(3):94-95.
[15] 张忠浩,谷巍巍,刘晓红.肺炎支原体肺炎的常见诊疗误区[J]. 中国临床医生杂志,2015,43(4):8-11.
[16] 张学红,聂晓晶,张国成,等.咽拭子及痰液标本肺炎支原体培养对支原体肺炎诊断的影响[J].宁夏医学杂志,2009,31(12):1122-1124.
[17] Fourour S,Fablet C,Tocqueville V,et al. A new multiplex real-time TaqMan PCR for quantification of mycoplasma hyopneumoniae,M. hyorhinis and M. flocculare: exploratory epidemiological investigations to research mycoplasmal association in enzootic pneumonia-like lesions in slaughtered pigs[J]. J Appl Microbiol,2018,125(2):345-355.
[18] Zhao MC,Li GX,Zhang D,et al. Clinical evaluation of a new single-tube multiplex reverse transcription PCR assay for simultaneous detection of 11 respiratory viruses,mycoplasma pneumoniae and Chlamydia in hospitalized children with acute respiratory infections[J]. Diagn Microbiol Infect Dis,2017,88(2):115-119.
[19] Dumke R,Benitez AJ,Chalker V,et al. Multi-center evaluation of one commercial and 12 in-house real-time PCR assays for detection of Mycoplasma pneumonia[J]. Diagn Microbiol Infect Dis,2017,88(2):111-114.
[20] 王健容,何旭,饶福光,等.间接免疫荧光与实时荧光PCR检测小儿支原体肺炎[J].国际检验医学杂志,2015,36(18):2633-2634.
[21] 官建军,徐红静,刘英雄.2000例儿童肺炎支原体抗体检测与临床分析[J].现代预防医学,2014,41(2):225-226.