近几年,急性脑梗死出血性转化(hemorrhagic transformation, HT)发病率随急性脑梗死溶栓和抗凝治疗的广泛应用而逐年升高[1]。HT是指缺血性梗死后在梗死区域发生的出血,包括自发性出血和抗凝、溶栓、扩血管等药物治疗后出血,可分为脑实质内血肿(parenchymal hematoma,PH)及出血性梗死(hemorrhagic infarction,HI)[2-3]。HT会使脑出血事件明显恶化,加重患者病情,对康复进程造成严重影响[4-5]。分析HT的临床特征对于HT临床治疗和预后判断具有重要价值。目前,关于影响HT患者预后的危险因素的研究报道较少。因此,本研究探讨HT的临床特征及影响预后的危险因素,现将结果报告如下。
1 资料与方法
1.1 一般资料 选取2016年6月—2019年6月我院收治的40例HT患者作为研究对象。纳入标准:①符合急性脑梗死的诊断标准[6],经实验室检查确诊;②在发病3周以内,经CT复查确诊为HT。排除标准:①合并血液系统疾病者;②合并严重肝、肾功能不全者;③年龄>80岁;④存在精神疾病及认知障碍者。按急性卒中Org 10172治疗试验(Trial of Org 10172 in Acute Stroke Treatment,TOAST)分型分为:小动脉性闭塞型(small artery occlusion,SAO)、心源性栓塞型(cardioembolism,CE)、大动脉粥样硬化型(large artery atheroselerosis,LAA)、不明原因型(undetermined etiology,UND)、其他明确病因型(other determined etiology,OC)。患者接受治疗3个月后,预后情况的评价采用改良Rankin量表( Modified Rankin Scale,mRS) [7],该量表满分6分,得分越高,预后越差。预后良好:0分≤mRS评分<3分;预后不良:3分≤mRS评分≤6分。按照Rankin量表评分分为预后不良组(n=18)和预后良好组(n=22)。
本研究经医院伦理委员会审批通过,所有患者知情同意并签署知情同意书。
1.2 方法 记录所有患者梗死部位、梗死面积、HT发生时间、HT分型和出血后症状变化情况。收集所有患者临床资料,包括性别、年龄、吸烟、糖尿病、高血压、高血脂症、冠心病、卒中和外周血管病史、美国国立卫生研究院卒中量表(National Institute of Health stroke scale,NIHSS)[8]评分及服用抗凝药情况。患者出院后随访6个月,患者每1个月到门诊复诊或电话随访。
1.3 统计学方法 应用SPSS 18.0软件分析数据。计数资料比较采用χ2检验,计量资料比较采用独立样本t检验,影响HT患者预后的危险因素采用多因素Logistic回归分析。P<0.05为差异有统计学意义。
2 结 果
2.1 HT临床特征
2.1.1 梗死部位与出血位置 脑叶梗死21例(52.50%),出血灶位于皮层和皮层下5例,皮层下4例,皮层12例;深部梗死9例(22.50%),出血灶位于梗死边缘或灶内;脑叶和深部梗死7例(17.50%);小脑2例(5.00%);脑干1例(2.50%),出血灶位于梗死灶内。
2.1.2 梗死面积与出血位置 大面积梗死26例(65.00%),出血灶位于混合部位3例,深部脑实质6例,皮层和皮层下17例;小面积梗死12例(30.00%),出血灶位于皮层下及深部脑实质1例,深部脑实质8例,皮层和皮层下3例;腔隙性梗死2例(5.00%),出血灶位于深部脑实质1例,皮层和皮层下1例。
2.1.3 不同亚型脑梗死 不同亚型脑梗死均会发生HT,其中SAO型5例(12.50%),CE型25例(62.50%),LAA型6例(15.00%),UND型3例(7.50%),OC型1例(2.50%)。
2.1.4 HT发生时间 HT发生为发病后1~3 d 7例(17.50%),4~7 d 5例(12.50%),8~14 d 23例(57.50%),15~21 d 5例(12.50%)。
2.1.5 HT分型与症状 HI型36例(90.00%),表现为皮质或深部脑回状、条索状、斑片状、点状出血灶;PH型4例(10.00%),表现为梗死区域形成血肿,血肿主要位于深部基底节区。
2.1.6 HT发生后症状变化 HT发生后症状加重17例(42.50%),其中视野缺损、共同偏视1例,头痛头晕4例,偏瘫6例,意识障碍6例;症状无变化23例(57.50%)。
2.2 影响HT患者预后的单因素分析 两组患年龄、糖尿病、高血压、高血脂症、冠心病、外周血管病史差异无统计学意义(P>0.05),两组性别、吸烟、卒中史、NIHSS评分、服用抗凝药物差异有统计学意义(P<0.05),见表1。
表1 影响HT患者预后的单因素分析
Table 1 Univariate analysis on influencing factors of prognosis in HT patients
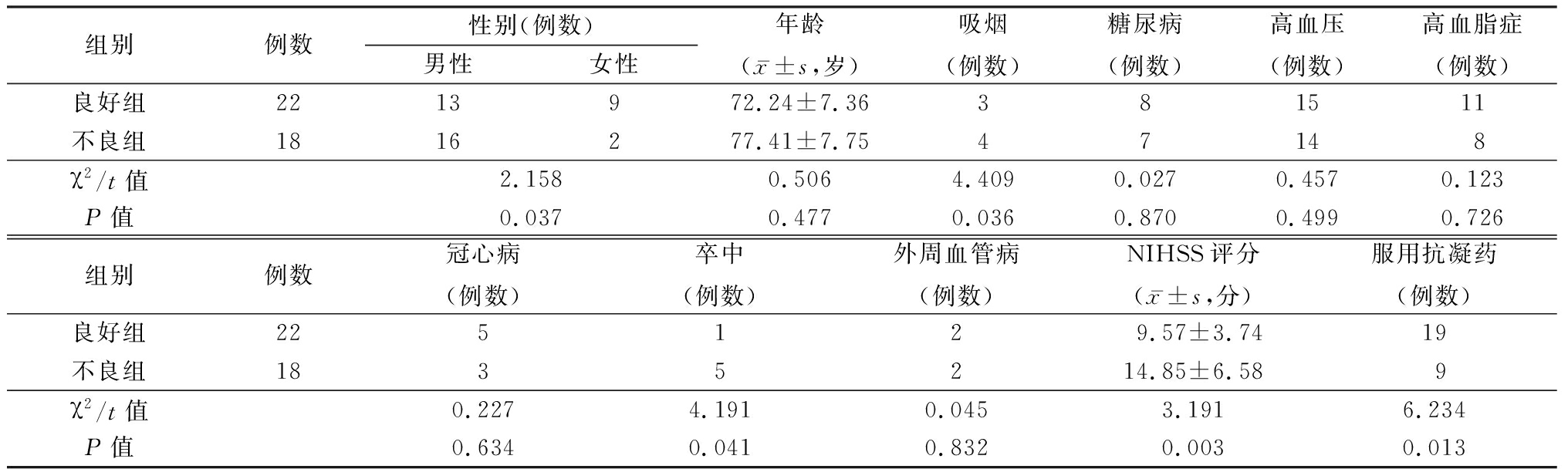
组别例数性别(例数)男性女性年龄(x-±s,岁)吸烟(例数)糖尿病(例数)高血压(例数)高血脂症(例数)良好组2213972.24±7.36381511不良组1816277.41±7.7547148χ2/t值2.1580.5064.4090.0270.4570.123P值0.0370.4770.0360.8700.4990.726组别例数冠心病(例数)卒中(例数)外周血管病(例数)NIHSS评分(x-±s,分)服用抗凝药(例数)良好组225129.57±3.7419不良组1835214.85±6.589χ2/t值0.2274.1910.0453.1916.234P值0.6340.0410.8320.0030.013
2.3 影响HT患者预后的多因素Logistic回归分析 以患者预后(良好=0,不良=1)作为因变量,以性别(女=0,男=1)、吸烟(否=0,是=1)、卒中史(否=0,是=1)、NIHSS评分(≤12分=0,>12分=1)、服用抗凝药(是=0,否=1)为自变量,纳入Logisitic回归模型中,结果显示,NIHSS评分>12分、服用抗凝药物是影响患者预后的独立危险因素(P<0.05),见表2。
表2 影响HT患者预后的多因素Logistic回归分析
Table 2 Multivariate Logistic regression analysis on influencing factors of prognosis in HT patients

自变量回归系数标准回归系数Wald χ2值P值OR值95%CINIHSS评分 1.4470.7273.9620.0474.2501.022~17.671服用抗凝药物1.3570.0185 683.485<0.0013.8853.750~4.024
3 讨 论
急性脑梗死治疗后的并发症较多,HT是常见的并发症之一[9],临床对于HT一般遵循早发现早治疗的原则。HT发病机制是脑梗死后缺血区域的血管再次发生血流灌注,引起脑出血,临床溶栓的效果和安全性受HT影响[10-11]。HT是由多种因素引发的疾病,心房颤动史、大面积脑梗死和尿蛋白阳性等因素可能是HT的主要危险因素[12-13]。因此,需要注意HT的发病机制及影响预后的危险因素,在治疗过程中应尽可能地减少危险因素的发生,帮助提升患者的生存时间及生活质量。
本研究结果显示,HT出血部位多发生于脑叶梗死部位,提示急性脑叶梗死患者脑更容易发生HT,这是由脑叶发生血管透明变性的机制所致,脑叶部位和β-淀粉样蛋白沉积有关,β-淀粉样蛋白沉积易引发淀粉样脑血管病,导致脑出血[14]。
国外研究发现[15],大面积脑梗死与HT发生密切相关。本研究HT发生大面积脑梗死的比例高达65.00%,这是因为水肿脑组织会压迫病变区周围血管,导致血管内皮组织损伤,当消除水肿脑组织后,周围血管因长期受压而易破裂,最终出现HT;氧化应激反应及炎性反应也会刺激血管内皮细胞,使其功能异常,破坏血脑屏障,引发HT[16]。本研究按照TOAST分型方法,CE占比较高,较其他亚型的脑梗死更易发生HT,这可能是因为,栓塞远端的毛细血管存在缺血坏死,当解除栓子,血管再通后,毛细血管壁由于再灌注出现破裂出血,最终形成HT[17]。本研究结果显示,脑梗死发生至 HT 发生的时间间隔在1周内29.2%,1~2周内占58.3%,3周以上占2.1%,提示临床应在2周内进行MRI或CT复查,尽早发现HT,改善患者预后。HT多以HI为主,影像学检查结果表现为皮质斑片状、点状出血,其原因在于皮质梗死更易发在较大动脉上,这些动脉的侧支循环较为丰富,极易再通。在皮质侧支循环对缺血半暗带的维持作用和动脉的缓和血压作用下,皮质出血一般呈现斑片状或点状出血。
本研究行单因素分析后发现,两组性别、吸烟史、卒中史、NIHSS评分、服用抗凝药物差异有统计学意义。为了分析HT患者预后的高危因素,使用多因素Logistic回归分析发现,NIHSS评分>12分、服用抗凝药是影响HT患者预后的危险因素。临床研究发现,NIHSS评分每升高1分,脑梗死患者溶栓后发生HT的概率会提高1.38倍[18]。当NIHSS评分>20分,HT发生的概率是NHHSS评分<5分的11倍[19]。闫慧等[20]研究发现,卒中严重程度可以使用NIHSS评分进行评估,NIHSS评分越高说明梗死部位比较特殊、梗死面积相对越大。因此,NIHSS评分是是影响HT患者预后的危险因素。NIHSS评分>12分表明神经功能损伤严重,脑组织受损范围大。梗死区域存在的水肿会导致恶性颅内高压,使梗死灶周围的毛细血管处于压迫状态,损害血管壁内皮,引发缺血坏死。此外,当下丘脑脑干等部位出现梗死时,会提升并发症发生率,严重影响其预后情况[21]。临床研究发现,长期服用抗凝药物的患者在急性脑梗死时更容易出现HT,影响患者预后[22]。本研究结果显示,服用抗凝药物的患者发生不良预后的风险是未服用抗凝药物患者的4.250倍,这可能是长期服用抗凝药物导致HT患者凝血功能出现异常,不良预后的可能性升高。提示在临床工作中应该高度重视上述危险因素,严密监护病情。
综上所述,CE型的急性脑梗死、脑叶梗死及大面积梗死患者更容易发生HT。HT多发于急性脑梗死后8~14 d内,多数为HI型,出血后症状加重占42.50%。NIHSS评分>12分、服用抗凝药物是影响HT患者预后的危险因素,治疗HT患者应结合上述因素制定个体化的治疗方案,改善患者预后。
[1] Mehta T, Hussain M,Sheth K,et al. Risk of hemorrhagic transformation after ischemic stroke in patients with antiphospholipid antibody syndrome[J]. Neurol Res,2017,39(6):477-483.
[2] 占达良,王晟,张耿.影响急性脑梗死患者预后的入院前相关因素分析[J].中国卫生统计,2018,35(4):569-572.
[3] 王金,许开喜,陈新建,等.深髓静脉征和皮质静脉征对急性脑卒中出血转化的预测研究[J].医学影像学杂志,2018,28(8):1246-1249.
[4] 周帆,黄云峰.血栓弹力图在急性脑梗死患者早期神经功能缺损及出血性转化风险性评估中的价值[J].实用临床医药杂志,2019,23(6):73-76.
[5] 孙凡,刘恒,付慧霄,等.急性脑梗死后出血转化的危险因素[J].中国老年学杂志,2019,39(17):4163-4165.
[6] 谷聚贤,李易明,安泽鑫,等.阿加曲班对早期急性脑梗死患者溶栓后的疗效分析[J].河北医科大学学报,2019,40(8):886-889.
[7] 陶冶,薛维爽,滕伟禹.三种量表与自发性脑出血患者预后相关性的研究[J].中国医师杂志,2017,19(5):770-772.
[8] 潘双杰,何远宏,王楠,等.羟乙基淀粉对急性缺血性脑卒中患者肾功能的影响[J].郑州大学学报(医学版),2017,52(3):353-355.
[9] 郭媛媛,罗永平,刘学东.急性脑梗死患者溶栓后出血转化发生特征及相关危险因素分析[J].解放军预防医学杂志,2017,35(10):1212-1214.
[10] 中华医学会神经病学分会,中华医学会神经病学分会脑血管病学组.中国急性脑梗死后出血转化诊治共识2019[J].中华神经科杂志,2019,52(4):252-265.
[11] Valentino F,Gentile L,Terruso V,et al. Frequency and determinants for hemorrhagic transformation of posterior cerebral stroke:posterior ischemic stroke and hemorrhagic transformation[J]. Bmc Res Notes,2017,10(1):592.
[12] 张晓峰.中老年急性脑梗死患者出血性转化的危险因素研究[J].实用心脑肺血管病杂志,2017,25(2):38-41.
[13] 崔志军,房维学.急性缺血性脑卒中患者脑微出血的相关危险因素研究[J].中国中西医结合急救杂志,2018,25(6):650-652.
[14] 邱凌骐,邱浩强,陈松深.脑微出血对轻型急性期脑梗死强化双抗后出血性转化的风险探讨[J].中国医师进修杂志,2018,41(9):772-775.
[15] García-Culebras A,Palma-Tortosa S,Moraga A,et al. Toll-like receptor 4 mediates hemorrhagic transformation after delayed tissue plasminogen activator administration in in situ thromboembolic stroke[J]. Stroke,2017,48(6):1695-1699.
[16] 王彬.溶栓治疗急性缺血性脑卒中患者发生出血性转化的危险因素探讨[J].神经损伤与功能重建,2019,14(11):568-570.
[17] van Kranendonk KR,Treurniet KM,Boers AMM,et al. Hemorrhagic transformation is associated with poor functional outcome in patients with acute ischemic stroke due to a large vessel occlusion[J]. J Neurointerv Surg,2019, 11(5):464-468.
[18] Li X,Ling L, Li C,et al. Efficacy and safety of desmoteplase in acute ischemic stroke patients:a systematic review and meta-analysis [J]. Medicine,2017,96(18):e6667.
[19] Hao Y, Zhang Z,Zhang H,et al. Risk of intracranial hemorrhage after endovascular treatment for acute ischemic stroke:systematic review and meta-analysis[J]. Interv Neurol,2017,6(1/2): 57-64.
[20] 闫慧,赵雪曼.急性脑梗死溶栓治疗后出血转化的危险因素分析[J].心血管康复医学杂志,2019,28(1):38-41.
[21] 沈明强,吴冠会,董晓峰,等.阿加曲班抗凝治疗急性脑梗死的疗效观察[J].临床神经病学杂志,2017,30(2):141-144.
[22] 安啟萍,张荣勇,黄云, 等.缺血性脑卒中患者静脉溶栓后出血转化的危险因素研究[J].护士进修杂志,2019,34(21):1934-1936,1941.