脓毒症是由病原菌感染机体而引起免疫功能紊乱的全身炎症反应综合征,凝血障碍是引起脓毒症患者组织器官衰竭的重要推动因素[1-3],因此在常规抗感染的基础上配合采用抗炎或抗血栓治疗可作为新的治疗选择,通过在对症(抗炎、血栓调节)和对因(抗感染)两个方面联合作用而发挥疗效。其中乌司他丁作为尿蛋白酶抑制剂,可有效清除氧自由基、调节炎症因子,以及减轻炎性递质对机体的免疫炎症损伤,改善疾病[4];中药制剂丹红注射液则通过防止血栓形成、促进纤溶系统活性及扩张血管从而改善凝血状态,防止动脉硬化[5]。调节性T淋巴细胞(T regular cell,Treg)和辅助性T细胞17(T help cell 17,Th17)是引起脓毒症患者体内免疫异常的相关细胞,可通过分泌炎症因子或直接作用调控免疫反应,其中CD4+ CD25+ Treg的CD25+表达数量可反映免疫功能强度。脓毒症患者受感染刺激后,使得炎症因子如可溶性髓样细胞触发受体1(soluble triggering receptor exprssed on myeloid cells 1,sTREM-1)、肝素结合蛋白(heparin-bindingprotein,HBP)等异常表达,从而调控炎症反应和凝血状态,可作为敏感性指标反映疾病进展[6-8]。目前,关于抗感染、抗炎、抗血栓联合治疗脓毒症及对脓毒症患者凝血功能、免疫系统、炎症因子的报道并不多见,因此本研究将通过实例探讨乌司他丁联合丹红注射液对脓毒症的疗效及对sTREM-1和HBP水平及Th17/Treg的影响。
1 资料与方法
1.1 一般资料 选取2015年1月—2017年6月南京医科大学附属淮安第一医院收治的脓毒症患者120例,根据随机数字表法分为对照组和观察组各60例。两组一般资料比较差异无统计学意义(P>0.05),具有可比性,见表1。
本研究已获得医院伦理委员会批准。所有患者家属均签署知情同意书。
表1 两组一般资料比较
Table 1 Comparison of general information between two groups (n=60)
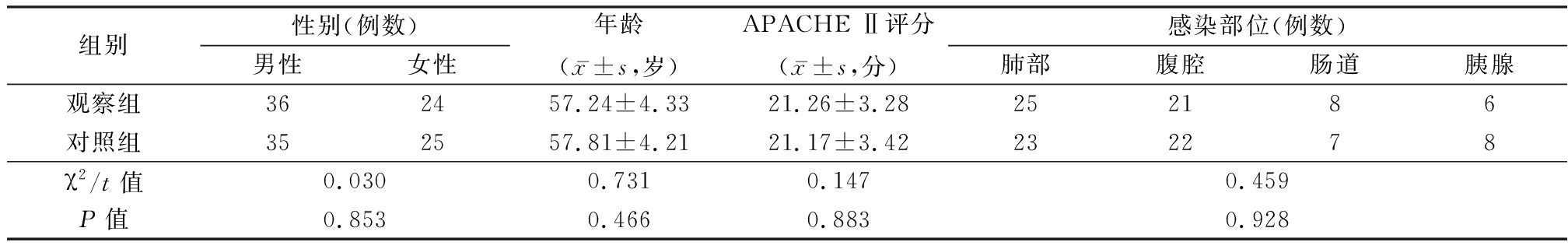
组别性别(例数)男性女性年龄(x-±s,岁)APACHE Ⅱ评分(x-±s,分)感染部位(例数)肺部腹腔肠道胰腺观察组362457.24±4.3321.26±3.28252186对照组352557.81±4.2121.17±3.42232278χ2/t值0.0300.7310.1470.459P值0.8530.4660.8830.928
1.2 纳入标准与排除标准 纳入标准:①符合Sepsis3.0中的临床诊断标准[9];②急性生理学与慢性健康状况(Acute Physiology and Chronic Health EvaluationⅡ,APACHEⅡ)评分均超过16分。排除标准:①有严重心、肝、肾功能障碍者,有免疫、血液、神经系统疾病者;②发病前接受免疫抑制剂或低分子肝素等抗凝剂治疗者;③对丹红注射液过敏者;④依从性、耐受性差者;⑤妊娠期、哺乳期、经期患者。
1.3 治疗方法 对照组采用常规抗感染治疗,适时地补充营养以纠正水电解质紊乱和维持酸碱平衡,实时监测血氧饱和度,配合输液和机械通气等,静脉输注乌司他丁(广东天普生化医药股份有限公司,031611323),10万U /次静滴,1次/8 h,7 d/疗程。观察组在对照组基础上静脉滴注丹红注射液(步长药业有限公司,10 mL/支,Z20026866),40 mL加入250 mL生理盐水中,1次/d,7 d/疗程。两组患者确保正常作息,持续1个疗程,治疗过程中密切关注患者心率、血压、体温、呼吸等体征。
1.4 观察指标
1.4.1 临床疗效比较 治疗7 d后评估临床疗效:①心率恢复到病前水平;②体温恢复至36~38 ℃范围内;③自主呼吸频率<20次/min;④白细胞计数为(4~12)×109/L。至少符合以上指标中的3项则为有效,否则为无效[9]。
1.4.2 APACHE Ⅱ评分 分别于治疗前、治疗3 d、治疗7 d 观察两组APACHE Ⅱ评分[1]。
1.4.3 血清HBP和sTREM-1水平比较 分别于治疗前、治疗7 d早晨空腹抽取静脉血5 mL,3 000 r/min离心5 min,上清液置入EP管在-70 ℃保存。应用酶联免疫吸附实验法检测血清HBP和sTREM-1水平,试剂盒购自上海酶联生物科技有限公司。
1.4.4 T细胞亚群比较 分别于治疗前、治疗7 d早晨抽取空腹静脉血5 mL,乙二胺四乙酸作为抗凝剂处理获取抗凝全血,以淋巴细胞分离液处理获取外周血单核细胞,应用流式细胞仪(美国Becton-Dickinson公司)计数外周血T细胞亚群指标水平,包括Th17和Treg(CD4+ CD25+、CD4+ CD25high),并计算其占淋巴细胞的百分数。
1.4.5 凝血功能指标比较 分别在入院时及治疗7 d时记录患者血小板计数(platelet count,PLT)、凝血酶原时间(prothrombin time,PT)、活化部分凝血活酶时间(activated partial thromboplastin time,APTT)、纤维蛋白原(fibrinogen,FIB)、凝血酶时间(thrombin time,TT)。
1.4.6 不良反应 观察并记录患者治疗过程中用药不良反应。
1.5 统计学方法 应用SPSS 19.0统计软件分析数据。计数资料比较采用χ2检验;计量资料比较采用两独立样本的t检验、配对t检验和重复测量方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1 临床疗效比较 治疗7 d后,观察组有效率为90.00%(54/60),明显高于对照组75.00%(45/60),差异有统计学意义(χ2=4.490,P=0.034)。
2.2 APACHEⅡ评分比较 两组APACHEⅡ评分组间、时点间和组间·时点间比较差异均有统计学意义(P<0.05)。两组经治疗后APACHEⅡ评分均显著降低,治疗后7 d评分低于治疗后3 d,观察组治疗后3 d、7 d评分均显著低于对照组。见表2。
表2 两组APACHEⅡ评分比较
Table 2 Comparison of APACHEⅡ score between two groups ![]() 分)
分)

组别 治疗前治疗后3 d治疗后7 d观察组 21.16±3.2314.22±2.379.37±1.22对照组 21.27±3.4118.35±3.1213.15±1.56组间 F值=20.158 P值=0.027时点间 F值=18.258 P值=0.032组间·时点间F值=32.524 P值=0.006
2.3 两组血清HBP和sTREM-1水平的比较 治疗前,两组血清HBP和sTREM-1水平差异均无统计学意义(P>0.05)。治疗后,两组血清HBP和sTREM-1水平低于治疗前,差异均有统计学意义(P<0.05),观察组血清HBP和sTREM-1水平显著低于对照组,差异均有统计学意义(P<0.05或P<0.01)。见表3。
表3 两组血清HBP和sTREM-1水平比较
Table 3 Comparison of serum HBP and sTREM-1 levels between two groups![]()
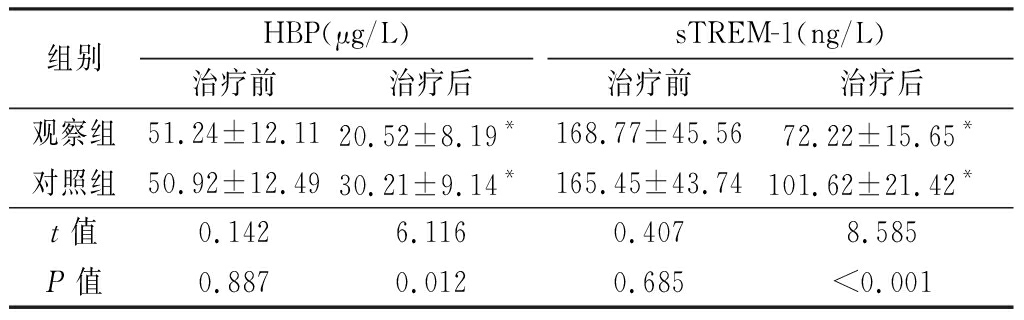
组别HBP(μg/L)治疗前治疗后sTREM-1(ng/L)治疗前治疗后观察组51.24±12.1120.52±8.19*168.77±45.5672.22±15.65*对照组50.92±12.4930.21±9.14*165.45±43.74101.62±21.42*t值0.1426.1160.4078.585P值0.8870.0120.685<0.001
*P值<0.05与治疗前比较(配对t检验)
2.4 两组Th17和Treg表达率的比较 治疗前,两组Th17和Treg(CD4+ CD25+、CD4+ CD25high)表达率差异均无统计学意义(P>0.05)。治疗后,两组Th17和Treg(CD4+ CD25+、CD4+ CD25high)表达率显著低于治疗前,差异均有统计学意义(P<0.05),观察组Th17和Treg(CD4+ CD25+、CD4+ CD25high)表达率显著低于对照组,差异均有统计学意义(P<0.05或P<0.01)。见表4。
表4 两组Th17和Treg表达率的比较
Table 4 Comparison of Th17 and Treg expression rate between two groups![]()
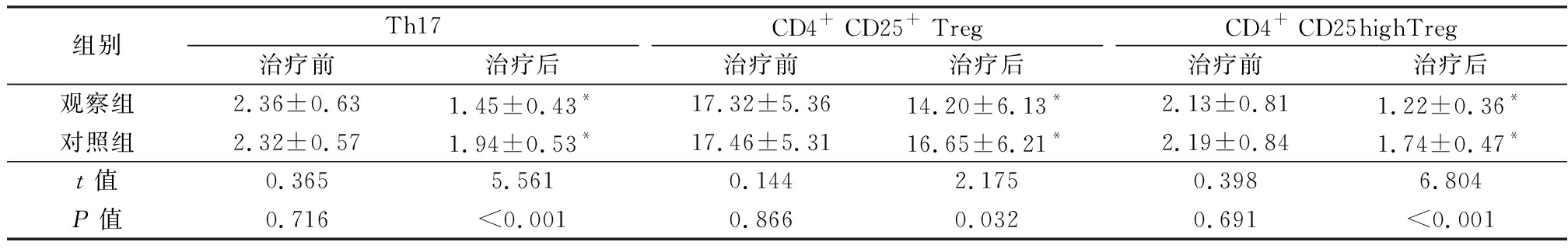
组别Th17治疗前治疗后CD4+ CD25+ Treg治疗前治疗后CD4+ CD25highTreg治疗前治疗后观察组2.36±0.631.45±0.43*17.32±5.3614.20±6.13*2.13±0.811.22±0.36*对照组2.32±0.571.94±0.53*17.46±5.3116.65±6.21*2.19±0.841.74±0.47*t值0.3655.5610.1442.1750.3986.804P值0.716<0.0010.8660.0320.691<0.001
*P值<0.05与治疗前比较(配对t检验)
2.5 两组凝血功能指标的比较 治疗前,两组PLT、PT、APTT、FIB、TT差异均无统计学意义(P>0.05)。治疗后,两组较治疗前PLT和FIB均升高,PT、APTT和TT均降低,差异均有统计学意义(P<0.05);观察组较对照组PLT和FIB均显著升高,PT、APTT和TT均显著降低,差异均有统计学意义(P<0.01)。见表5。
表5 两组凝血功能指标的比较
Table 5 Comparison of coagulation function indexes between two groups![]()
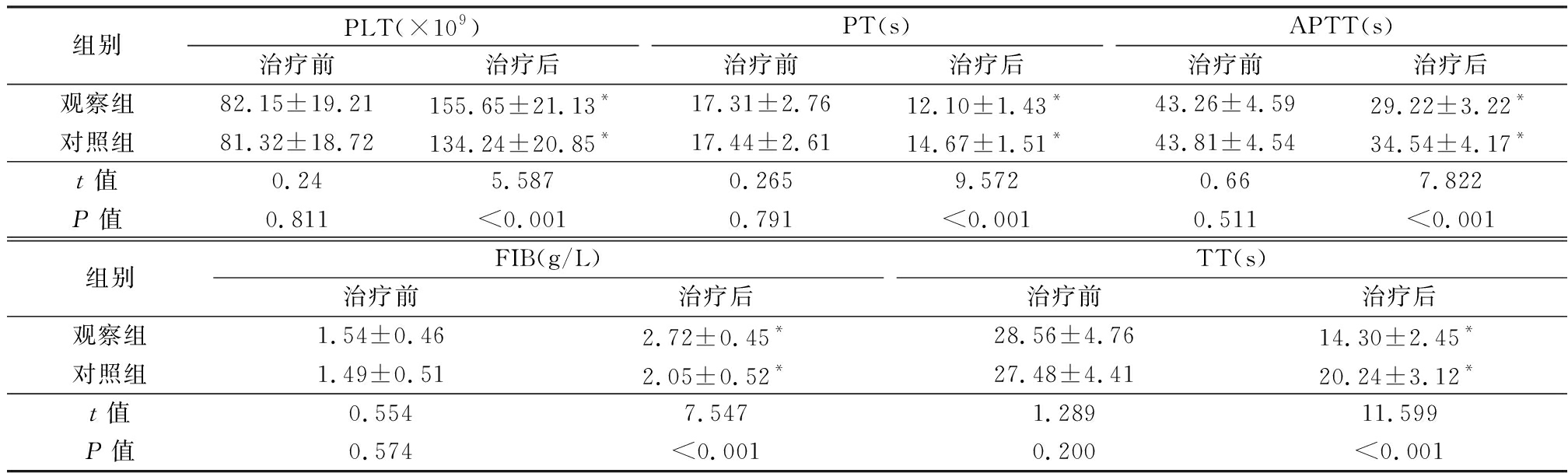
组别PLT(×109)治疗前治疗后PT(s)治疗前治疗后APTT(s)治疗前治疗后观察组82.15±19.21155.65±21.13*17.31±2.7612.10±1.43*43.26±4.5929.22±3.22*对照组81.32±18.72134.24±20.85*17.44±2.6114.67±1.51*43.81±4.5434.54±4.17*t值0.245.5870.2659.5720.667.822P值0.811<0.0010.791<0.0010.511<0.001组别FIB(g/L)治疗前治疗后TT(s)治疗前治疗后观察组1.54±0.462.72±0.45*28.56±4.7614.30±2.45*对照组1.49±0.512.05±0.52*27.48±4.4120.24±3.12*t值0.5547.5471.28911.599P值0.574<0.0010.200<0.001
*P值<0.05与治疗前比较(配对t检验)
2.6 两组不良反应比较 两组患者治疗期间不良反应主要为过敏反应,具体表现为颜面潮红、皮疹、胸闷等,不良反应均较轻,且对症治疗后均很快消失。观察组不良反应10例(16.67%),其中颜面潮红(3例)、皮疹(4例)、胸闷(3例),对照组不良反应8例(13.33%),其中颜面潮红(3例)、皮疹(2例)、胸闷(3例),不良反应发生率差异无统计学意义(χ2=0.260,P=0.609)。
3 讨 论
脓毒症是休克、病原菌感染及严重创伤等多种应激因素下的常见并发症,脓毒症患者往往伴随产生不同程度的机体免疫力低下、炎症异常、凝血障碍等异常生理过程,最终引起多系统、多器官病理改变,严重危及患者生命安全[10-11]。目前常见的治疗策略有改善临床病症(发热、营养失调、电解质紊乱等)、抗感染、抗炎、抗血栓等。乌司他丁可有效调节炎症因子水平及Th17/Treg的平衡,抑制内皮细胞黏附分子过度表达,减轻水解酶对正常组织器官的伤害,从而改善机体免疫功能和炎症反应,但对于血流动力学状态无直接作用,临床上通常用于辅助治疗脓毒血症[4]。中医认为脓毒症的病因为气阴两伤、络脉瘀滞、正虚毒损及脏腑功能衰竭,针对该病因常采用通关开窍、活血化瘀、益气养阴的治疗原则[12-13]。从中医理论角度认为,丹红注射液中的主要成分丹参、红花均可活血祛瘀、排脓止痛[2];从现代药理角度认为,丹红注射液通过抑制血小板聚集而防止血栓形成,以及通过促进纤溶系统活性和调节血脂,改善血流状态和防止动脉硬化[14]。本研究结果显示,经不同方案治疗后,观察组有效率显著高于对照组,且APACHEⅡ评分显著低于对照组,两组均出现较轻的不良反应,主要为颜面潮红、皮疹、胸闷,不良反应发生率差异无统计学意义,表明联合使用抗感染(抗生素)、抗炎(乌司他丁)及抗血栓(丹红注射液)治疗脓毒症效果显著,可有效改善患者临床病症,促进预后。李志云等[2]指出在常规治疗基础上采用丹红注射液,可有效降低APACHEⅡ评分,乌司他丁通过抑制氧自由基的生成,减轻严重的免疫麻痹,从而改善免疫功能,促进预后。尽管治疗过程有一定程度的不良反应(颜面潮红、心悸等),但对症处理后均很快好转,与本次试验结果一致,表明安全性、有效性可靠,值得临床推广。
脓毒症是各种原因的感染导致的机体平衡、免疫系统的失衡,表现为炎症反应异常和凝血障碍[11]。Treg和Th17作为免疫系统重要的细胞,可通过分泌炎症介质或直接作用等方式增强抗感染的免疫能力和清除病原体的能力,从而参与脓毒症发生发展[6]。sTREM-1作为新型炎症标记物,机体受感染刺激后大量释放于血液中,与脓毒症炎症级联反应的触发和放大密切关系[8]。本次研究结果显示,两组患者经治疗后其Treg、Th17及sTREM-1水平均显著改善,且观察组改善程度显著优于对照组,表明联合治疗可有效调控脓毒症患者的免疫系统,改善炎症反应。分析认为抗菌治疗杀死大量的病原菌,减少对机体的刺激。丹红注射液一方面通过抑制氧化酶活性及血管内皮细胞氧自由基生成,阻断内皮细胞凋亡,增加内皮细胞一氧化氮的释放,保护内皮细胞,降低炎症反应;另一方面可激活内皮网状系统,调节免疫系统活性作用,提高机体清除内毒素的能力,阻止炎症瀑布反应,联合乌司他丁治疗时,可有效清除氧自由基、调节炎症细胞因子,改善Th17/Treg平衡,减轻炎性递质对机体的免疫炎症损伤[4]。研究表明,联合治疗进一步降低炎症反应,改善免疫功能,表现为经治疗后,血清Th17、Treg(CD4+ CD25+、CD4+ CD25high)及sTREM-1水平显著降低。
脓毒症患者存在凝血障碍,表现为毛细血管内微血栓形成,组织灌注不良,进而引起血流动力学紊乱,其凝血指标可用于评估疾病进展和治疗效果[2]。HBP是由活化的中性粒细胞释放的可分泌蛋白质,可增强毛细血管渗透性,减少有效循环血量,与严重脓毒症的病理生理过程(炎症反应、微循环功能状态)密切关联[7]。研究结果显示,经治疗后观察组凝血指标(PLT、PT、APTT、FIB、TT)改善程度显著优于对照组,HBP显著低于对照组,表明联合治疗可显著改善凝血功能,促进预后。分析认为,抗感染(抗生素)、抗炎(乌司他丁)从源头和过程中改善疾病症状,丹参活性成分抑制血小板聚集,防止血栓形成[15],阻断机体炎性反应和凝血障碍严重紊乱导致的恶性循环,扩张血管,改善微循环,故而改善凝血功能障碍,降低HBP水平。
综上所述,乌司他丁联合丹红注射液对脓毒症患者的疗效显著,能够有效调节sTREM-1、HBP水平及Th17/Treg表达率,从而改善免疫、凝血功能,促进预后。
[1] 李皖生,徐道剑,王国涛.参麦注射液治疗脓毒症临床效果及对LAC、NSE和S100B蛋白的影响[J].中华中医药学刊,2018,36(3):688-691.
[2] 李志云,杜仲平,王春雨,等.丹红注射液对严重脓毒症凝血功能及预后的影响[J].世界中医药,2015,10(8):1197-1200.
[3] 戴琳琳,崔颖.低分子肝素抗凝治疗对ICU脓毒症患者凝血功能和炎症反应的影响[J].河北医科大学学报,2018,39(1):100-104.
[4] 韩林,熊滨.乌司他丁联合胸腺肽对脓毒血症患者血清炎症因子、黏附因子及免疫细胞亚群的影响[J].山东医药,2017,57(41):91-93.
[5] 李建鹏,王峥.丹红注射液对血栓性浅静脉炎血液流变学、炎症细胞因子及内皮功能的影响[J].中国实验方剂学杂志,2016,22(3):192-196.
[6] 李国辉,马纪林,石占利,等.重症脓毒症患者辅助性T细胞17及调节性T细胞的监测及意义[J].中华全科医学,2015,13(7):1045-1047,1094.
[7] 许程,徐元宏.肝素结合蛋白在脓毒症诊断中的临床应用价值[J].中国现代医学杂志,2015,25(32):59-62.
[8] 罗运山,刘易林,邓霞梅,等.PCT、sTREM-1结合APACHE Ⅱ评分对脓毒症诊断和预后的价值[J].实用医学杂志,2017,33(4):586-590.
[9] Seymour CW,Liu VX,Iwashyna TJ,et al. Assessment of clinical criteria for sepsis:for the third international consensus definitions for sepsis and septic shock(sepsis-3)[J]. JAMA,2016,315(8):762-774.
[10] 高勇,王晓静,李宁.降钙素原下降率对脓毒血症治疗及预后评估的意义[J].河北医科大学学报,2015,36(7):768-771,782.
[11] 唐虹.乌司他丁、血必净联合治疗对烧伤后脓毒症凝血功能及全身炎性反应影响的临床研究[J].中国医科大学学报,2015,44(12):1132-1136.
[12] 何聪,王显雷,王志刚,等.参麦注射液联合中药大黄制剂对脓毒症合并急性肾损伤患者免疫功能的影响[J].中国医院药学杂志,2015,35(19):1759-1761.
[13] Adembri C,Selmi V,Vitali L,et al. Expression and characterization of anionic components in the tubulointerstitial compartment of rat kidney during polymicrobial sepsis[J]. Acta Histochem,2014,116(1):94-105.
[14] 孙良,李丕宝,孙先义.丹红注射液与黄芪注射液对重症脓毒症患者肾功能及微循环的影响[J].山东医药,2015,55(29):92-94.
[15] 王涛. 丹红注射液对下肢骨折患者凝血及局部微循环状态的影响研究[J]. 世界中医药,2014,9(8):1020-1022.