下肢动脉粥样硬化是糖尿病(diabetes mellitus,DM)患者常见的慢性血管并发症之一,一方面常提示心脑血管疾病发病风险增高,另一方面严重狭窄和闭塞可导致下肢坏疽,轻则致残,重则危及生命。研究发现,DM尤其是合并有危险因素的DM,会增加外周血管狭窄的发生率[1]。DM下肢大血管病变常发生在膝以下动脉,累及多支动脉,呈多节段性表现。糖尿病足的主要致病因素之一即下肢微血管障碍[2]。由于下肢大小循环缺血,可产生局部发绀、溃疡、坏死,经久不愈,甚至截肢。本研究以DM膝以下动脉狭窄患者为主要研究对象,观察胰激肽原酶肠溶片联合贝前列素钠对DM合并下肢动脉闭塞患者的最大行走距离、无痛行走距离,踝肱指数(ankle brachial index,ABI)、收缩期峰值血流速度(peak systolic blood flow velocity,PSV)、 血管管径狭窄率的影响,为临床联合用药提供依据。
1 资料与方法
1.1 一般资料 选择2016年2月—2019年2月我院收治的2型DM合并膝以下动脉胫前动脉,胫后动脉,腓动脉狭窄的患者60例,并按照随机分配原则分为对照组与观察组各30例。对照组男性16例,女性14例;年龄42~74岁,平均(57.12±7.96)岁;病程4~14年,平均(7.16±0.82)年; 26例单侧下肢病变,4例双侧下肢病变。观察组男性14例,女性16例;年龄45~73岁,平均(59.04±6.31)岁;病程5~13年,平均(7.03±0.95)年; 27例单侧下肢病变,3例双侧下肢病变。两组患者一般资料比较差异无统计学意义(P>0.05),具有可比性。
本研究经医院伦理委员会审批通过,所有患者及家属均知情同意并签署知情同意书。
1.2 纳入标准 DM诊断标准按WHO1999年颁布的《糖尿病诊断标准》及2011年8月我国卫生部正式发布的动脉硬化闭塞症(arteriosclerosis obliterans,ASO)的诊断标准。常规抗动脉硬化治疗,血脂达标,血糖相对较为稳定,空腹血糖在6.0~8.0 mmol/L,餐后2 h血糖在8.0~10.0 mmol/L。纳入患者:①具有相关的临床表现,局部组织缺血改变,可有间歇性跛行或静息痛、下肢麻木或发凉等症状;足背动脉搏动减弱或消失;②符合下肢动脉硬化症的临床诊断标准,彩色多普勒超声检查发现胫前动脉,胫后动脉,腓动脉狭窄;③四肢血流多普勒检查ABI<0.9。
1.3 排除标准 ①有出血倾向、下肢溃疡、外伤后致血管闭塞等其他原因引起的下肢血管病变;②DM酮症酸中毒及合并感染;③精神疾患不能配合治疗或者依从性差;④妊娠期或者哺乳期妇女;⑤入院前1个月内使用过抗凝药和(或)血管扩张药物。
1.4 方法 2组严格控制血糖及抗动脉硬化治疗。对照组单用贝前列腺素钠片(北京泰德制药股份有限公司,国药准字H20083588),40 μg/次,口服,3次/d;观察组在对照组基础上口服胰激肽原酶肠溶片(怡开,常州千红批准文号:国药准字H20067914),240 U/次,口服,3次/d。观察12周。
1.5 观察指标 ABI的测量:采用日本ES-1000SPM 多普勒血流探测仪测定,正常人休息时ABI为0.9~1.3。胫前动脉,胫后动脉,腓动脉相关指标测定:采用利浦IU-22多普勒超声仪检查胫前动脉,胫后动脉,腓动脉中狭窄最严重的部位的PSV及血管管径狭窄率。双侧肢体均发病时,取较重一侧数值为评价标准。
1.6 统计学方法 应用SPSS 19.0统计软件进行处理数据。计量资料比较采成组设计的t检验或配对t检验,计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 两组患者下肢运动功能及ABI比较 治疗后,两组患者最大行走距离、无痛行走距离、ABI均明显高于治疗前,差异有统计学意义(P<0.05);且治疗后,观察组最大行走距离、无痛行走距离、ABI均明显高于对照组(P<0.05)。见表1。
表1 两组患者最大行走距离、无痛行走距离和ABI比较
Table 1 Comparison of painless walking distance, maximum walking distance and ABI between two groups![]()
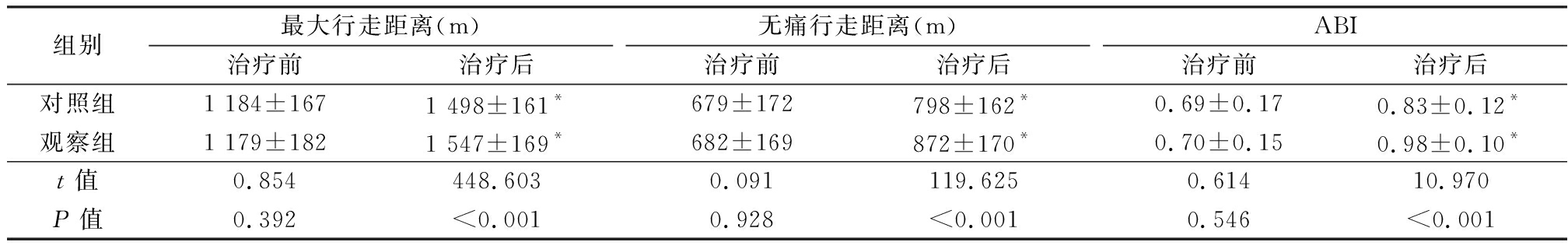
组别最大行走距离(m)治疗前治疗后无痛行走距离(m)治疗前治疗后ABI治疗前治疗后对照组1 184±1671 498±161*679±172798±162*0.69±0.170.83±0.12*观察组1 179±1821 547±169*682±169872±170*0.70±0.150.98±0.10*t值0.854448.6030.091119.6250.61410.970P值0.392<0.0010.928<0.0010.546<0.001
*P值<0.05与治疗前比较(配对t检验)
2.2 两组患者的血管相关指标比较 治疗后,两组胫前动脉、胫后动脉及腓动脉PSV明显减慢,管径狭窄率明显低于治疗前,差异有统计学意义(P<0.05);且治疗后,观察组各个动脉PSV较对照组显著减慢,管径狭窄率明显低于对照组,差异有统计学意义(P<0.05)。见表2。
表2 两组患者的血管相关指标比较
Table 2 Comparison of vascular related indexes between two groups![]()
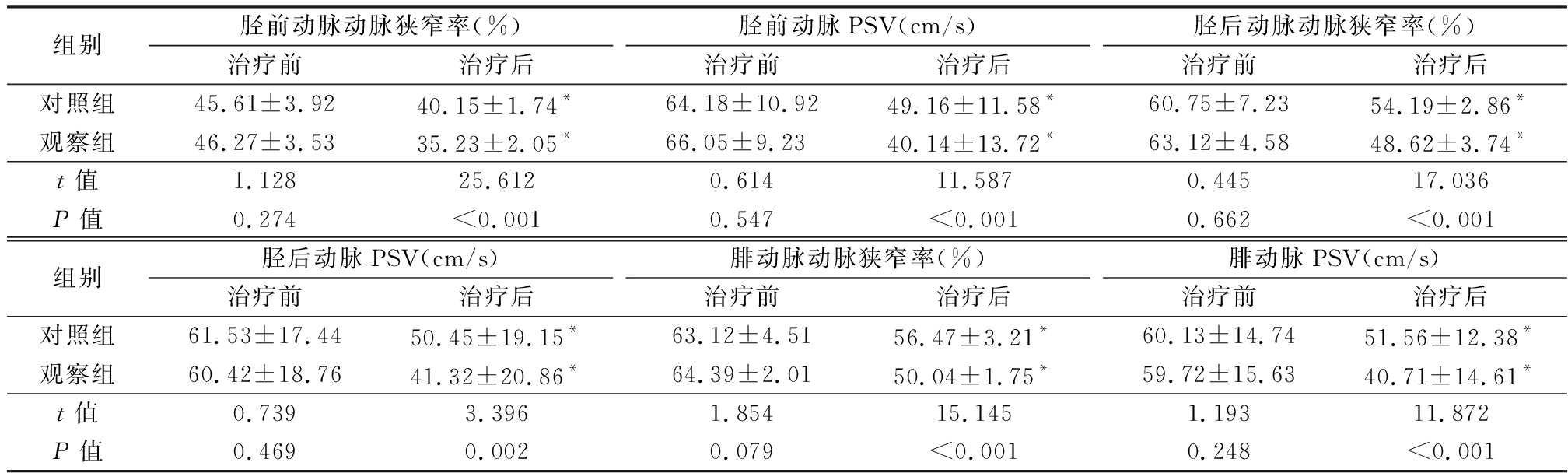
组别胫前动脉动脉狭窄率(%)治疗前治疗后胫前动脉PSV(cm/s)治疗前治疗后胫后动脉动脉狭窄率(%)治疗前治疗后对照组45.61±3.9240.15±1.74*64.18±10.9249.16±11.58*60.75±7.2354.19±2.86*观察组46.27±3.5335.23±2.05*66.05±9.2340.14±13.72*63.12±4.5848.62±3.74*t值1.12825.6120.61411.5870.44517.036P值0.274<0.0010.547<0.0010.662<0.001组别胫后动脉PSV(cm/s)治疗前治疗后腓动脉动脉狭窄率(%)治疗前治疗后腓动脉PSV(cm/s)治疗前治疗后对照组61.53±17.4450.45±19.15*63.12±4.5156.47±3.21*60.13±14.7451.56±12.38*观察组60.42±18.7641.32±20.86*64.39±2.0150.04±1.75*59.72±15.6340.71±14.61*t值0.7393.3961.85415.1451.19311.872P值0.4690.0020.079<0.0010.248<0.001
*P值<0.05 与治疗前比较(配对t检验)
2.3 两组依从性及不良反应 治疗中及治疗后两组患者均无失访或脱落,且未见严重不良反应发生。
3 讨 论
国内外研究报道,DM病程5年、>5~10年和10年以上合并下肢血管病变发病了也逐步升高,发病率为22.6%、23%和66.7%;病因多为血管狭窄或闭塞及动脉硬化[3]。 研究表明,DM发生下肢动脉病变,可能与以下因素有直接或间接关系:①动脉粥样硬化是DM下肢血管狭窄甚至闭塞的主要致病因素。而高糖和高胰岛素血症致使动脉内膜对脂质尤其是胆固醇摄取增加,同时妨碍动脉壁对过多胆固醇的排泄,致使动脉内膜斑块形成、内膜增厚及中层平滑肌增殖,导致动脉狭窄或闭塞,引发下肢缺氧缺血。②脂代谢异常,DM患者可导致脂类特别是低密度脂蛋白胆固醇聚集在血管内膜,引发内皮损伤,并释放炎性因子,引起血小板聚集,局部形成血栓,进一步加重动脉粥样硬化。③内皮细胞和凝血机制异常,血管内皮功能紊乱,血管性血友病因子(von willebrand factor,vWF)增多,前列环素2(prostacyclin2,PGI2)降低,纤维蛋白溶解活力降低,促进了血栓的形成;内皮细胞损伤后可导致缩血管物质内皮素增多,而舒血管物质一氧化氮(nitric oxide,NO)表达降低[4],同时抑制NO自内皮扩散致平滑肌,下调NO受体,引起平滑肌痉挛,血管收缩,加重血管狭窄。④微血管病变,DM中微血管病变与动脉粥样硬化的关系亦属推测,研究发现,冠状动脉壁增厚及心肌纤维化可能与DM微血管病变有关;其病理变化主要是毛细血管基底膜增厚,导致血管管径缩小,弹力和收缩力降低,从而导致血流不畅,血黏度增高,微血栓形成。微血管病变最终导致下肢微血管舒张受限,血流速度缓慢,血黏度增高,血栓形成,甚至官腔闭塞,发生严重不良后果[5]。因此,对DM下肢血管病变的及早筛查及诊治尤为重要。目前,根据患者病情及血管病变严重程度[6],可选择药物、介入及手术等方式进行治疗[7]。但介入术后有再发血栓形成及狭窄的风险;而手术创伤大、并发症多;故药物治疗对于轻症、不能耐受手术及介入治疗的患者更加重要。
大量随机对照试验、人类前列环素受体(human prostacyclin receptor,hIP)变异研究和小鼠IP受体敲除研究的证据表明,前列环素可能对动脉粥样硬化血栓形成风险有保护作用[8],增加前列环素含量可改善血管内皮细胞功能和凝血机制,增加血管血流量[9]。贝前列素钠是前列环素类似物口服制剂,诸多研究表明,血小板和血管平滑肌上存在前列环素受体,贝前列素钠通过与其结合,使腺苷酶激活,增加血管内皮环磷酸腺苷(cyclic adenosine monophosphate,cAMP)的含量,抑制血栓素A2生成,发挥抗血小板聚集作用,同时抑制Ca2+内流引起的血管收缩;达到抗栓和舒血管作用,进而改善慢性动脉狭窄及闭塞性引起的溃疡、间歇性跛行、疼痛和冷感等症状。另有研究发现贝前列素钠可显著减低细胞间黏附因子及炎性因子[10] ,抑制动脉内膜增厚,减轻闭塞性动脉硬化症。
胰激肽原酶肠溶片有扩张血管改善微循环作用;其通过激活纤溶酶及磷脂酶A2,防止血小板聚集形成血栓,发挥降低血黏度等作用,主要用于微循环障碍性疾病[11];胰激肽原酶肠溶片还可激活纤溶系统,提高胶原水解酶活性,减轻血液黏度,预防微血栓形成等[12]。胰激肽原酶肠溶片还可通过释放激肽酶降解激肽原,提高具有舒张血管作用的激肽含量,发挥扩血管改善微循环,减轻大血管后循环阻力,进一步增加病变血管血流量。激肽水平升高可一定程度恢复毛细血管功能,并且可更强的增加红细胞变形能力,纠正组织缺氧的情况,达到治疗目的[13]。
国内大量研究发现,贝前列素钠显著改善患者6 min步行距离及最大无痛行走距离,改善ABI[14],其机制可能是减低血中高敏C反应蛋白,升高NO舒张血管,从而改善下肢血循环,增加下肢血流[15]。研究报道胰激肽原酶肠溶片可改善全血黏度及微循环。国内研究发现胰激肽原酶肠溶片联合前列地尔,能更有效改善糖尿病下肢血管血流变,改善微循环[16]。而关于胰激肽原酶肠溶片联合贝前列素钠对临床症状及 ABI、PSV、管径狭窄率影响尚未见报道。
本研究发现,治疗后,两组最大行走距离、无痛行走距离、ABI均明显增加,而PSV及动脉狭窄率均明显下降,提示无论是从临床表现,还是从客观指标多普勒、彩色超声指标对比结果,较治疗前均明显缓解;且治疗后,观察组较对照组最大行走距离、无痛行走距离明显延长,ABI有显著改善;胫前动脉,胫后动脉,腓动脉的PSV显著减慢,而血管狭窄率均明显下降。因此,DM膝以下动脉狭窄的患者通过联合口服贝前列腺素钠及胰激肽原酶肠溶片能够更加显著改善临床症状及血管彩色超声相关指标,延缓疾病进展,减少截肢风险。
由于本研究的样本量偏少,且入选患者为膝以下动脉狭窄,所选血管均为轻度狭窄,对于DM合并重度下肢股动脉狭窄,甚至闭塞仍需长期大样本多中心、随机、双盲对照研究,以便获取更可靠确切临床结果,以指导临床工作。
[1] Wilcox T,Newman JD,Maldonado TS,et al. Peripheral vascular disease risk in diabetic individuals without coronary heart disease[J]. Atherosclerosis,2018,275:419-425.
[2] Hazari A,Maiya A,Agouris I,et al. Prediction of peak plantar pressure for diabetic foot:the regressional model[J]. Foot(Edinb),2019,40:87-91.
[3] Charbel FT,Amin-Hanjani S. Hemodynamics in symptomatic atherosclerotic vertebrobasilar occlusive disease-reply[J]. JAMA Neurol,2016,73(6):759-760.
[4] Mokhtar SS,Vanhoutte PM,Leung SW,et al. Endothelium dependent hyperpolarization-type relaxation compensates for attenuated nitric oxide-mediated responses in subcutaneous arteries of diabetic patients[J]. Nitric Oxide,2016,53:35-44.
[5] 陈一文,秦明照.糖尿病下肢动脉疾病与微血管病变的相关性[J].中华老年心脑血管病杂志,2016,18(5):551-552.
[6] Patel MR,Conte MS,Cutlip DE,et al. Evaluation and treatment of patients with lower extremity peripheral artery disease:consensus definitions from Peripheral Academic Research Consortium(PARC)[J]. J Am Coll Cardiol,2015,65(9):931-941.
[7] 沈晨阳,李伟浩.《美国血管外科学会无症状性和间歇性跛行下肢动脉硬化闭塞症诊治指南》解读[J].浙江医学,2016,38(5):311-312.
[8] Stitham J,Hwa J. Prostacyclin,atherothrombosis and diabetes mellitus:physiologic and clinical considerations[J]. Curr Mol Med,2016,16(4):328-342.
[9] 寇威,刘蔚,孟庆江,等.中药泡足联合前列地尔治疗糖尿病下肢动脉硬化闭塞症临床观察[J].光明中医,2019,34(21):3329-3330.
[10] Qin L,Qin W,Wang J,et al. Combined treatment of diabetic nephropathy with alprostadil and calcium dobesilate[J]. Exp Ther Med,2017,14(5): 5012-5016.
[11] Jin YP,Su XF,Li HQ,et al. The therapeutic effect of pancreatic kininogenase on treatment of diabetic peripheral neuropathy in patients with type 2 diabetes[J]. Exp Clin Endocrinol Diabetes,2016,124(10):618-621.
[12] 刘宝萍.丹参注射液配合口服胰激肽原酶肠溶片治疗糖尿病微血管病变的临床疗效观察[J].继续医学教育,2017,31(4):160-162.
[13] 康和平.加味补阳还五汤联合西药治疗2型糖尿病(T2DM)下肢动脉硬化闭塞症的临床疗效分析[J].双足与保健,2019,28(3):120-121.
[14] 胡继新.贝前列素钠治疗老年2型糖尿病合并下肢血管病变的临床效果观察[J].河南医学研究,2017,26(9):1671-1672.
[15] Hellmann M,Roustit M,Gaillard-Bigot F,et al. Cutaneous iontophoresis of treprostinil,a prostacyclin analog, increases microvascular blood flux in diabetic malleolus area[J]. Eur J Pharmacol, 2015,758:123-128.
[16] 李犀文,刘德荣.前列地尔注射液联合胰激肽原酶对2型糖尿病患者血液流变学影响研究[J].海峡药学,2013,25(6):160-161.