颅内动脉瘤是脑动脉内腔异常增大导致动脉壁形成瘤状突出,与先天性缺陷、感染、创伤或动脉硬化等因素有关。颅内动脉瘤破裂是临床上蛛网膜下腔出血(subarachnoid haemorrhge,SAH)的主要病因之一,具有高致死率和病残率。 对于破裂出血的动脉瘤患者,目前研究表明都应积极手术治疗[1-2]。开颅动脉瘤夹闭术和血管内动脉瘤栓塞术是治疗动脉瘤的重要方式[2-4]。然而血管内治疗不适于一些特殊患者(如碘造影剂过敏、颅内血管迂曲导管无法到位等),因此动脉瘤夹闭术仍是治疗颅内破裂动脉瘤的重要手段。其中老年患者是需特殊关注人群[5-6],但目前国内对老年颅内破裂动脉瘤患者行开颅夹闭术预后质量不一,结论不尽相同,同时虚弱症对于老年颅内破裂动脉瘤患者手术治疗研究较少,值得关注[4,7]。本研究通过回顾行开颅手术的颅内破裂动脉瘤老年患者的数据,对影响预后的相关因素进行分析。
1 资料与方法
1.1 一般资料 回顾性分析2013年1月—2017年12月于首都医科大学附属北京潞河医院神经外科行开颅动脉瘤夹闭术治疗的颅内破裂动脉瘤老年患者74例的病历。年龄60~81岁,平均(65.5±4.9)岁,其中男性31例,女性43例。合并高血压56例,冠心病15例。患者入院Hunt-Hess分级Ⅰ~Ⅱ级38例,Ⅲ~Ⅳ级36例。虚弱症患者24例,其中虚弱症定义为贫血(男性血红蛋白<130 g/L或血细胞比容<39%,女性<120 g/L或血细胞比容<36%)、低白蛋白血症(白蛋白<34 g/L)或体重指数(body mass index,BMI)<18.5[4]。所有患者术前均行头颅电子计算机断层扫描(computed tomography,CT)或磁共振成像(magnetic resonance imaging,MRI)及数字减影血管造影(digital subtraction angiography,DSA)检查,经DSA或CT确诊颅内动脉瘤位置、形态及大小。前循环动脉瘤63例,后循环动脉11例;多发动脉瘤21例;动脉瘤直径≥7 mm 25例。早期手术(破裂出血后≤3 d)44例,延期手术(破裂出血后>3 d)30例;手术时间为1.5~15.5 h,平均(5.2±2.6)h。根据电话和门诊随访方式,了解一般精神状态、语言、肢体运动情况、生活自理能力等,同时观察是否有脑积水或脑积水是否加重。对患者的围手术期并发症及术后6个月时功能状态进行观察和评估。其中出现脑缺血卒中患者28例,严重非神经系统并发症(术后心肌梗死、肺感染、Clavien-Dindo分级Ⅲ~Ⅳ级)21例,不同程度脑积水患者15例,癫痫10例,颅内感染1例。按照改良Rankin评分(Modified Rankin Scale,mRS)标准[8]将术后6个月结局分为预后较好组(mRS 0~2分)45例和预后较差组(mRS 3~6分)29例。其中死亡14例。
本研究经医院伦理委员会批准。
1.2 纳入标准及排除标准 纳入标准:①年龄≥60岁;②CT或MRI提示自发性蛛网膜下腔出血患者;③所有患者经脑血管造影或CT确诊;④手术方式为开颅显微动脉瘤夹闭术;⑤术中证实所有患者SAH均为单一动脉瘤破裂所致。排除标准:①非动脉瘤性蛛网膜下腔出血的患者;②血管内治疗的患者;③资料不全患者(如术中无动脉瘤直径记载的病例);④术前死亡或存在手术禁忌的患者[9];⑤患者家属放弃治疗;⑥失访患者。
1.3 手术方法 所有患者在外科显微镜下完成责任动脉瘤夹闭术,大多数采取翼点入路,从优势供血动脉侧开颅。显微剪刀剪开蛛网膜后仔细分离,依次打开侧裂池、颈动脉池、视交叉池等,清除蛛网膜下腔出血、释放脑脊液后寻找动脉瘤,分离动脉瘤时不强求瘤顶完全暴露,在保证暴露空间足够放置瘤夹的情况下,尽量减少穿支血管的损伤。缓慢释放合适的瘤夹,术中可联合神经内镜观察动脉瘤夹闭情况,或用吲哚菁绿在显微镜下显影来检测动脉瘤是否完全夹闭,必要时再次调整瘤夹或加用瘤夹塑性。术中尽量避免动脉阻断(术中动脉瘤破裂除外)。
1.4 观察指标 分析比较可能影响手术预后的指标,如性别、年龄、高血压、糖尿病、冠心病、吸烟史、饮酒史、抗血小板或抗凝史、脑出血史。Hunt-Hess分级、虚弱症、手术时机、动脉瘤部位(前或后循环)、多发动脉瘤、动脉瘤最大直径、手术时间、神经系统相关症状(脑缺血卒中、脑积水、再出血、颅内感染、癫痫)及非神经系统相关症状。以术后6个月mRS评分作为临床预后评估指标。
1.5 统计学方法 应用SPSS 19.0统计学软件分析数据。计量资料资料比较采用独立样本的t检验和秩和检验;计数资料比较采用χ2检验或Fishers精确概率法;采用多因素Logistic回归分析确定影响老年患者颅内破裂动脉瘤开颅手术预后的独立危险因素。P<0.05为差异有统计学意义。
2 结 果
2.1 2组可能影响预后的变量因素比较 2组在性别、高血压、糖尿病、冠心病、吸烟史、饮酒史、抗血小板或抗凝史、脑出血病史、动脉瘤部位(前或后循环)、多发动脉瘤、手术时间、再出血、癫痫、非神经系统严重症状差异无统计学意义(P>0.05)。预后较好组在年龄≥70岁、Hunt-Hess分级Ⅲ~Ⅴ级、合并虚弱症、手术时机>3 d、动脉瘤直径≥7 mm、发生脑缺血卒中和脑积水比例比预后较差组更低,差异有统计学意义(P<0.05或P<0.01)。见表1。
表1 2组可能影响预后的变量因素比较
Table 1 Comparison of the variables that may affect the prognosis between two groups (例数,%)
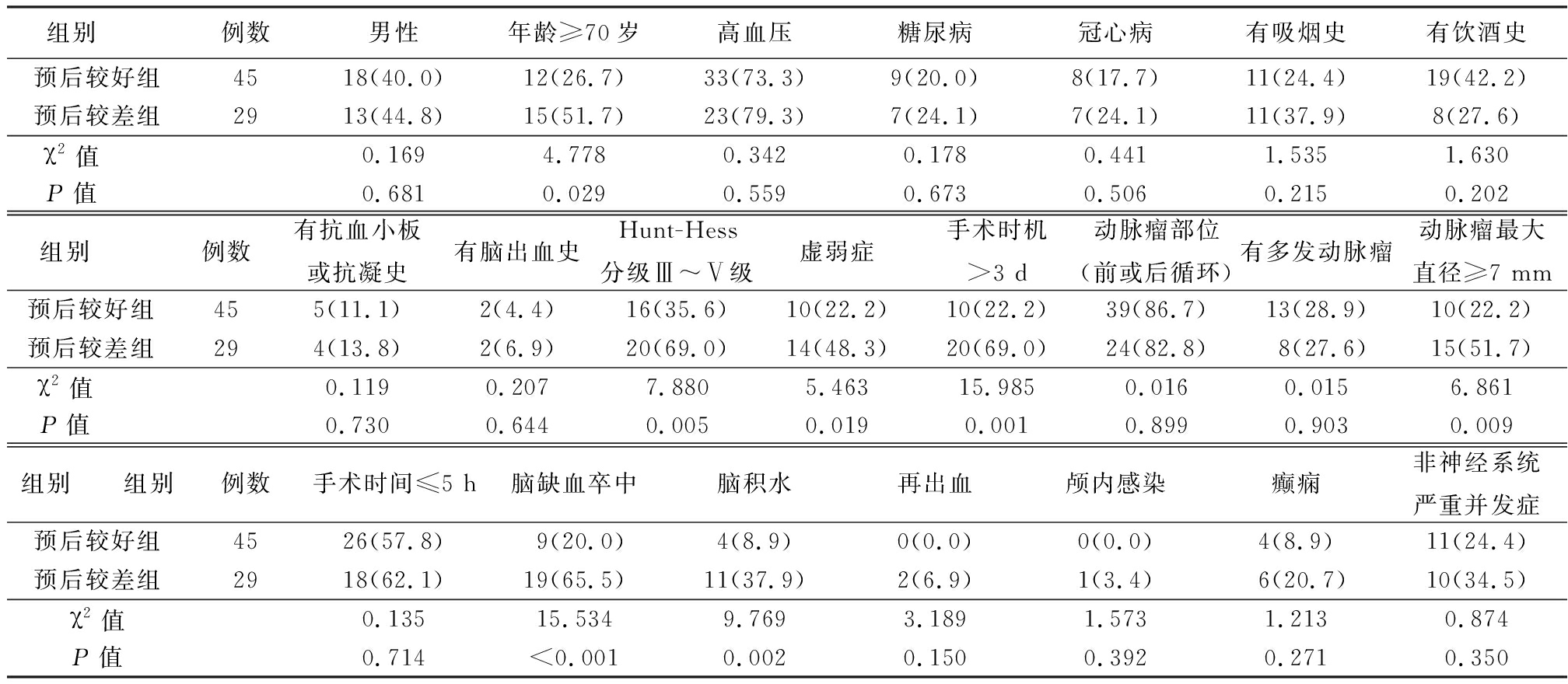
组别 例数男性年龄≥70岁高血压糖尿病冠心病有吸烟史有饮酒史预后较好组4518(40.0)12(26.7)33(73.3)9(20.0)8(17.7)11(24.4)19(42.2)预后较差组 2913(44.8)15(51.7)23(79.3)7(24.1)7(24.1)11(37.9)8(27.6)χ2值 0.1694.7780.3420.1780.4411.5351.630P值 0.6810.0290.5590.6730.5060.2150.202组别 例数有抗血小板或抗凝史有脑出血史Hunt-Hess分级Ⅲ~Ⅴ级虚弱症手术时机>3 d动脉瘤部位(前或后循环)有多发动脉瘤动脉瘤最大直径≥7 mm预后较好组455(11.1)2(4.4)16(35.6)10(22.2)10(22.2)39(86.7)13(28.9)10(22.2)预后较差组 294(13.8)2(6.9)20(69.0)14(48.3)20(69.0)24(82.8)8(27.6)15(51.7)χ2值 0.1190.2077.8805.46315.9850.0160.0156.861P值 0.7300.6440.0050.0190.0010.8990.9030.009组别 组别例数手术时间≤5 h脑缺血卒中脑积水再出血颅内感染癫痫非神经系统严重并发症预后较好组4526(57.8)9(20.0)4(8.9)0(0.0)0(0.0)4(8.9)11(24.4)预后较差组 2918(62.1)19(65.5)11(37.9)2(6.9)1(3.4)6(20.7)10(34.5)χ2值0.13515.5349.7693.1891.5731.2130.874P值0.714<0.0010.0020.1500.3920.2710.350
2.2 影响老年颅内破裂动脉瘤开颅手术预后的Logistic回归分析 以老年患者颅内破裂动脉瘤开颅手术预后(较好预后=0,较差预后=1)作为因变量,以年龄(60~69岁=0,≥70岁=1)、虚弱症(无=0,有=1)、Hunt-Hess分级(Ⅰ~Ⅱ级=0,Ⅲ~Ⅴ级=1)、手术时机(手术时机≤3 d=0,手术时机>3 d=1)、动脉瘤直径(最大直径<7 mm=0,最大直径≥7 mm=1)、脑缺血卒中(无=0,有=1)、脑积水(无=0,有=1)为自变量进行多因素Logistic回归分析结果显示,Hunt-Hess分级、虚弱症、手术时机及脑缺血卒中对预后有影响,差异有统计学意义(P<0.05),而年龄、动脉瘤直径及脑积水对结果无影响,差异无统计学意义(P>0.05)。见表2。
表2 影响老年患者颅内破裂动脉瘤手术预后的多因素Logistic回归分析
Table 2 Multivariate Logistic regression analysis of surgical prognosis in the elderly patients with ruptured intracranial aneurysms
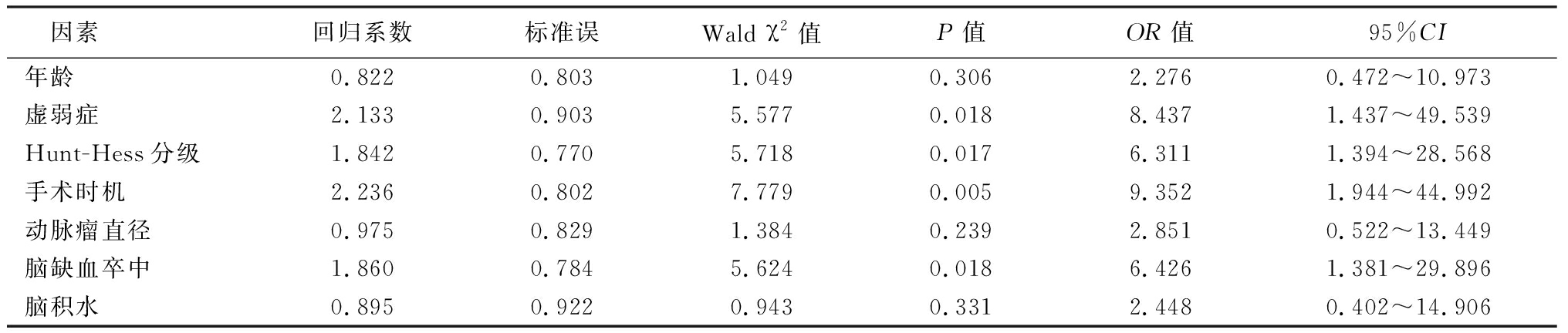
因素回归系数标准误Wald χ2值P值OR值95%CI年龄0.8220.8031.0490.3062.2760.472~10.973虚弱症2.1330.9035.5770.0188.4371.437~49.539Hunt-Hess分级1.8420.7705.7180.0176.3111.394~28.568手术时机2.2360.8027.7790.0059.3521.944~44.992动脉瘤直径0.9750.8291.3840.2392.8510.522~13.449脑缺血卒中1.8600.7845.6240.0186.4261.381~29.896脑积水0.8950.9220.9430.3312.4480.402~14.906
3 讨 论
随着我国老龄化社会的进展,老年动脉瘤破裂患者不断增加,具有破裂风险高、预后差的特点,传统观点不主张积极手术治疗,认为即便手术治疗仍效果不佳。随着手术技术的快速发展,尤其是颅脑微创外科技术的发展,老年破裂颅内动脉瘤的开颅夹闭手术的治疗效果得以认可。老年动脉瘤患者具有以下特点:①发病时病情多较严重,Hunt-Hess分级较高;②多合并基础疾病,例如高血压、糖尿病等,同时全身机能减退,易出现内环境的紊乱,手术耐受性差;③自身血管条件差,常伴有脑血管狭窄、载瘤动脉迂曲、痉挛等;④血管调节能力下降,多合并腔隙性脑梗塞及脑动脉硬化,易出现血管痉挛,同时脑组织对于缺血缺氧敏感,导致严重后果[9-10]。因此,影响老年患者人群破裂动脉瘤开颅手术治疗的相关因素需特殊关注。对老年破裂动脉瘤患者开颅手术预后的风险因素进行评估,可以帮助筛选高风险人群,同时指导临床治疗,改善患者预后。
3.1 Hunt-Hess分级 术前对颅内破裂动脉瘤患者的评估至关重要,其中Hunt-Hess分级是既往判断病情轻重及预后常用指标,一般分级越高,预后越差[9-10],可能与脑血管痉挛及延迟缺血性神经功能障碍有关。同时老年患者因脑组织相对脆弱,且弹性下降特点,因此手术难度及风险更大[11]。而高级别患者手术还是保守治疗仍存在争议,早期研究倾向于保守治疗,而近些年也有研究主张尽早手术治疗。同时研究中报道的手术治疗良好预后率不一,例如Zhao等[11]报道为46%,Steklacova等[12]报道为40.3%,而2016年我国多中心登记研究结果为50.6%[13]。Yue等[4]研究中Hunt-Hess分级同样是老年破裂动脉瘤患者手术治疗的重要影响因素。随着Hunt-Hess分级的逐渐增高,易合并脑血管痉挛和颅内或脑室积血,其中脑血管痉挛可导致缺血性及延迟缺血性神经功能障碍,而颅内及脑室积血会引发颅内占位效应及脑脊液循环不畅、脑积水等,均有可能影响手术的预后。因此,对于Hunt-Hess分级较高的患者,更要进行病情的全面分析,以决定最佳的手术时机和治疗方案。
3.2 虚弱症 虚弱症的研究在国际老年医学等领域十分活跃,但我国这方面研究尚处于起步阶段,研究较少。虚弱症的患者生理储备功能减退,Darvall等[14]的研究提示虚弱症可见于19~62%的患者,可明显增加手术并发症及死亡风险,影响远期预后。既往有研究报道,即使外科手术总体死亡率有所较低,但在急诊和高风险手术人群中,合并虚弱症患者较无虚弱症患者死亡率更高,Joseph等[15]报道的分别是8.5%和0%,且急诊手术平均住院天数从6.3 d可增加至10.0 d,同时发生严重并发症如肺炎、败血症或再次手术的风险为3.87倍;因此老年患者虚弱症的衡量对于手术风险的评估至关重要。本研究采用Yue等[4]标准,纳入血红蛋白、白蛋白及BMI等指标作为虚弱症的观察项目,且研究中32.4%患者合并有虚弱症,稍低于Yue等[4]研究的43.4%,但仍提示老年SAH患者虚弱症并不少见。本研究结果显示虚弱症是影响预后的相关因素,可能与生理储备低的人更容易受到外界创伤或刺激的影响有关,如SAH或开颅手术,导致更多的术后并发症和较慢的术后恢复。因此对于合并虚弱症的SAH老年患者,在外科或者ICU病房期间,临床医生应加强各方面的急性护理,对术前潜在风险进行及时干预及术后特殊康复治疗,以减少上述相关不良并发症的发生,改善远期预后。
3.3 手术时机 动脉瘤破裂后手术时机的选择十分重要,尤其是对于老年患者这一特殊人群。早期观点倾向于延期手术与早期手术效果并无差异。这些观点认为,在颅内动脉瘤破裂早期因颅内压增高,水肿等,可导致术中脑牵拉暴露动脉瘤困难,同时老年患者自身耐受能力差,常合并一些慢性疾病,因此手术难度大并风险高,应于患者病情平稳后再行手术治疗。不过随着手术技巧和护理工作的改善,有研究提示早期手术较延期手术可取得更好的预后[16],对于状况良好的患者,早期手术较延期手术可降低入院时的不良结局和病死率,即便对于状况不良患者,早期手术也可降低入院期间不良结局发生率,尤其对于年龄≥50岁的患者,早期手术治疗在降低患者病死率方面要优于延期手术[17]。早期手术治疗可有效清除颅内或脑池积血,降低血管痉挛发生率,并降低再出血风险,改善预后。本研究结果显示对老年SAH患者行早期手术有助于取得良好预后,与既往研究结果一致。因此对于高龄患者,虽然有应激能力减退和手术加重脑损伤的风险,仍倾向于早期手术治疗,以对动脉瘤进行及早开颅夹闭,并术后扩血管、扩容、升高血压积极治疗增加脑组织灌注,从而改善预后。手术技术的进步和护理工作的精细化,也降低了如脑组织高反应性和耐受性差等早期手术潜在风险。
3.4 并发症 并发症是决定破裂动脉瘤患者预后的重要因素,预防围手术期并发症的发生可改善患者长期预后[18]。对老年患者的研究中术后并发症发生20%~50%之间[18-19]。参照既往研究并发症分类,本研究将并发症大致分为神经系统并发症和非神经系统并发症。文献报道破裂动脉瘤患者高致残率主要为再出血及脑缺血卒中,随着手术技术的成熟,再出血风险明显下降,但术后缺血性卒中仍是影响远期预后重要原因[19]。研究显示BEHAVIOR评分系统可将临床特征和影像学资料等多个因素进行综合评分,预测SAH后发生脑缺血事件的风险,并将高龄作为预测脑缺血事件发生的一项重要因素[20]。本研究有37.8%的患者出现脑缺血脑卒中,介于既往文献数据中间[18-20]。脑缺血卒中的发生与老年人血管调节能力下降、脑血管易痉挛、脑组织对缺血缺氧敏感及术中脑组织牵拉等关系密切。本研究同时关注了非神经系统并发症,有研究表明分别有38%和11%的患者术后出现肺部感染和心脏并发症,16%远期死于肺部感染,5.2%死于心力衰竭和肾脏功能衰竭。虽然本研究提示非神经系统并发症对短期预后无影响,但考虑到有28.3%的患者出现了该类并发症,因此高龄患者仍需特殊关注,尽可能注意预防和及时治疗,减少不必要的创伤。
本研究纳入了虚弱症及非神经系统相关并发症进行评估,但因回顾性研究,存在一定局限性,如病例数少、单中心研究等,对一些重要的神经相关并发症如再出血、脑积水等可能观察时间相对有限,需进一步扩大样本量及增加随访时间。
总之,影响老年患者颅内破裂动脉瘤开颅手术的预后因素较为复杂。对老年高分级动脉瘤患者需综合全面分析病情制定手术方案,尽早手术清除血肿、术中减少脑组织牵拉及术后常规抗血管痉挛治疗,以减少缺血性卒中发生,有助于进一步提高该特殊人群动脉瘤的手术治疗效果。
[1] Hemphill JC,Greenberg SM,Anderson CS,et al. Guidelines for the management of spontaneous intracerebral hemorrhage:aguideline for healthcare professionals from the American Heart Association/American Stroke Association[J]. Stroke,2015,46(7):2032-2060.
[2] Lindgren A,Vergouwen MD,van der Schaaf I,et al. Endovascular coiling versus neurosurgical clipping for people with aneurysmal subarachnoid haemorrhage[J]. Cochrane Database Syst Rev,2018,8(8):D3085.
[3] Bekelis K,Gottlieb DJ,Su Y,et al. Medicare expenditures for elderly patients undergoing surgical clipping or endovascular intervention for subarachnoid hemorrhage[J]. J Neurosurg,2017,126(3):805-810.
[4] Yue Q,Liu Y,Leng B,et al. A prognostic model for early post-treatment outcome of elderly patients with aneurysmal subarachnoid hemorrhage[J]. World Neurosurg,2016,95:253-261.
[5] Meneghelli P,Cozzi F,Hasanbelliu A,et al. Surgical management of aneurysmal hematomas:prognostic factors and outcome[J]. Acta Neurochir Suppl,2016,123:3-11.
[6] Li J,Su L,Ma J,et al. Endovascular coiling versus microsurgical clipping for patients with ruptured very small intracranial aneurysms:management strategies and clinical outcomes of 162 cases[J]. World Neurosurg,2017,99:763-769.
[7] 苘辉斌,毕伟平.60岁以上前循环颅内动脉瘤破裂患者的手术疗效[J].中国实用神经疾病杂志,2015,18(2):66-67.
[8] Rinaldo L,Rabinstein AA,Lanzino G. Elderly age associated with poor functional outcome after rupture of anterior communicating artery aneurysms[J]. J Clin Neurosci,2016,34:108-111.
[9] 洪景芳,王守森,刘峥,等.老年人颅内破裂动脉瘤的临床特点和早期血管内介入治疗[J].中国微侵袭神经外科杂志,2014(12):543-545.
[10] 马骏,尹浩,刘窗溪,等.老年人颅内动脉瘤破裂的早期显微外科手术治疗[J].中国现代医学杂志,2014,24(16):61-63.
[11] Zhao B,Cao Y,Tan X,et al. Complications and outcomes after early surgical treatment for poor-grade ruptured intracranial aneurysms:a multicenter retrospective cohort[J]. Int J Surg,2015,23(Pt A):57-61.
[12] Steklacova A,Bradac O,Charvat F,et al. “Clip first” policy in management of intracranial MCA aneurysms:single-centre experience with a systematic review of literature[J]. Acta Neurochir(Wien),2016,158(3):533-546.
[13] 李则群,郑匡,赵兵,等.颅内高分级动脉瘤性蛛网膜下腔出血外科干预的随访研究[J].中华神经外科杂志,2016,32(2):136-139.
[14] Darvall JN,Gregorevic K J,Story D A,et al. Frailty indexes in perioperative and critical care:a systematic review[J]. Arch Gerontol Geriatr,2018,79:88-96.
[15] Joseph B,Zangbar B,Pandit V,et al. Emergency general surgery in the elderly:too old or too frail?[J]. J Am Coll Surg,2016,222(5):805-813.
[16] Yao Z,Hu X,Ma L,et al. Timing of surgery for aneurysmal subarachnoid hemorrhage:a systematic review and meta-analysis[J]. Int J Surg,2017,48:266-274.
[17] Zhao C,Wei Y. Surgical timing for aneurysmal subarachnoid hemorrhage:a meta-analysis and systematic review[J]. Turk Neurosurg,2017,27(4):489-499.
[18] Shimamura N,Naraoka M,Katagai T,et al. Analysis of factors that influence long-term independent living for elderly subarachnoid hemorrhage patients[J]. World Neurosurg,2016,90:504-510.
[19] Ohkuma H,Shimamura N,Naraoka M,et al. Aneurysmal Subarachnoid Hemorrhage in the Elderly over Age 75:A Systematic Review[J]. Neurol Med Chir(Tokyo),2017,57(11):575-583.
[20] Jabbarli R,Reinhard M,Roelz R,et al. Early identification of individuals at high risk for cerebral infarction after aneurysmal subarachnoid hemorrhage:the BEHAVIOR score[J]. J Cereb Blood Flow Metab,2015,35(10):1587-1592.