新生儿缺血缺氧性脑病是由于围产期母体或胎儿发生血液循环障碍或气体交换障碍等原因造成的新生儿脑病。新生儿缺血缺氧性脑病多以脑水肿、神经元损伤坏死等为主要病理改变,能够引起患儿脑瘫、癫痫、智力发育障碍甚至死亡。目前,治疗新生儿缺血缺氧性脑病主要以营养神经元、改善受损神经元代谢、控制惊厥等为主[1]。神经生长因子(nerve growth factor,NGF)是促进神经元发育、保持神经元功能的蛋白质,参与神经元的修复[2]。纳洛酮是一种吗啡受体拮抗剂,能够刺激呼吸功能,改善血氧水平[3]。根据相关研究,NGF和纳洛酮对新生儿缺血缺氧性脑病具有一定的治疗作用,但具体机制尚不清楚[4]。程序性细胞死亡分子5(programmed cell death 5,PDCD5)是一种促细胞凋亡因子,有研究显示PDCD5参与新生儿缺血缺氧性脑病的发病过程[5]。8-羟基脱氧鸟苷(8-hydroxy-2 deoxyguanosine,8-OHDG)是评估机体氧化损伤及氧化应激的重要指标,在新生儿缺血缺氧性脑病患儿中呈较高表达[6]。为探索NGF联合纳洛酮治疗新生儿缺血缺氧性脑病的效果,现对部分患儿进行临床对比研究,报道如下。
1 资料与方法
1.1 一般资料 选取2015年12月—2017年4月于我院诊治的新生儿缺血缺氧性脑病患儿90例,按随机数字表法分为观察组和对照组各45例。两组性别、日龄、出生时体质量、胎龄、新生儿评分差异均无统计学意义(P>0.05),见表1。
所有患儿家长均签署知情同意书。本研究经医院伦理委员会批准。
表1 两组一般资料比较
Table 1 Comparison of general data between two groups (n=45)
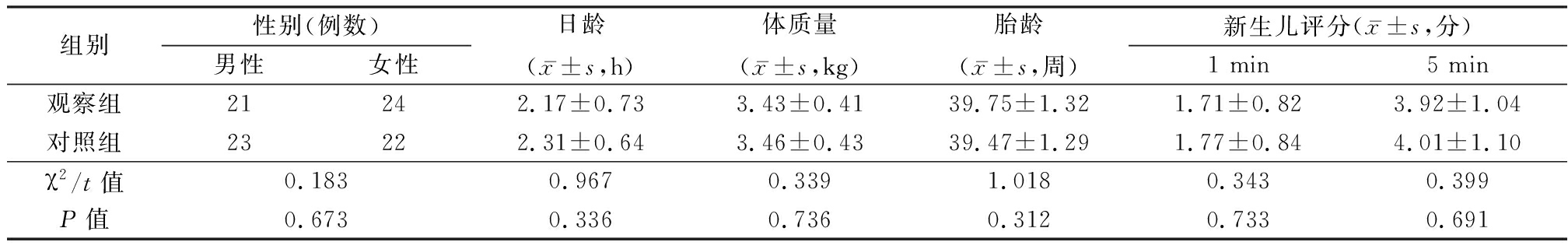
组别性别(例数)男性女性日龄(x-±s,h)体质量(x-±s,kg)胎龄(x-±s,周)新生儿评分(x-±s,分)1 min5 min观察组21242.17±0.733.43±0.4139.75±1.321.71±0.823.92±1.04对照组23222.31±0.643.46±0.4339.47±1.291.77±0.844.01±1.10χ2/t值0.1830.9670.3391.0180.3430.399P值0.6730.3360.7360.3120.7330.691
1.2 纳入标准及排除标准 纳入标准:①患儿均符合英国缺血缺氧性脑病临床指南中新生儿缺血缺氧性脑病的诊断标准[7];②患儿心、肺、肾等重要脏器发育良好。排除标准:①患儿合并颅骨畸形、先天性脑发育不良等神经系统先天性疾病;②患儿为早产儿;③患儿心、肺发育不良。
1.3 方法 两组均接收吸氧、降颅压、抗惊厥、维持血糖血压、使用脑代谢激活剂等基础治疗。对照组在基础治疗上采用NGF联合纳洛酮进行治疗,出生后第2日开始肌内注射鼠神经生长因子(丽珠集团丽珠制药厂,S20100005),1次/d,30 μg/次,连续给药7 d;出生后即日开始静脉滴注盐酸纳洛酮注射液(北京华素制药股份有限公司,H20023755),0.05 mg/kg加入50 mL 10%葡萄糖溶液,1次/d,连续给药7 d。观察组在对照组基础上联合促红细胞生成素(北京四环生物制药有限公司,S20020044)进行治疗,首次采用皮下注射,第2次起改为静脉推注,1次/d,每次200 U/kg,连续给药7 d。
1.4 观察指标
1.4.1 疗效评定 根据患儿治疗后症状体征改变评估患儿治疗效果,显效为患儿相关症状和体征较治疗前基本消失,心率≥100次/min;有效为患儿症状体征较治疗前有所改善,心率≥100次/min;无效为患儿症状体征较治疗前无明显改善,心率<100次/min。总有效率=(显效患儿数+有效患儿数)/患儿总数×100.0%。
1.4.2 一般指标 检测并记录两组意识恢复时间、惊厥消失时间、肌张力恢复时间、反射恢复时间。采用新生儿神经行为测定(neonatal behavioral neurological assessment,NBNA)评分法评估患儿治疗前后神经功能评分[8],共包括新生儿行为能力27项和新生儿神经反射20项,总分40分,37分以下视为异常。分别于治疗前后采集患儿空腹静脉血5 mL,分离血清后采用酶联免疫吸附测定法检测患儿血清PDCD5水平。采用高效液相色谱法检测患儿治疗前后8-OHDG水平。
1.4.3 预后指标 分别采用《贝利婴幼儿发展量表》评估患儿治疗1年后智力发育指数(mental derelopmental index,MDI)及心理运动发育指数(psycho-moter developmental index,PDI)[9]。
1.4.4 不良反应 记录两组治疗期间出现的不良反应发生情况。
1.5 统计学方法 应用SPSS 19.0统计软件分析数据。计量资料比较分别采用两独立样本的t检验和配对t检验;计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 两组治疗效果比较 观察组总有效率为91.1%,对照组为73.3%,观察组治疗有效率高于对照组,差异有统计学意义(P<0.05),见表2。
表2 两组治疗效果比较
Table 2 Comparison of the effects between two groups of treatments (n=45,例数,%)
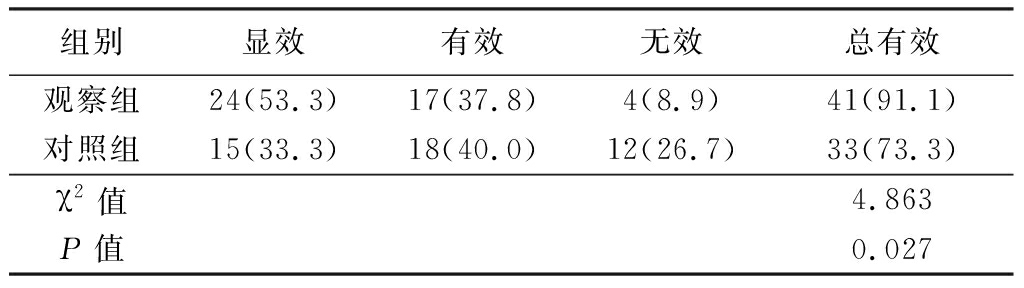
组别显效有效无效总有效观察组24(53.3)17(37.8)4(8.9)41(91.1)对照组15(33.3)18(40.0)12(26.7)33(73.3)χ2值4.863P值0.027
2.2 两组症状消失时间比较 观察组意识恢复时间、惊厥消失时间、肌张力恢复时间、反射恢复时间等均显著短于对照组,差异有统计学意义(P<0.01),见表3。
表3 两组症状消失时间比较
Table 3 Comparison of the disappearance time of symptoms between two groups![]()
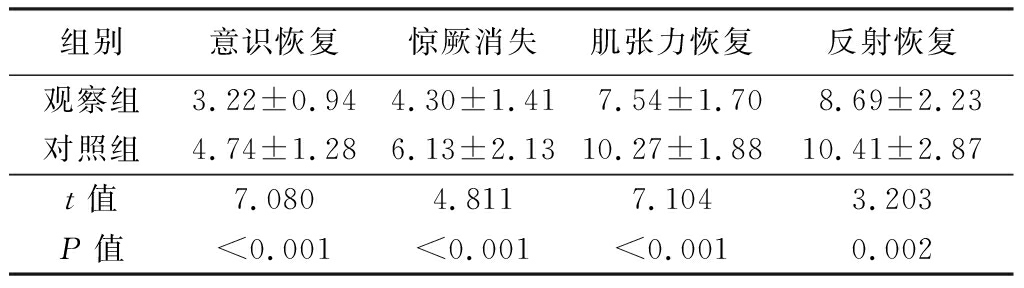
组别意识恢复惊厥消失肌张力恢复反射恢复观察组3.22±0.944.30±1.417.54±1.708.69±2.23对照组4.74±1.286.13±2.1310.27±1.8810.41±2.87t值7.0804.8117.1043.203P值<0.001<0.001<0.0010.002
2.3 两组治疗前后NBNA评分比较 治疗前,两组NBNA评分差异无统计学意义(P>0.05)。治疗后,两组NBNA评分较治疗前均显著升高,差异有统计学意义(P<0.01);观察组NBNA评分显著高于对照组,差异有统计学意义(P<0.01)。见表4。
表4 两组治疗前后NBNA评分比较
Table 4 Comparison of NBNA scores before and after treatment between two groups ![]() 分)
分)
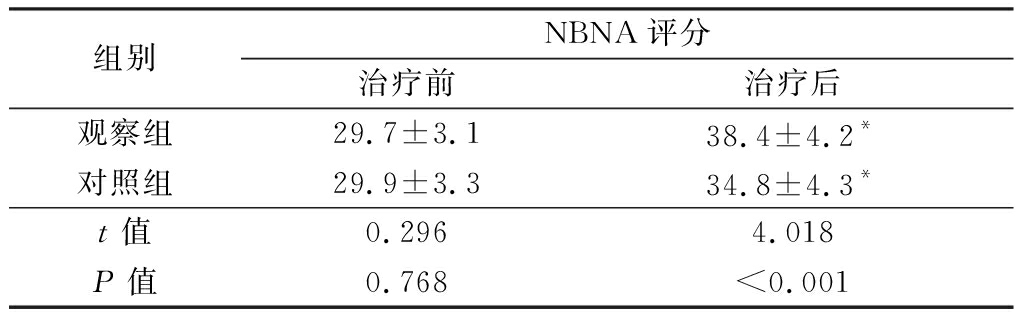
组别NBNA评分治疗前治疗后观察组29.7±3.138.4±4.2*对照组29.9±3.334.8±4.3*t值0.2964.018P值0.768<0.001
*P值<0.01与治疗前比较(配对t检验)
2.4 两组治疗前后PDCD5和8-OHDG 比较 治疗前,两组PDCD5和8-OHDG差异无统计学意义(P>0.05)。治疗后,两组PDCD5和8-OHDG较治疗前均显著降低,差异有统计学意义(P<0.01);观察组PDCD5和8-OHDG均显著低于对照组,差异有统计学意义(P<0.01)。见表5。
表5 两组治疗前后PDCD5和8-OHDG 比较
Table 5 Comparison of PDCD5 and 8-OHDG before and after treatment between two groups![]()
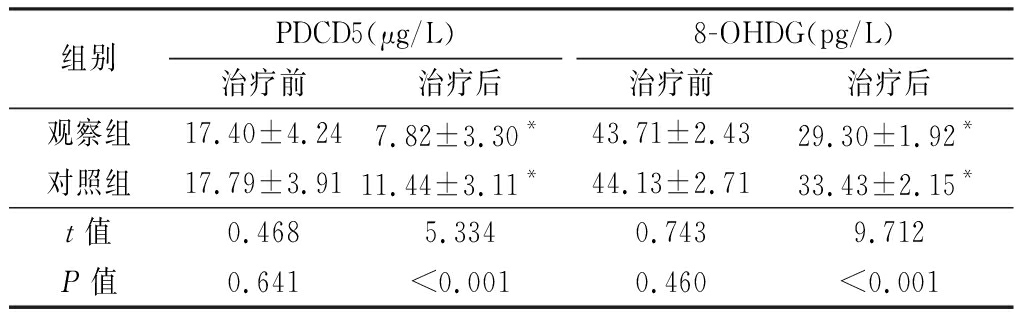
组别PDCD5(μg/L)治疗前治疗后8-OHDG(pg/L)治疗前治疗后观察组17.40±4.247.82±3.30*43.71±2.4329.30±1.92*对照组17.79±3.9111.44±3.11*44.13±2.7133.43±2.15*t值0.4685.3340.7439.712P值0.641<0.0010.460<0.001
*P值<0.01与治疗前比较(配对t检验)
2.5 两组治疗1年后MDI和PDI比较 观察组治疗1年后MDI和PDI均高于对照组,差异有统计学意义(P<0.05),见表6。
表6 两组治疗1年后MDI和PDI比较
Table 6 Comparison of MDI and PDI scores in 1 year after treatment between two groups![]()

组别MDIPDI观察组96.43±8.5197.72±9.15对照组92.26±8.6593.48±8.93t值2.2612.213P值0.0260.029
2.6 不良反应比较 两组治疗期间均未出现严重不良反应。
3 讨 论
新生儿缺血缺氧性脑病目前尚无统一的治疗方案,临床中主要采取保护损伤神经元及控制患儿临床症状等措施[10]。NGF能促进缺血缺氧性脑病患儿神经元损伤后的修复,维持神经元活性[11]。纳洛酮能抑制血管内咖肽的表达,提高交感神经元的兴奋性,促进呼吸运动[12]。促红细胞生成素在新生儿缺血缺氧性脑病的治疗中具有一定作用。本研究观察组采用NGF、纳洛酮联合促红细胞生成素治疗,对照组单独采用NGF联合纳洛酮治疗,结果显示观察组总有效率高于对照组(P<0.05),意识恢复时间、惊厥消失时间、肌张力恢复时间、反射消失时间等均短于对照组(P<0.01),表明采用促红细胞生成素能够改善患儿临床症状,进一步提高缺血缺氧性脑病治疗效果;治疗后观察组NBNA评分显著高于对照组(P<0.01),表明促红细胞生成素能够显著改善患儿临床症状,改善患儿神经功能评分。黄健等[13]研究,采用促红细胞生成素能够明显提高新生儿缺血缺氧性脑病患儿NBNA评分,本研究结果与其相似。
缺血缺氧性脑病患儿由于脑组织缺氧,能够造成神经细胞PDCD5水平明显升高,引起神经细胞凋亡。本研究治疗后两组PDCD5均较治疗前降低,观察组显著低于对照组(P<0.01),表明联合促红细胞生成素治疗能降低PDCD5水平,有助于抑制细胞凋亡,有利于脑缺血后组织恢复。8-OHDG是组织缺血缺氧后发生DNA损伤的重要标志物,缺血缺氧醒脑病患儿由于脑部神经细胞缺氧,造成大量神经细胞死亡引起8-OHDG表达量增多[14]。本研究观察组治疗后8-OHDG水平显著低于对照组(P<0.01),表明联合促红细胞生成素治疗能降低组织DNA损伤,有利于提高治疗效果。其原因可能与促红细胞生成素能提高红细胞水平有关[15],通过促进红细胞增殖,提高组织供氧,对提高预后具有积极作用。
贝利婴幼儿发展量表主要评估婴幼儿心理和运动发育水平[16]。本研究观察组治疗1年后MDI和FDI水平均高于对照组(P<0.05),表明联合促红细胞生成素治疗有助促进患儿心理和运动的发育。
本研究还对患儿治疗期间不良反应进行监测,结果显示两组均未出现严重不良反应,表明两种药物治疗新生儿缺血缺氧性脑病较为安全。但因样本量较小,结果易受地域因素影响,可能具有一定的局限性。
综上所述,NGF、纳洛酮联合促红细胞生成素治疗能够降低PDCD5和8-OHDG表达,减少脑组织损伤,抑制细胞凋亡,改善神经功能,促进患儿心理和运动发育。
[1] 窦金明,韩辉. 新生儿缺血缺氧性脑病的治疗进展[J].中国妇幼保健,2016,31(21):4595-4597.
[2] Wisniewski MS,Carvalho-Silva M,Gomes LM,et al. Intracerebroventricular administration of α-ketoisocaproic acid decreases brain-derived neurotrophic factor and nerve growth factor levels in brain of young rats[J]. Metab Brain Dis,2016,31(2):377-383.
[3] Shi J,Dong B,Mao Y,et al. Review: traumatic brain injury and hyperglycemia,a potentially modifiable risk factor[J]. Oncotarget,2016,7(43):71052-71061.
[4] 鲁旭,姜泓,张渊韬.新生儿缺氧缺血性脑病发病机制研究进展[J].新乡医学院学报,2016,33(10):927-929.
[5] 叶武成,王俊霞,叶鹏,等.单唾液酸神经节苷脂注射液联合常规治疗新生儿缺氧缺血性脑病后的血清指标评估[J].海南医学院学报,2017,23(4):556-559.
[6] 黄玉维,冯金明,韦清华.新生儿缺氧缺血性脑病血清8-OHDG、NSE、sICAM-1、ADM水平变化与病情的关系[J].山东医药,2018,58(18):64-66.
[7] Azzopardi D. Clinical management of the baby with hypoxic ischaemic encephalopathy[J]. Early Hum Dev,2010,86(6):345-350.
[8] 邢珊,刘俐,李改莲,等.NBNA评分在评价早产儿脑发育、脑损伤及预后中的应用[J].中国儿童保健杂志,2016,24(2):191-194.
[9] 任宁,梁政波,夏玮,等.贝利婴幼儿发展量表的临床应用进展[J].护理学杂志,2017,32(15):99-102.
[10] Chaparro-Huerta V,Flores-Soto ME,Merin Sigala ME,et al. Proinflammatory cytokines,enolase and s-100 as early biochemical indicators of hypoxic-ischemic encephalopathy following perinatal asphyxia in newborns[J]. Pediatr Neonatol,2017,58(1):70-76.
[11] 羡晓辉,高俊侠,齐杰,等.p38MAPK通路参与舒巴坦诱导的大鼠脑缺血耐受[J].河北医科大学学报,2017,38(10):1117-1121,1126.
[12] 廖瑞雪,杨洋,刘彦慧.纳洛酮治疗中重度新生儿缺氧缺血性脑病的Meta分析[J].华西医学,2016,31(8):1344-1351.
[13] 黄健,唐晓霞.亚低温联合促红细胞生成素治疗新生儿缺氧缺血性脑病疗效观察[J].海南医学,2017,28(22):3728-3729.
[14] 李晓梅,刘建红,朱法荣,等.缺氧缺血性脑病新生儿血清8-羟基脱氧鸟苷水平变化及其临床意义[J].山东医药,2016,56(36):54-56.
[15] Rjiba-Touati K,Ayed-Boussema I,Guedri Y,et al. Effect of recombinant human erythropoietin on mitomycin C-induced oxidative stress and genotoxicity in rat kidney and heart tissues[J]. Hum Exp Toxicol,2016,35(1):53-62.
[16] Rosenbaum P. Commentary on “counterbalanced comparison of the bayley scales of infant development-Ⅱ and -Ⅲ at 18 to 22 months corrected age”[J]. J Dev Behav Pediatr,2017,38(5):345-346.