硫化氢(hydrogen sulfide,H2S)是有着“一种臭鸡蛋气味”的有害气体,长期接触可导致许多组织器官的损害。但近几年的研究表明,H2S可以通过抗氧化、抑制凋亡等发挥抗脑、心肌等多器官组织缺血缺氧的损伤[1-3]。正常动物体内参与内源性H2S合成的两种重要的酶是胱硫醚β-合酶(cystathionine beta-synthase, CBS)和胱硫醚γ-裂解酶(cystathionine γ lyase,CSE) [4]。其中CBS主要分布于中枢神经系统[5-6],而CSE则主要分布于神经系统以外的组织。血管性痴呆(vascular dementia,VD)是由一系列脑血管因素(缺血、出血等)导致脑组织损伤引起的痴呆综合征,其主要特征是认知功能障碍[7]。本实验采用VD大鼠模型,通过腹腔给药的方式,研究不同剂量H2S供体硫氢化钠(sodium hydrosulfide,NaHS)及H2S合成酶抑制剂羟氨 (hydroxylamine, HA),对建立大鼠全脑缺血再灌注模型后的海马CA1区锥体神经元损伤和脑组织炎症变化后的影响,并探讨其炎症反应机制。采用病理切片和HE染色的方法观察各组大鼠海马CA1区细胞形态的变化;免疫组织化学和Western blot方法检测大鼠脑缺血再灌注中脑组织H2S生成酶CBS表达变化;酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)测定方法检测H2S生成酶抑制剂对脑缺血再灌注中炎症介质的影响。本实验旨在从神经元、炎性因子、内源性H2S等方面,证明H2S抗脑缺血损伤的保护作用,并为其提供理论依据。
1 材料与方法
1.1 动物与分组 健康雄性Wistar大鼠(280~350 g),80只(模型成功52只,死亡8只),由河北省实验动物中心提供。随机分为以下8组:正常组(Normal),假手术组(Sham),脑缺血再灌注组(ischemia-reperfusion injury,IR),IR+NaHS根据注射剂量进一步分为2 mg/kg、5 mg/kg、10 mg/kg和20 mg/kg 4个亚组,IR+NaHS+HA,每组10只。
1.2 动物模型制备 采用目前国际公认的Pulsinelli四血管阻断法(4-vessel occlusion,4-VO)制造大鼠VD模型[8-10]。假手术组仅暴露手术部位,不阻断血流。IR+NaHS组在脑缺血灌注前30 min,给予腹腔注射不同剂量的NaHS。IR+NaHS+HA组于脑缺血再灌注前1 d,给予NaHS 20 mg/kg[11],全脑缺血再灌注30 min前,开始腹腔注射HA。所有实验动物操作程序符合《实验动物管理和使用指南》规定。本研究获得河北省实验动物伦理委员会的审查批准。
1.3 方法 脑缺血再灌注术后24 h后断头取脑。冠状切取视交叉后1~4 mm脑组织,4% 多聚甲醛固定48 h,经酒精梯度脱水,二甲苯组织透明,蜡块包埋,常规脑组织切片厚5 μm,用于神经病理学评价和免疫组织化学分析。
1.4 脑海马伊红染色法(hematoxylin-eosin staining,HE)染色
1.4.1 配制 HE染色剂0.5%的伊红酒精溶液、苏木精染液。
1.4.2 HE染色 常规脑组织切片(5 μm)置于的载玻片上,60 ℃过夜烤片。用二甲苯脱蜡→经梯度乙醇脱水→蒸馏水洗→苏木素染色5 min→1%盐酸酒精分化30 s→置0.5%伊红液30 s→常规脱水,透明→中性树脂封片。
1.4.3 脑组织病理学观察 参照Kitagawa和Kato分级方法[12],对海马CA1区病理组织学变化进行分级(histological grade,HG),标准如下:0级,无神经元死亡;1级,散在神经元死亡;2级,成片神经元死亡;3级,几乎全部的神经元死亡。取双侧平均等级作为统计值。高倍镜下计数海马CA1区每1 mm区段内胞核饱满、核仁清晰的锥体细胞数目、细胞膜完整,每张切片双侧海马各计数3个区段取平均数为神经元密度(neuronal density,ND)。
1.5 免疫组织化学染色 兔抗CBS抗体(美国Sigma公司),兔抗大鼠β-actin抗体(美国Santa Curz公司:Cat sc-47778,Lot#H 1709)。
1.6 ELISA 按照ELISA试剂盒的操作步骤进行,并读取450 nm处的吸光值。利用Microsoft Excel作图功能分析结果,根据标准曲线分别计算出450 nm的吸光值与TNF-α和IL-1β浓度之间关系公式推算出各实验组上清液中TNF-α和IL-1β的含量(每组上清液均用3个孔并行实验,结果取平均值)。
1.7 Western blot分析 应用Alpha Imager凝胶图像分析系统(美国AlphaInotech公司)对Western免疫反应阳性条带进行积分光密度(integrated optical density,IOD)测定,以CBS的IOD值与β-actin的IOD值的比值表示CBS表达的相对表达量。
1.8 统计学方法 应用SPSS 21.0统计软件处理数据。计量资料比较采用单因素方差分析和LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 病理形态学结果 Normal组和Sham组大鼠海马CA1区锥体细胞排列整齐、致密,细胞形态完整,胞核饱满,核仁清晰,无明显神经元死亡,HG为0~Ⅰ级,ND值为(210.0±17.5) mm。全脑缺血IR组大鼠出现了明显的细胞损伤,海马CA1区核仁消失;锥体细胞稀疏,排列紊乱;残存的锥体细胞体积缩小,呈三角形或不规则形;大量细胞碎片可见,海马CA1区有大片神经元缺失;与Normal组和Sham组相比,HG(Ⅱ~Ⅲ级)明显升高,ND值显著降低(P<0.05)。IR+NaHS组中,2 mg/kg组和5 mg/kg组组织形态与IR组基本一致;10 mg/kg组与IR组相比,可见不完整的锥体细胞层,神经元数量有所增加;20 mg/kg组神经元存活状态明显改善,组织学特征与Normal组和Sham组类似,神经元排列比较整齐,细胞形态也比较完整。IR+NaHS+HA组IR+NaHS 20 mg/kg相比出现了明显的细胞损伤,见图1。
2.2 H2S上调全脑缺血大鼠海马CA1区CBS的表达
2.2.1 免疫组织化学结果显示 Normal组、Sham组大鼠海马CA1区可见到一定量CBS阳性免疫颗粒,呈棕黄色,染色较浅,均匀分布。与Sham组相比,IR组CBS阳性免疫颗粒显著减少(P<0.05),甚至在锥体细胞层及其周围出现大片CBS表达缺失区域。与IR组相比,低剂量NaHS(2、5 mg/kg)CBS的免疫阳性染色强度均无明显变化,随着NaHS的剂量加大免疫染色阳性随之增强。NaHS大剂量(20 mg/kg)组可见大量棕褐色CBS阳性免疫颗粒分布于海马CA1区,尤其在海马锥体细胞层可见大量、深染的CBS阳性颗粒包绕锥体神经元细胞。IR+NaHS+HA组与IR+NaHS 20 mg/kg相比,CBS阳性免疫颗粒明显减少,见图2。
2.2.2 Western blot结果 在Normal组和Sham组动物海马CA1区组织内有CBS蛋白的生成。与Sham组相比,IR组的CBS的蛋白表达全脑缺血后显著降低(P<0.05)。大剂量NaHS可明显上调全脑缺血大鼠CBS蛋白的表达;而低剂量NaHS对全脑缺血大鼠CBS蛋白表达下调无明显影响。注射HA后H2S诱导的CBS的蛋白表达上调作用消失,见图3。
2.3 H2S抑制全脑缺血大鼠海马CA1区炎症因子的表达 ELISA结果显示在Normal组和Sham组大鼠海马CA1区组织内有TNF-α和IL-1β蛋白的生成。与Normal组和Sham组相比,IR组的TNF-α和IL-1β蛋白浓度于脑缺血后显著上调(P<0.05)。给予NaHS后,明显抑制了脑缺血引起的TNF-α和IL-1β蛋白生成,表现为其上升的高峰显著降低(P<0.05)。并且,大剂量组20 mg/kg IR+NaHS的抑制作用最为明显。IR+NaHS+HA组与IR+NaHS 20 mg/kg组相比IL-1β和TNF-α蛋白显著上调,见表1。

图1 HE染色显微镜下观察海马CA1区的神经元(HE ×400)A.Normal组;B.Sham组;C.IR组;D. IR+NaHS 2 mg/kg组;E.IR+NaHS 5 mg/kg组;F.IR+NaHS 10 mg/kg组;G.IR+NaHS 20 mg/kg组;H.IR+NaHS+HA组
图2 显微镜下观察海马CA1区免疫组织化学CBS的表达( ×400)
A.Normal组;B.Sham组;C.IR组;D. IR+NaHS 2 mg/kg组;E.IR+NaHS 5 mg/kg组;F.IR+NaHS 10 mg/kg组;G.IR+NaHS 20 mg/kg组;H.IR+NaHS+HA组
图3 Western blot分析显示各组海马CA1区中CBS蛋白的表达
1.Normal组;2.Sham组;3.IR组;4.IR+NaHS 2 mg/kg组;5.IR+NaHS 5 mg/kg组;6.IR+NaHS 10 mg/kg组;7.IR+NaHS 20 mg/kg组;8.IR+NaHS+HA组
表1 H2S抑制VD大鼠海马CA1区IL-1β、TNF-α的表达![]()
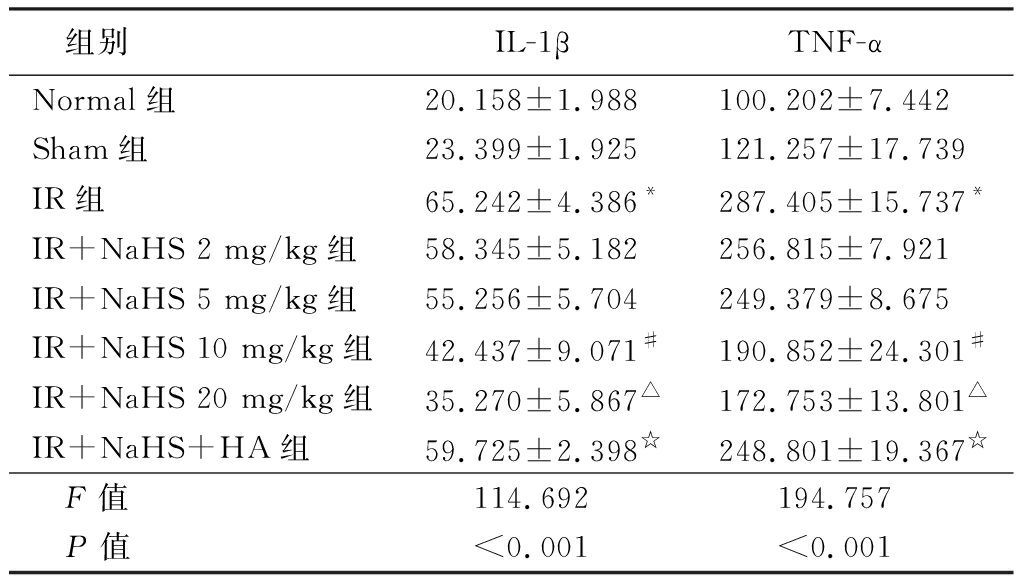
组别IL-1βTNF-αNormal组20.158±1.988100.202±7.442Sham组23.399±1.925121.257±17.739IR组65.242±4.386*287.405±15.737*IR+NaHS 2 mg/kg组58.345±5.182256.815±7.921IR+NaHS 5 mg/kg组55.256±5.704249.379±8.675IR+NaHS 10 mg/kg组42.437±9.071#190.852±24.301#IR+NaHS 20 mg/kg组35.270±5.867△172.753±13.801△IR+NaHS+HA组59.725±2.398☆248.801±19.367☆ F值114.692194.757 P值<0.001<0.001
*P值<0.05与Normal组比较 #P值<0.05与Sham组比较 △P值<0.05与IR组比较 ☆P值<0.05与IR+NaHS 20 mg/kg组比较(LSD-t检验)
3 讨 论
Pulsineli和Brierley首先利用4-VO(灼烧动物双侧椎动脉和夹闭双侧颈总动脉)建立了全脑缺血模型。严重缺血会引起神经元的坏死。建立全脑缺血的动物模型对于探讨脑血管炎症的发病机制等方面至关重要。H2S是一种具有神经活性物质的气体信号分子,参与内源性H2S合成的两种重要的酶是CBS和CSE[13-14]。生理浓度的H2S可易化海马CA1区长时程增强,调节脑组织血流量[15]。H2S通过抗迟发性神经元死亡和凋亡发挥神经的保护作用[16]。由此可见,进一步研究H2S在神经系统缺血性疾病中的作用及其机制是必要的。以往有研究发现脑缺血再灌注损伤后,大鼠海马组织CBS表达增加,H2S的含量增加,表明CBS/H2S体系在脑缺血再灌注损伤中被激活,从而发挥抗脑缺血损伤的作用。
本实验采用VD大鼠模型,通过腹腔给药的方式,研究不同剂量NaHS及HA,采用免疫组织化学和Western blot方法检测脑缺血再灌注中脑组织H2S生成酶CBS表达变化。其免疫组织化学结果显示,Normal组和Sham组大鼠海马CA1区可见到一定量CBS阳性免疫颗粒,呈棕黄色,均匀分布。与脑缺血组相比,低剂量NaHS(2、5 mg/kg)对全脑缺血大鼠海马CA1区CBS的免疫阳性染色强度均无明显变化,而大剂量NaHS(20 mg/kg)组大鼠可见大量棕褐色CBS阳性免疫颗粒分布于海马CA1区。IR+NaHS+HA组与IR+NaHS 20 mg/kg相比,CBS阳性免疫颗粒明显减少。Western blot结果显示,在Normal组和Sham组动物海马CA1区组织内有CBS蛋白的生成。与Sham组相比,IR组的CBS的蛋白表达全脑缺血后显著降低。大剂量NaHS可明显上调全脑缺血大鼠CBS蛋白的表达;而低剂量NaHS对全脑缺血大鼠CBS蛋白表达下调无明显影响。注射HA后H2S诱导的CBS的蛋白表达上调作用消失。
IR是脑损伤的因素之一,而局部过度炎症反应是造成再灌注损伤主要原因之一。许多炎症细胞及炎症介质均参与了炎症反应。在正常脑组织中,大多数细胞因子包括TNF-α和IL-1β的表达量很少。脑缺血可以触发炎性反应,这个过程有多种细胞因子包括TNF-α和IL-1β参与[17],从而加重脑组织损伤[18]。IL-1β可通过促进炎症反应、增加兴奋性氨基酸、激活内皮细胞产生多种组织因子等参与IR损伤过程[19-20]。TNF-α增多可促进IR后炎症反应,加重脑损害而使用TNF-α单克隆抗体可以减小了脑梗死灶体积,起到一定的脑保护作用[21]。IL-1β、TNF-α等炎症因子具有对抗脑缺血性损伤的作用并介导缺血预处理的神经保护作用[22-23]。本实验发现Normal组和Sham组动物海马CA1区组织内有IL-1β和TNF-α蛋白的生成。与Normal组和Sham组相比,脑缺血组动物的IL-1β和TNF-α蛋白浓度于脑缺血后显著上调。治疗性给予NaHS后,明显抑制了脑缺血引起的IL-1β和TNF-α蛋白生成的上调,表现为其上升的高峰显著降低。并且,IR+NaHS 20 mg/kg的抑制作用最为明显。IR+NaHS+HA组与IR+NaHS 20 mg/kg相比IL-1β和TNF-α蛋白显著上调。研究表明H2S下调脑缺血过程中炎症因子IL-1β和TNF-α的表达,进一步证实H2S的抗脑缺血作用。
综上所述,脑缺血前给予一定剂量的NaHS可有效地减轻全脑IR大鼠海马CA1区细胞损伤,且大剂量组的保护作用更明显。而CBS的抑制剂HA可以抑制上述作用;HA可以抑制H2S上调CBS表达和下调脑缺血过程中炎症因子IL-1β和TNF-α的表达,可能是H2S抗缺血性脑损伤的机制之一,并进一步表明H2S的抗脑缺血作用。
[1] Lin J,Chen M,Liu D,et al. Exogenous hydrogen sulfide protects human umbilical vein endothelial cells againsthigh glucose induced injury by inhibiting the necroptosis pathway [J]. Int J Mol Med,2018,41(3):1477-1486.
[2] Karwi QG,Bice JS,Baxter GF. Pre-and postconditioning the heart with hydrogen sulfide(H2S) against ischemia /reperfusion injury in vivo:a systematic review and meta-analysis[J]. Basic Res Cardiol,2017,113(1):6.
[3] Citi V,Piragine E,Testai L,et al. The role of hydrogen sulfide and H2S-donors in myocardial protection against ischemia/reperfusion injury[J]. Curr Med Chem,2018,25(34):4380-4401.
[4] Shefa U,Kim MS,Jeong NY,et al. Antioxidant and cell-signalingfunctions of hydrogen sulfide in the central nervoussystem[J]. Oxid Med Cell Longev,2018,2018:1873962.
[5] Prabhudesai S,Koceja C,Dey A,et al. Cystathionine β- synthase is necessary for axis development in vivo [J]. Front Cell Dev Biol,2018,6:121.
[6] Ohia SE,Robinson J,Mitchell L,et al. Regulation of aqueoushumor dynamics by hydrogen sulfide: potentialrole in glaucoma pharmacotherapy [J]. J Ocul Pharmacol Ther,2018,34(1/2):61-69.
[7] 杨申,崔瑞亭,刘运林.血管性痴呆的细胞学和分子机制研究进展[J/CD].中华临床医师杂志(电子版),2016,10(12):1785-1789.
[8] 李清云,徐小林.白藜芦醇对血管性痴呆大鼠认知功能及突触可塑性的影响[J].河北医科大学学报,2018,39(6):623-627.
[9] 刘娜,徐明,王华龙,等.红景天对血管性痴呆大鼠认知功能的影响[J].河北医科大学学报,2017,38(6):621-624,632.
[10] 李欧,沙中玮,吴双,等.血管性认知功能障碍动物模型研究进展[J].中国中医基础医学杂志,2018,24(4):567-570.
[11] 柯娩英,杨治芳,周华华,等.硫化氢改善高糖环境下内皮祖细胞功能活性的机制研究[J].江西医药,2018,53(10):1063-1069.
[12] 何小苏,邹红群,李启艳,等.替格瑞洛对大鼠全脑缺血/再灌注损伤的神经保护作用[J].中国药理学通报,2019,35(3):413-418.
[13] Zhao L,Xiao Y,Weng RX,et al. Neonatal colonic inflammation increases spinal transmission and cystathionine β-synthetase expression in spinal dorsal horn of rats with visceral hypersensitivity[J]. Front Pharmacol,2017,8:696-707.
[14] 李清梅,张琴,秦榜勇,等.胱硫醚-β-合成酶参与慢性压迫性损伤大鼠神经病理性痛的作用[J].实用医学杂志,2019,35(6):864-867.
[15] 沈慧,马洁,王国红,等.ATP处理导致PC12细胞通透性变化及NaHS的干预作用[J].神经解剖学杂志,2018,34(2):184-190.
[16] 张翀,余丹.硫化氢治疗脑缺血再灌注损伤的研究进展[J/CD].中华临床医师杂志(电子版),2016,10(23):3626-3630.
[17] Pallesen LP,Ragaller M,Kepplinger J,et al. Diagnostic impact of transesophageal echocardiography in patients with acute cerebral ischemia[J]. Echocardiography,2016,33(4):555-561.
[18] 贾二娟.血清Hcy、hs-CRP、IL-6和TNF-α水平与急性脑梗死严重程度的关系[J].实验与检验医学,2017,35(3):382-384.
[19] 丁彬彬,邓飞飞,徐坚,等.阿尔茨海默病患者血清炎性因子与血凝指标的变化[J].疑难病杂志,2017,16(1):32-35.
[20] 伏彩霞,尚天明,马宝山.阿尔茨海默病患者炎症因子、氧化应激与胰岛素抵抗的相关性分析[J].检验医学与临床,2019,16(7):939-942.
[21] Wang Y,Tao Y,Liu Y, et al. Rapid detection of urinary soluble intercellular adhesion molecule-1 for determination of lupus nephritis activity[J]. Medicine,2018,97(26):e11287.
[22] 金桐,叶樱泽,古丽娟,等.甲异靛对小鼠脑缺血再灌注损伤的保护作用及对CD68+细胞极化的影响[J].卒中与神经疾病,2019,26(1):3-7.
[23] 喻斌,沈祥春,梁涛,等.基于脑区特异性不同剂量冰片与川芎配伍抗脑缺血的研究[J].中国医院药学杂志,2017,37(18):1792-1796.