乳腺癌是起源于乳腺导管上皮的恶性肿瘤,多见于40~60岁女性[1]。妊娠期乳腺癌(pregnancy-associated breast cancer,PABC)即怀孕期间确诊为原发性乳腺癌,或者分娩之后的1年内明确诊断为原发性乳腺癌[2-4],属于一种比较特殊的乳腺癌,临床上发病率大概是6/100 000,但是随着高龄产妇的相应增加,其发病率呈逐渐增高趋势。现阶段尚无对妊娠期乳腺癌有效的筛查模式。根据非妊娠期乳腺癌高危人群的筛查标准,结合实际孕检人员构成,笔者将可触及乳腺结节者、高龄(≥35岁)、乳腺癌家族史者、合并有卵巢肿瘤者列为高危人群。
1 资料与方法
1.1 一般资料 选取2009—2017年于我院分娩孕妇2 053例作为研究对象,其中年龄≥40岁的妊娠妇女581例,被列为妊娠期乳腺癌高危人群。前瞻性研究自2018年1—12月门诊产检孕产妇3 876例,入组妊娠期乳腺癌的高危人群共482例。共确诊10例乳腺癌患者,病情发展至Ⅲa期和Ⅲc期均为4例,病情发展至Ⅳ期2例。采取手术治疗4例,选择保守治疗6例,其中选择化疗2例,观察疗法4例。
1.2 研究方法 回顾性分析:通过查阅的方式对2009—2017年于我院接受分娩治疗的乳腺癌高危者581例进行病历检查,归纳总结乳腺癌发病情况、诊治情况及妊娠结局等。前瞻性研究:选择在2018年1—12月,依据新的筛查标准对我院就诊的妊娠期乳腺癌高危者建档时(12~16周)进行乳腺触诊,如发现乳腺结节行超声筛查,并联合乳腺科会诊。
1.3 统计学方法 应用 SPSS18.0统计软件分析数据。计数资料比较采用χ2检验,采用线性回归分析2009—2017年发病例数的趋势。P<0.05为差异有统计学意义。
2 结 果
2.1 回顾性研究 妊娠期乳腺癌高危者顺利产检已终止妊娠并哺乳,母儿结局良好。2009—2017年妊娠期乳腺癌高危孕妇比例大致呈增长趋势,其中2016年7.037‰为最高。妊娠期乳腺癌高危者年龄≥40岁的占比大致呈增长趋势,其中2017年41.567‰为最高。2009—2013年前5年高危者中存在乳腺家族史的例数为13例,发生率相对较低;后5年高危者中存在乳腺家族史的例数为28例,较5年前显著增多。2009—2017年的合并乳腺结节人数上升加快,从2009年1例上升至2017年15例,前5年为17例,后5年为45例,这与当前生活环境的变化、生活方式的变化等因素有着密切联系。各年份具体情况见表1。
表1 妊娠期乳腺癌高危者孕妇每年病例数表
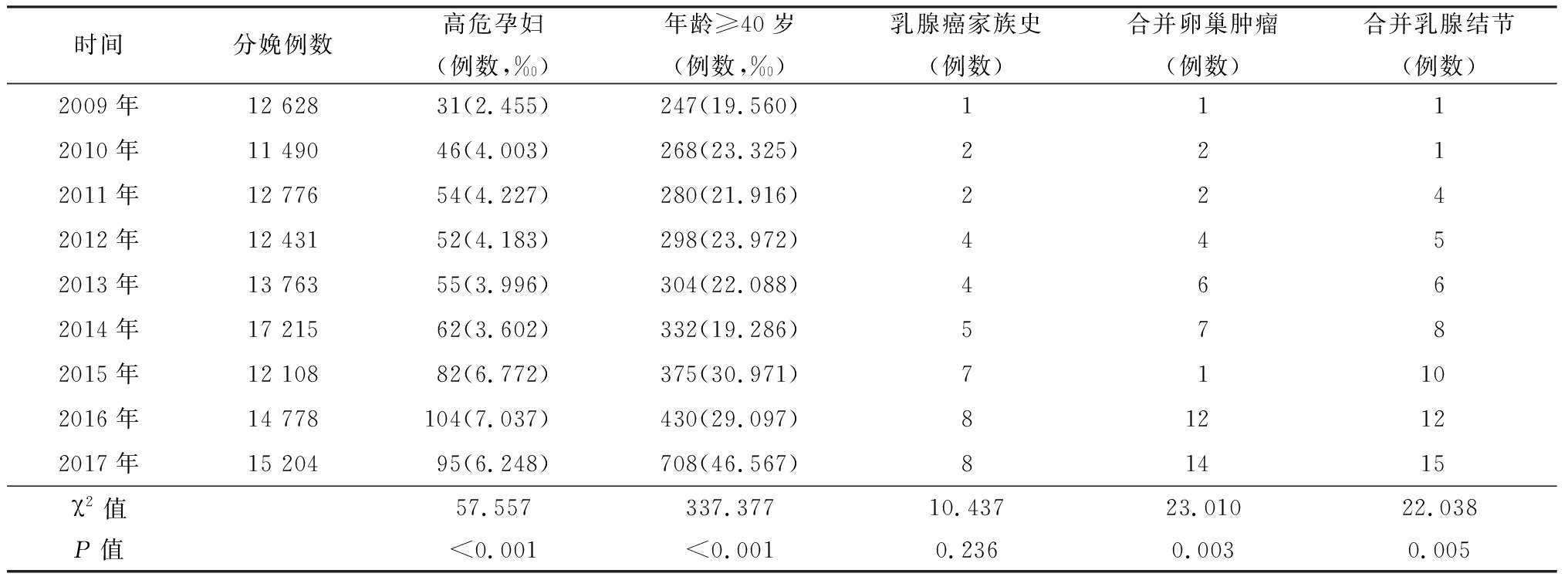
时间分娩例数高危孕妇(例数,‰)年龄≥40岁(例数,‰)乳腺癌家族史(例数)合并卵巢肿瘤(例数)合并乳腺结节(例数)2009年12 62831(2.455)247(19.560)1112010年11 49046(4.003)268(23.325)2212011年12 77654(4.227)280(21.916)2242012年12 43152(4.183)298(23.972)4452013年13 76355(3.996)304(22.088)4662014年17 21562(3.602)332(19.286)5782015年12 10882(6.772)375(30.971)71102016年14 778104(7.037)430(29.097)812122017年15 20495(6.248)708(46.567)81415χ2值57.557337.37710.43723.01022.038P值<0.001<0.0010.2360.0030.005
以时间为自变量,对2009—2017年间妊娠期乳腺癌的高危人群中各项高危因素发生例数进行直线回归分析,发现随着时间推移,具有各项高危因素例数整体的变化趋势均为持续增长。见表2。
表2 2009—2017年间妊娠期乳腺癌高危人群例数的直线回归分析
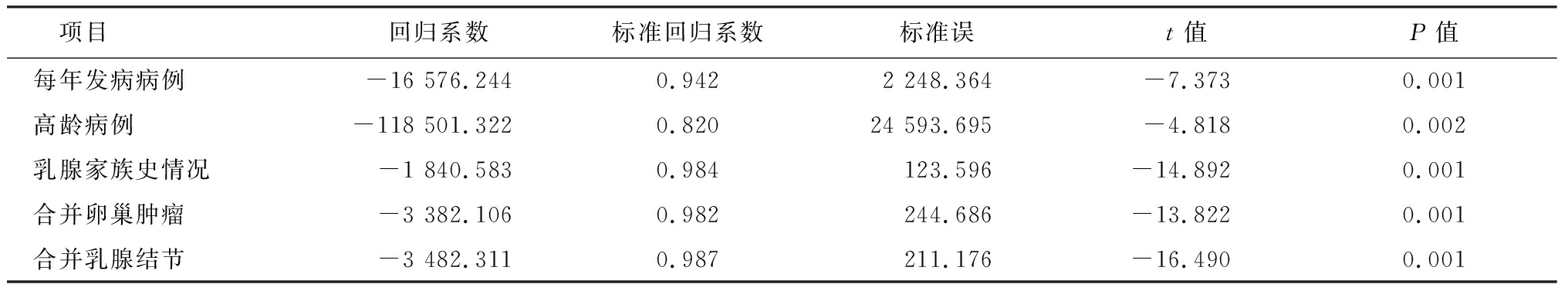
项目回归系数标准回归系数标准误t值P值每年发病病例-16 576.2440.942 2 248.364-7.3730.001高龄病例-118 501.3220.820 24 593.695-4.8180.002乳腺家族史情况-1 840.5830.984123.596-14.8920.001合并卵巢肿瘤-3 382.1060.982244.686-13.8220.001合并乳腺结节-3 482.3110.987211.176-16.4900.001
2.2 前瞻性分析 根据拟定出的筛查妊娠期乳腺癌高危者的条件,产检筛查孕产妇3 876例,其中年龄≥35岁393例,年龄>40岁46例,有乳腺癌家族史和乳腺结节的分别有9例和17例,有卵巢肿瘤或相关病史者17例。其中确诊为妊娠期乳腺癌患者2例:高龄初产妇(44岁)高雌激素患者1例。2016年行腹腔镜下卵巢畸胎瘤手术史1例。
2.3 确诊妊娠期乳腺癌患者
2.3.1 临床表现 可触及乳腺结节、通过术后病理确诊为乳腺癌10例。其中孕前即有乳腺结节(0.5~1 cm)但未重视者3例;早孕期乳腺结节1 cm,均出现结节增大,经病理活检确诊乳腺癌2例。妊娠中期由住院医生触及乳腺结节2 cm,后经乳腺科会诊提示乳腺癌1例。乳腺癌术后在行靶向治疗及化疗期间意外妊娠者1例,孕3+个月发现左胸壁结节,直径1 cm,定期复查,孕期无变化;高龄经产妇1例,49岁,孕前2个月体检未见乳腺异常,但同时发现卵巢畸胎瘤、子宫肌瘤,孕24周自行触及右乳肿块,直径2 cm,左乳发现直径1 cm结节,后于孕25周行局部麻醉下右乳腺癌保乳根治+前哨淋巴结切除手术确诊为妊娠期乳腺癌。另前瞻性研究中发现高龄初产妇(44岁)高雌激素者1例,工作压力大,焦虑状态,9年不孕不育,经1年以上促排卵后妊娠,孕期保胎治疗,孕16周查体发现乳腺结节,因有强烈生育要求,经产科及乳腺科严密观察至孕足月,产后乳腺科治疗;于2016年行腹腔镜下卵巢畸胎瘤手术史1例,27周产检时发现乳腺结节,严密监测33周,结节突然增大,穿刺活检确诊妊娠期乳腺癌后,剖宫产终止妊娠后行乳腺癌根治术。
2.3.2 组织病理学结果 采用细针穿刺取细胞检查或者乳腺包块切除术后送至病理科检查后确诊,浸润性癌9例,原位癌1例。
2.3.3 治疗及妊娠结局 10例均为Ⅲa期及以上;孕妇剖宫产者7例,催产自娩者3例;新生儿早产5例,足月产5例。足月剖宫产后选择全部切除乳腺加化疗的患者2例;妊娠期间实施化疗,至预产期时顺利分娩者1例;怀孕期间实施手术治疗,但无化疗,怀孕至足月后顺利分娩3例;怀孕期间采用手术加化疗,一个疗程后进行剖腹产,然后实施乳腺癌根治术并结合化疗者1例,行早产剖宫产后即刻转入乳腺科行乳腺癌根治术+放化疗,且早产儿发育状况良好者2例;怀孕中期和晚期实施化疗者2例,其中选择CAF(环磷酰胺+多柔吡星+氟尿嘧啶)化疗方案1例,在怀孕30周的时候化疗1次,32周时通过剖腹产产下1名健康的新生儿,新生儿生长发育状况良好,现已8岁;选择AT(多柔吡星+紫衫醇)化疗方案1例,怀孕期间总共进行5次化疗,化疗结束后2周正好足月,自然分娩产下1名健康的新生儿。见表3。
表3 10例妊娠合并乳腺癌患者的基本情况、治疗情况及妊娠结局
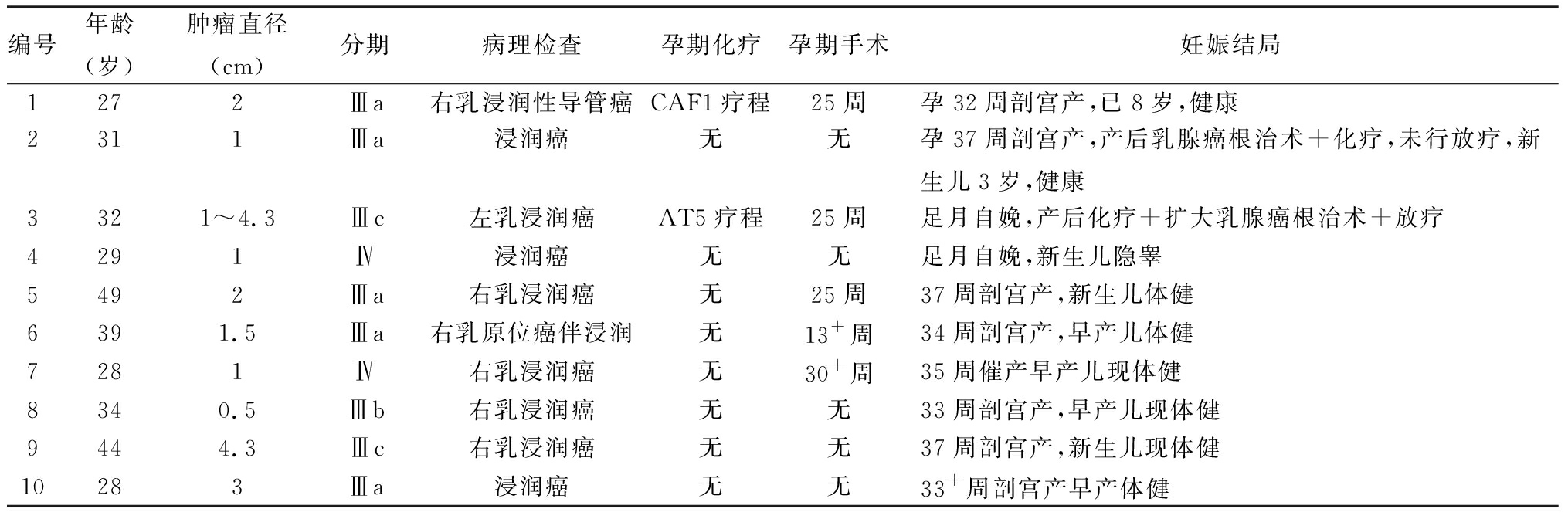
编号年龄(岁)肿瘤直径(cm)分期病理检查孕期化疗孕期手术妊娠结局1272Ⅲa右乳浸润性导管癌CAF1疗程25周孕32周剖宫产,已8岁,健康2311Ⅲa浸润癌无无孕37周剖宫产,产后乳腺癌根治术+化疗,未行放疗,新生儿3岁,健康3321~4.3Ⅲc左乳浸润癌AT5疗程25周足月自娩,产后化疗+扩大乳腺癌根治术+放疗4291Ⅳ浸润癌无无足月自娩,新生儿隐睾5492Ⅲa右乳浸润癌无25周37周剖宫产,新生儿体健6391.5Ⅲa右乳原位癌伴浸润无13+周34周剖宫产,早产儿体健7281Ⅳ右乳浸润癌无30+周35周催产早产儿现体健8340.5Ⅲb右乳浸润癌无无33周剖宫产,早产儿现体健9444.3Ⅲc右乳浸润癌无无37周剖宫产,新生儿现体健10283Ⅲa浸润癌无无33+周剖宫产早产体健
3 讨 论
3.1 概述妊娠期乳腺癌高危人群 中国抗癌协会乳腺癌诊治指南与规范中指出,乳腺癌高危人群包括:①有乳腺癌遗传家族史或明显的遗传影响者;②曾经患有乳腺导管不典型增生或曾经患有小叶原位癌者;③曾经有胸部放疗治疗者。随着社会的不断发展进步,女性的生育时间明显延迟[5]。随着妊娠年龄的增高,妊娠期乳腺癌的发病率也相应升高,且家族中有乳腺癌病史的、多次分娩史的人群乳腺癌的风险为无上述因素的人群的2倍[2,6]。
本研究中妊娠期乳腺癌相关高危因素包括:①孕产妇自诉乳房不适(表皮红肿、胀痛感,针刺感,乳头溢液)或乳房有结节者;②临床行乳腺触诊检查可触及乳腺结节者;③有乳腺癌家族遗传史的人群;④长期分泌过度雌激素者;⑤曾经有过乳腺导管不典型增生、小叶不典型增生者;⑥有胸部放疗史者。但在我国,目前尚无对乳腺癌患者的生育状况进行研究,对于已行乳腺癌治疗患者有无生育要求、妊娠时间及孕期管理尚需多科室联合制定。研究结果表明妊娠期乳腺癌患者首要高危因素为有乳腺结节或有乳房不适感,其次为乳腺癌遗传倾向,工作压力大,精神紧张,高雌激素状态等。
3.2 妊娠期乳腺癌高危人群的筛查
3.2.1 乳腺触诊 乳腺癌发病初期主要诊断方式是触诊,但怀孕期间乳腺腺管和腺泡大量增生、脂肪沉积,使妊娠期乳房体积增大、密度增加,进而乳腺癌的诊断难度增加。本研究妊娠合并乳腺癌者10例,其中被动发现乳腺结节(有主诉或经体检发现)5例,直径为0.5~3 cm,怀孕期间因感觉到结节肿大后就医,做进一步检查后确诊为乳腺癌;自行触摸到直径为1.5~4 cm的肿块5例。通过早孕期乳腺触诊,可触及乳腺结节直径1~2 cm者9例。故对乳腺癌高危人群进行乳腺触诊,可能会尽早发现乳腺结节,早诊断早治疗,降低母婴不良结局发生率[7]。本研究建议妊娠妇女尤其是年龄≥35岁的高龄孕妇均应行乳腺癌筛查,争取做到早发现早治疗[8]。
3.2.2 辅助检查 ①超声检查具有操作简便、速度快及没辐射等优点,对人体无创伤[9],成为最常用的检查手段,可用于任何妊娠时期的筛查。②磁共振成像检查(magnetic resonance imaging,MRI)一种无创且无辐射的影像学检查方法,其安全性已被证实,但仍有专家认为应尽量避免妊娠前3个月行MRI检查,最佳的检测时间为18~22周[10]。③进行细针穿刺或包块切除手术后送病理学活检是最为可靠的诊断方法,视为诊断乳腺癌的“金标准”[11]。
3.3 妊娠期乳腺癌高危人群与基因 仅有10%的乳腺癌患者进行基因检测时,发现存在乳腺癌易感基因(breast cancer susceptibility gene,BRCA)基本突变。研究表明携带BRCA1和O6-甲基鸟嘌呤-DNA甲基转移酶基因(O6-methyl-guanine DNA methyltransferase,MGMT)基因表型突变者可具有遗传性[12]。在我国,妊娠期乳腺癌发病率相对较低,基因筛查不适合在生育年龄妇女中开展。
3.4 妊娠期乳腺癌与激素 有观点认为雌激素促进已存在的乳腺癌细胞增殖,并且可引起乳腺基因突变而发展为乳腺癌。另有观点认为在特定人群中,雌激素可能通过促凋亡及其它机制发挥癌保护作用[13]。本研究孕前即有乳腺结节经过妊娠中雌孕激素的过增于妊娠中晚期发展为妊娠期乳腺癌者3例;孕前高雌激素状态,促排卵后雌孕激素保胎,孕中期诊断妊娠期乳腺癌者1例。笔者更倾向于雌激素能促进乳腺癌的发生发展。
乳腺癌与孕激素之间的相互作用尚存争议。有研究认为雌激素和孕激素通过拮抗增长或促进增长发挥作用,促进增长变现为促进乳腺导管末梢形成腺房,增加乳腺癌的发生率,而拮抗作用则主要表现为孕激素对雌激素促乳腺癌细胞增殖和分化的影响[14]。
3.5 妊娠期乳腺癌的治疗措施 本次研究在怀孕期间采取手术切除治疗措施者4例,其中怀孕至足月后自然分娩者2例,新生儿外观无异常,现已8岁,心智发育无异常;孕35周催产早产者1例,新生儿发育好。在高危者中,妊娠期乳腺癌发病者2例,足月剖宫产后行乳腺癌根治术加放化疗者1例,孕33周行剖宫产后即转入乳腺外科行进一步治疗者1例。
3.5.1 手术治疗 妊娠期乳腺癌的手术适应证及术式同非妊娠的乳腺癌患者,妊娠期乳腺和腋窝手术对胎儿没有明显危险性,尤其妊娠>12周后更为安全[15]。大多数妊娠期乳腺癌患者确诊时已属晚期,肿块较大,可行乳腺根治术,待分娩后行规范化治疗。本研究中孕妇自行触及肿块直径在1.5~4 cm之间。
3.5.2 化学治疗 乳腺癌是应用化疗治疗最有效的实体瘤之一,妊娠期乳腺癌患者往往发现较晚,在本研究中,乳腺癌患者术后病理分期均在Ⅲa期及以上10例,术后基本均需化疗。为不影响胎儿的正常发育,通常选择在怀孕后期化疗,且需重点注意最后一次化疗要和胎儿娩出时间有一定的间隔,一般超过3周[16]。
3.5.3 其他 分子靶向治疗、放射治疗[17]、内分泌治疗[14]均不建议在妊娠期进行,研究表明其可造成羊水过少及胎儿畸形,可待分娩后进行。
3.6 妊娠期乳腺癌的预后 研究显示PABC患者预后较差[18]。与非PABC对比,PABC患者发病年龄更小、肿块直径更大、癌症分期更晚。本研究年龄为27~49岁10例,分期均为Ⅲa期及以上,其中浸润癌9例,原位癌1例。跟踪随访10年,目前无复发。
妊娠期乳腺癌未行任何治疗的患者,其幼儿的早期认知、心脏和总体发育均正常[19]。多数研究结果均表明在孕中、晚期是否给予化疗,并不影响新生儿近期和远期结局[15,20],在胎儿发育早期进行化疗会增加死胎、流产、早产及严重缺陷病等风险。本研究于妊娠期化疗者2例,新生儿查体未见异常1例,新生儿已8岁1例,心智无异常。关于化疗对于胎儿预后影响仍需要进一步加大样本临床实验。
3.7 结论 近年来妊娠期乳腺癌的发病率呈现增长趋势,与妊娠期乳腺癌的高危率不断提升有关。在本研究及实际临床工作中总结并拟定新的筛查标准,对于妊娠期乳腺癌高危人群的筛查无年龄限制,且符合以下几种情况中的1种即可列入乳腺癌高发人群:①孕产妇自诉乳房不适(包括乳房表皮红肿,自觉刺痛等)或乳房有结节者;②临床行乳腺触诊检查可触及乳腺结节者;③家族中有明显的乳腺癌遗传倾向者;其中包括但不限于卵巢癌,涵盖卵巢肿瘤;④既往有乳腺导管或小叶不典型增生或小叶原位癌的患者;⑤既往行胸部放疗。基于此筛查标准,将触诊作为首选方式,并结合其他影像学技术进一步确诊,尽量减少漏诊率及早对妊娠期乳腺癌进行诊治,以期能够早期发现妊娠期乳腺癌患者并及时诊治,以降低母婴不良结局。
[1] 苗江雨,郭炳勋,张静,等.2种手术方式治疗早期乳腺癌的远期效果研究[J].河北医科大学学报,2016,37(5):555-557.
[2] Johansson AL,Andersson TM,Hsieh CC,et al. Family history and risk of pregnancy-associated breast cancer(PABC)[J]. Breast Cancer Res Treat,2015,151(1):209-217.
[3] Nargotra N,Kalita D. Pregnancy associated breast cancer: awareness is the key to diagnosis -a case report[J]. J Clin Diagn Res,2015,9(11):ED9-ED11.
[4] Dimitrakakis C,Zagouri F,Tsigginou A,et al. Does pregnancy-associated breast cancer imply a worse prognosis? A matched case-case study[J]. Breast Care(Basel),2013,8(3):203-207.
[5] 刘静,刘晓巍.再孕女性的评估与分娩方式的选择[J].中国临床医生杂志,2018,46(6):634-636.
[6] Bae SY,Kim SJ,Lee J,et al. Clinical subtypes and prognosis of pregnancy-associated breast cancer:results from the korean breast cancer society registry database[J]. Breast Cancer Res Treat,2018,172(1):113-121.
[7] Sekine M,Kobayashi Y,Tabata T,et al. Malignancy during pregnancy in Japan: an exceptional opportunity for early diagnosis[J]. BMC Pregnancy Childbirth,2018,18(1):50.
[8] Kelaranta A,Ekholm M,Toroi P,et al. Radiation exposure to foetus and breasts from dental X-ray examinations: effect of lead shields[J]. Dentomaxillofac Radiol,2016,45(1):20150095.
[9] 杨蕾,周纯武.超声结合数字乳腺三维断层摄影在乳腺癌诊断中的应用[J].中国医刊,2015,50(5):78-81.
[10] Bulas D,Egloff A. Benefits and risks of MRI in pregnancy[J]. Semin Perinatol,2013,37(5):301-304.
[11] Loibl S,Schmidt A,Gentilini O,et al. Breast cancer diagnosed during pregnancy: adapting recent advances in breast cancer care for pregnant patients[J]. JAMA Oncol,2015,1(8):1145-1153.
[12] Al-Moghrabi N,Al-Showimi M,Al-Yousef N,et al. Methylation of BRCA1 and MGMT genes in white blood cells are transmitted from mothers to daughters[J]. Clin Epigenetics,2018,10(1):99.
[13] Munster PN,Carpenter JT. Estradiol in breast cancer treatment: reviving the past[J]. JAMA,2009,302(7):797-798.
[14] Zagouri F,Sergentanis TN,Chrysikos D,et al. Trastuzumab administration during pregnancy: a systematic review and meta-analysis[J]. Breast Cancer Res Treat,2013,137(2):349-357.
[15] Wang FW,Fu SM,Jin YC,et al. Retrospective analysis of diagnosis and treatment of breast cancer in pregnancy[J]. Zhonghua Wai Ke Za Zhi,2018,56(2):114-118.
[16] Peccatori FA,Azim HJ,Orecchia R,et al. Cancer,pregnancy and fertility: ESMO clinical practice guidelines for diagnosis,treatment and follow-up[J]. Ann Oncol,2013,24:i160-i170.
[17] Cordeiro CN,Gemignani ML. Breast cancer in pregnancy:avoiding fetal harm when maternal treatment is necessary[J]. Breast J,2017,23(2):200-205.
[18] Martinez MT,Bermejo B,Hernando C,et al. Breast cancer in pregnant patients:a review of the literature[J]. Eur J Obstet Gynecol Reprod Biol,2018,230:222-227.
[19] Amant F,Vandenbroucke T,Verheecke M,et al. Pediatric outcome after maternal cancer diagnosed during pregnancy[J]. N Engl J Med,2015,373(19):1824-1834.
[20] Simoes E,Graf J,Sokolov AN,et al. Pregnancy-associated breast cancer: maternal breast cancer survival over 10 years and obstetrical outcome at a university centre of women′s health[J]. Arch Gynecol Obstet,2018,298(2):363-372.