微小RNA(micro RNA,miRNA)是一类非编码RNA,可以调节生物体内的多种生理过程,靶向并降解特定的mRNA可以抑制基因的表达,从而在生物体中发挥调节作用。miRNA可以调节人类基因80%的表达,如细胞发育、增殖、分化、信号转导、细胞周期、细胞凋亡等。除此之外,miRNA表达失调会导致神经结构和功能的异常,使得神经发育过程中出现精神性疾病。精神分裂症患者与正常人相比,大脑的前额叶皮质区、颞叶和丘脑区域内几种miRNA表达水平发生显著变化。miRNA也可以抑制肿瘤生长、增殖和转移等。miRNA在许多生理及病理学过程具有重要的调节作用[1]。miRNA基因首先转录初级RNA的转录产物(pri-miRNA)。在细胞核中,pre-miRNA由RNase Ⅲ内切酶Drosha和双链RNA结合蛋白构成的微处理器复合物加工成70 nt的茎环结构pre-miRNA,在Exportin-5复合体的作用下被转运到细胞质,由另一种RNAⅢ内切酶Dicer及双链RNA结合蛋白进一步加工以产生长度为18~24 nt的双链RNA。解链后,成熟的单链miRNA参与形成RNA介导的沉默复合物。在复合物中,miRNA通过碱基互补配对识别并结合mRNA的3′非翻译区(3′untranslated region,3′UTR)(图1)。此外,miRNA和靶标之间不完全的碱基配对使一个miRNA可以调控多种mRNA,一种mRNA同样也可受多种miRNA的调控。位于1号染色体短臂2区2带(1p22)的miR-137(AK094607)在细胞生物学中具有重要的生物功能。miR-137在脑部高表达,参与调控神经发育、突触形成及神经干细胞的增殖分化。最近研究发现miR-137与精神分裂症、双相情感障碍等精神疾病的成因密切相关,同时miR-137失调也会诱发黑色素瘤、胶质母细胞瘤、肺癌等疾病[2]。本文将总结miR-137的发现、生物学功能、相关调控途径及与人类相关疾病的最新进展,这有助于进一步了解相关精神疾病和癌症。
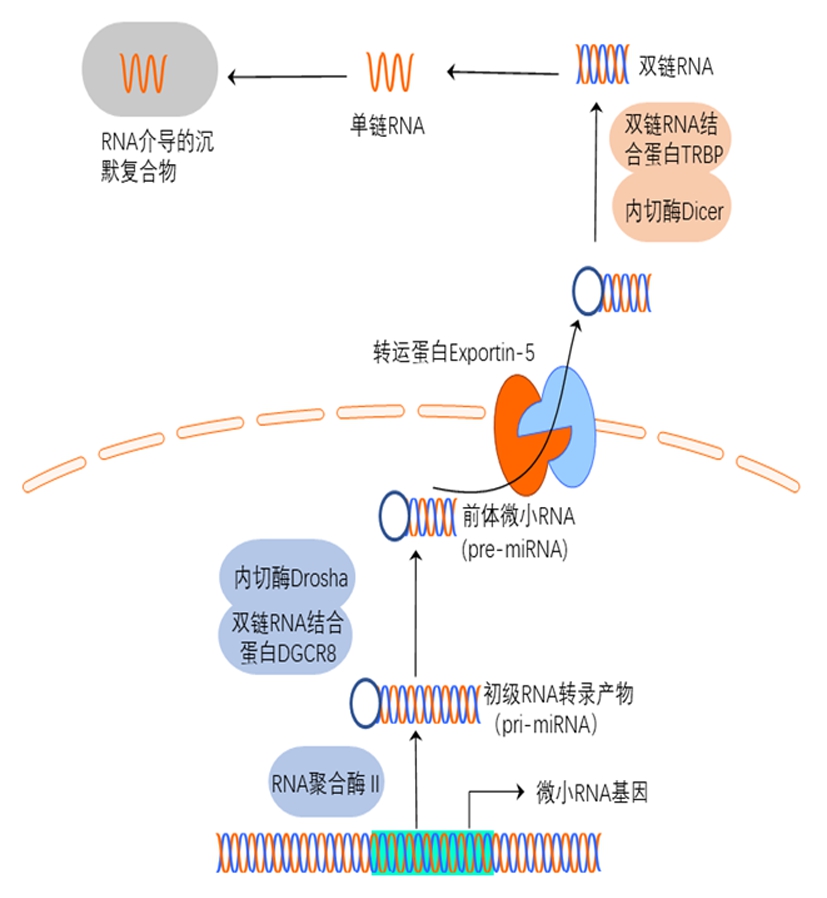
图1 微小RNA加工过程
1 发现与表达
miR-137最初的研究主要是在哺乳动物细胞中鉴定功能性的miRNA及其组织特异性。从9种成年小鼠的心脏、肝脏、小肠、结肠、皮质、小脑和中脑等组织中克隆出不同组织特异性的miRNA,其中包括miR-137在内的34种miRNA在中脑皮质组织中被特异性鉴定出。在人类和啮齿动物的组织中也表达miR-137及其它共超过250种miRNA。
miR-137表达在神经干细胞和大脑的许多区域,包括杏仁体、海马脑区、眶前额叶皮层、伏隔核、前扣带皮质、背外侧前额叶皮质、尾状核、壳核和丘脑,且在杏仁体和海马脑区的表达量最高。与正常人相比,精神分裂症患者背外侧前额叶皮层的miR-137表达水平显著降低。
2 甲基化调控与其靶基因
miR-137是基因表达的重要调节因子,靶基因超过1 000个,目前通过蛋白质印迹、荧光素酶检测等方法已验证了约5%的靶基因,这些靶基因涉及细胞周期、神经发育、增殖分化等多种生理功能[3]。miR-137也可以调节表观遗传机制中基因的表达。
miR-137是经典的长23 nt的非编码RNA,由MIR137HG基因编码,该基因上游2.5 kb的启动子区域内有大量的CpG岛,表明miR-137的表达可能会受到甲基化的调控。在许多癌细胞中,DNA启动子区域高度甲基化会抑制miR-137的表达。在黑色素瘤细胞系中,甲基化抑制剂(5-aza-dC)或组蛋白去乙酰化酶抑制剂能恢复miR-137的表达水平。类似的,在非小细胞肺癌中miR-137表达下调,抑制DNA甲基化可以恢复miR-137的表达水平。除此之外,在口腔鳞状细胞癌、胶质母细胞瘤、结直肠癌、胃癌和头颈部鳞状细胞癌中,miR-137的表达受到DNA甲基化沉默。miR-137在成年大鼠的神经干细胞中受到DNA甲基化结合蛋白MeCP2与转录因子Sox2的调控。在胚胎神经干细胞中,miR-137受到核受体转录因子核受体无尾蛋白(tailless X,TLX)和组蛋白去甲基化酶赖氨酸特异性脱甲基酶1(lysinespecificdemethylase1,LSD1)的调节,TLX可招募LSD1并与其形成复合物,结合在miR-137基因组上以抑制pre-miR-137的转录。有趣的是,LSD1也是miR-137的靶基因,miR-137对LSD1的抑制作用能促进自身表达。miR-137与LSD1、TLX形成负反馈调节,以确保其表达维持在适当的水平(图2)。
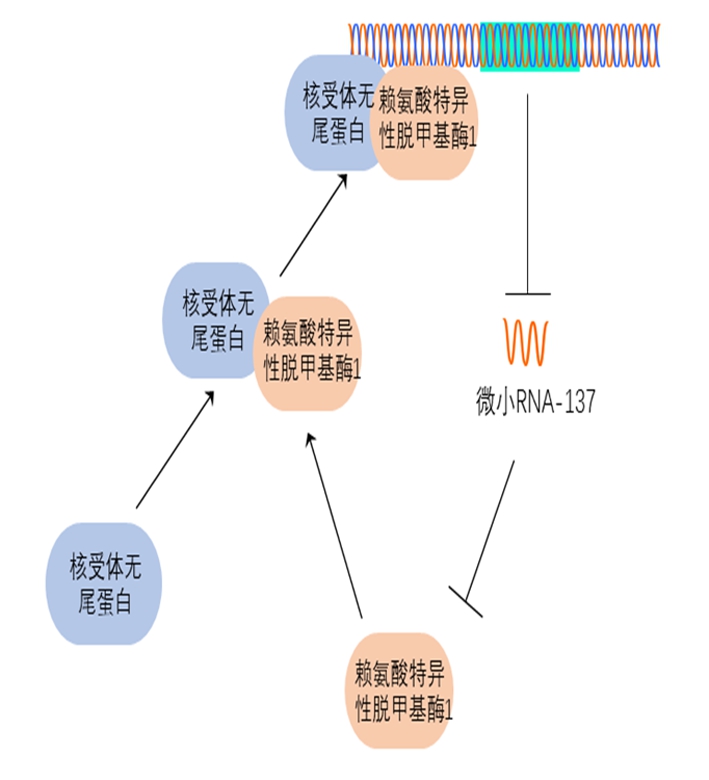
图2 核受体无尾蛋白,赖氨酸特异性脱甲基酶1与微小RNA-137的负反馈调节
miR-137还参与调节表观遗传途径中相互作用。zeste基因增强子同源物2(enhancer of zeste homolog 2,Ezh2)是组蛋白甲基化的重要工具酶(H3K27甲基转移酶),也是多梳蛋白家族(polycomb group,PcG)的核心部分,PcG蛋白通过维持特定靶基因的沉默,使一些基因具有细胞或组织特异性。在神经干细胞中,过表达miR-137能抑制Ezh2的表达,造成抑制性组蛋白标记(H3K27me3)显著减少,且miR-137对Ezh2的负调控也抑制肝癌细胞的转移与侵袭[4]。Jarid1b是去甲基化酶,是miR-137的靶标,可以去掉组蛋白H3K4的甲基化位点,该甲基化位点通过抑制RNA聚合酶抑制基因转录。在急性淋巴细胞白血病中,miR-137的表达水平下调导致Jarid1b的异常表达,这可能是诱发该疾病的原因之一[5]。因此,miR-137在表观遗传的调控中起着重要的作用,miR-137的失调可能会影响表观遗传。
3 功 能
miRNA几乎在所有组织中都发挥调控正常生理功能的作用。在神经干细胞中,miR-137过表达会抑制细胞周期,进而抑制细胞增殖,同时开启干细胞的分化过程。miR-137通过抑制细胞周期蛋白依赖性激酶(如CDK6)封闭神经干细胞从G1期向S期的过渡,同时通过上文提到的负反馈调节环下调LSD1基因进而抑制胚胎神经干细胞增殖,促进细胞分化。此外,miR-137还可以通过靶标Jarid1b促进小鼠胚胎干细胞的分化。miR-137在细胞的有丝分裂间期被表达,在胚胎干细胞向神经细胞分化的阶段表达上调,抑制miR-137靶标的胚胎干细胞转录因子Klf4和Tbx3,促进细胞分化。除此之外,miR-137在少突神经胶质瘤来源的干细胞及多形性胶质母细胞瘤来源的干细胞分化过程中也发挥相似的作用。相反,在人神经干细胞中,miR-137靶向Ezh2促进细胞的增殖并抑制细胞分化,在miR-137过表达人神经干细胞中,CDK6蛋白表达量升高。表明miR-137在神经干细胞的分化和增殖过程中发挥重要的作用,miR-137所发挥的作用受环境的调控。
miR-137在神经元成熟和树突形态发生过程中具有重要的调控作用,miR-137过表达抑制树突形态的发生。Mind bomb 1(Mib1)是位于突触后膜上的泛素连接酶,可调节神经元细胞的突触长度,外源Mib1可抑制miR-137过表达造成的影响。miR-137靶标Mib1的3′UTR保守位点,抑制Mib1的转录。miR-137对Mib1的调控过程涉及神经元成熟、树突形态发生、表型成熟和脊柱发育等多个方面。
miR-137还参与神经信号的转导过程。环氧合酶2(cyclooxygenase 2,COX-2)是miR-137的靶基因,表达于皮质、海马区和杏仁体中的兴奋性神经元树突及树突棘中。COX-2作为逆行信使可以促进突触前膜神经递质的释放,此外,COX-2的代谢物前列腺素E2(prostag-landin E2,PGE2)可与突触前膜的EP2/4受体结合,激活cAMP/PKA信号通路和钙依赖性蛋白激酶,增加海马突触中的谷氨酸释放,维持神经信号转导。
miR-137也调控细胞凋亡。miR-137靶向并抑制丝裂原活化蛋白激酶激活的蛋白激酶2,进而抑制炎症反应及细胞凋亡[6]。miR-137对Ezh2的抑制降低H3K27me3水平,进而活化抑癌基因簇蛋白和神经生长因子受体,造成神经母细胞瘤的细胞凋亡。miR-137可以在铁死亡中发挥作用,miR-137可以通过靶标并负调控溶质载体家族1成员5,抑制细胞内脂质过氧化物与铁离子含量的增加,进而抑制erastin诱导的黑色素瘤细胞铁死亡[7]。表明miR-137在细胞增殖、分化、细胞死亡中均发挥重要作用。
4 精神疾病
miR-137与神经干细胞的增殖分化、神经元成熟、树突形态发生及神经信号转导均有着密不可分的关系,且miR-137表达水平在正常人和精神分裂症患者体内存在差异。miR-137与精神性疾病很有可能存在极大关联。miR-137与抑郁症、精神分裂症、亨廷顿舞蹈病、自闭症息息相关。
4.1 抑郁症 miRNA在抑郁症中具有重要的调控作用。最近研究发现,在卒中后抑郁大鼠模型中,miR-137具有抗抑郁作用。与对照组相比,抑郁大鼠脑和外周血中miR-137水平显著低于对照组,注射拮抗剂可上调miR-137表达水平,改善卒中后抑郁大鼠行为,说明miR-137通过与Grin2A mRNA的3′UTR结合,抑制Grin2A蛋白表达,发挥抑制卒中后抑郁的作用。敲除miR-137的小鼠前脑中Ezh2的表达升高,且敲除Ezh2能改善小鼠抑郁症状[8]。此外,在抑郁自杀受试者前额叶皮质中,miR-137的表达下调。
CACNA1C是miR-137的靶基因,编码电压依赖的L型钙离子通道α1C亚单位,基因组水平研究表明其和精神分裂症、双相情感障碍、抑郁症、自闭症等精神性疾病相关[9-10]。1C亚单位可与细胞膜的去极化偶联,造成膜对钙离子的通透性增加,导致细胞内信号通路的活化。损害该过程会造成抑郁症等精神疾病的发生。表明miR-137在抗抑郁症方面具有重要的作用。
4.2 精神分裂症 精神分裂症是一种严重的且具有遗传性的精神性疾病。在基因组水平上miR-137可能靶标4个与精神分裂症相关的基因:T细胞因子4(T cell factor-4,TCF-4)、CACNA1C、CSMD1(CUB and Sushi multiple domains 1)和C10orf26,这些基因是miR-137的靶基因。TCF-4是一个调控感觉门控通道的核转录因子,过表达TCF-4的老鼠表现出精神分裂症相关的症状,且精神分裂症患者体内的TCF-4水平与miR-137呈负相关。CSMD1是一种单次跨膜蛋白,目前单核苷酸多态性的相关研究证明了CSMD1与精神分裂症的密切关系。
锌指蛋白804A是miR-137的另一个靶基因,与精神分裂症密切相关。锌指蛋白804A具有C2H2型锌指结构域,通过与精神分裂症相关靶基因(PRSS16、COMT、PDE4B、DRD2)的结合促进靶基因的转录。多巴胺受体D2(recombinant dopamine receptor D2,DRD2)是锌指蛋白804A的靶基因之一,中脑边缘的多巴胺神经系统的过度活跃会造成DRD2的过度活化,进而诱发幻觉、妄想等症状,而抗精神病药物DRD2阻断剂可以减轻精神分裂症的症状。锌指蛋白804A的另一个靶基因儿茶酚-O-甲基转移酶(catechol-o-methyl transferase,COMT)通过甲基化选择性降解前额皮质突触中的多巴胺,当COMT受到抑制时,过量的多巴胺可能导致精神分裂症。此外,miR-137通过调控PI3K-Akt-mTOR途径改变神经发育,导致精神分裂症[11]。
miR-137的靶基因主要涉及长时程调节(long-term potentiation,LTP)、ephrin(Eph)受体、轴突导向及突触功能。LTP影响突触间信息传递的效率,是学习与记忆基础的主要分子机制;Eph受体及其配体参与神经网络、神经管和轴旁中胚层的形成及细胞迁移;轴突导向使神经细胞轴突沿正确的路径到达目标区域;miR-137通过调控突触发生、突触结构影响突触功能,这些过程与精神分裂症的发生密切相关[12]。这些结果表明miR-137可能通过调控神经网络及相关发病基因在精神分裂症中起着重要作用。
此外,miR-137单核苷酸多态性(single nucleotide polymorphism,SNP)与精神分裂症具有最强的相关性。Rs1625579位于miR-137基因下游的8 kb区域,与精神分裂症的发病及相关症状有着很大的联系,miR-137可能是精神分裂症的重要调控因子。
4.3 亨廷顿舞蹈症 亨廷顿舞蹈症是一种无法治愈的神经退行性疾病,亨廷顿蛋白的突变会导致细胞核内神经元限制性沉默因子(repressor element-1 silencing transcription factor,REST)表达上调,而后抑制多种miRNA的转录。此外,在亨廷顿舞蹈症中存在转录失调,使许多神经特异性miRNA表达明显受到抑制。通过ChIP-Seq图谱预测,miR-137在内的多种miRNA可能是REST的靶基因,miRNA的转录抑制是由REST直接介导,且敲除REST可挽救此转录失调。表明miR-137等miRNA的抑制与亨廷顿舞蹈症存在很大的联系,且miR-137可能成为亨廷顿舞蹈症的新的治疗靶点[13]。
4.4 自闭症 miR-137与自闭症相关。miR-137特异性靶向RORa的3′UTR区域并对其进行调控。RORa是一种新发现的、与自闭症相关的基因,可作为转录因子发挥作用,其靶基因细胞色素P450芳香化酶、17β-羟基类固醇脱氢酶X型、肌醇三磷酸受体1、神经连接蛋白1和酪氨酸激酶受体TrKB等均与自闭症的易感性相关。
SH3和多锚蛋白重复结构域3(SH3 and multiple ankyrin repeat domains protein 3,SHANK3)参与突触形成并影响突触的正常功能,表达于突触前膜的轴突蛋白1(neurexin1,NRXN1)是自闭症与精神分裂症的易感基因,NRXN1影响大脑结构和认知功能,提高患精神分裂症和自闭症的风险,SHANK3和NRXN1均是miR-137的靶基因。人类miR-137基因位点的SNP与自闭症的发生存在较大关联,且MIR137HG的微缺失已证实与自闭症相关[14]。因此,miR-137在自闭症中的调控作用对该疾病的治疗具有重要意义。
5 癌 症
miR-137参与许多细胞增殖、分化及细胞凋亡的过程,在黑色素癌、多形性胶质母细胞瘤中同样具有调控癌细胞增殖、分化、侵袭作用,此外miR-137还会影响一些癌细胞的耐药性。
5.1 黑色素瘤 黑色素瘤是一种病死率极高的皮肤癌,对化疗药物具有很强的耐药性。miR-137是黑色素瘤的抑制剂,通过靶标小眼畸形相关转录因子(microphthalmia-associated transcription factor,MITF)、Ezh2、c-Met、Y-盒结合蛋白1(Y-box binding protein 1,YB1)等多种靶基因抑制黑色素瘤的增殖。在黑色素瘤中,MITF是一个重要的癌基因,与黑色素瘤的耐药性息息相关。在正常的黑素细胞中,MITF是重要的转录因子。MITF通过调控抗凋亡蛋白Bcl-2、凋亡抑制蛋白ML-IAP、酪氨酸酶相关蛋白促进黑色素瘤对化疗药物的抗性。内源性miR-137在黑色素瘤细胞中表达下调,过表达的miR-137对MITF和CDK6有抑制作用,抑制癌细胞的增殖分化。此外,从良性痣到黑色素瘤,Ezh2的表达逐渐增加,且Ezh2介导的表观遗传与黑色素瘤的生长、增殖、转移高度相关。miR-137对Ezh2的调控作用,或许可以成为新的治疗黑色素瘤的方向。
羧基末端结合蛋白1(C-terminal binding protein1,CtBP1)作为抑制因子可以抑制多种抑癌基因的表达,而miR-137特异性靶标CtBP1的3′UTR抑制CtBP1的表达。表明miR-137与黑色素瘤的增殖、转移及其耐药性息息相关,因此miR-137的研究为解决黑色素瘤的耐药性问题提供了新思路。
5.2 肺癌 肺癌是全球范围内影响健康问题的主要原因之一,其发病率和病死率逐年升高,其中非小细胞肺癌约占85%[15]。在非小细胞肺癌中,miR-137的表达量明显下调,且miR-137下调与其在肺癌中的启动子高度甲基化有关,通过抑制DNA甲基化回补内源性miR-137。miR-137靶标并下调细胞分裂周期蛋白42(cell division cycle 42,Cdc42)、CDK6的水平,抑制细胞增殖并诱导细胞周期停滞。桩蛋白作为黏着斑的重要组成部分,不仅参与整合蛋白介导的信号转导和黏着斑组装,在细胞黏附和迁移过程中发挥重要作用。类固醇受体辅激活因子3(steroid receptor coactivator-3,SRC-3)是一类与转录激活相关的蛋白辅助因子,通过与一些特定的转录因子结合调控机体的生长发育、能量代谢、细胞增殖、存活及迁移等过程。在非小细胞肺癌中,miR-137还可以靶标并抑制转化生长因子α、桩蛋白及SRC-3的表达,进而抑制细胞增殖过程及转移能力[16-17]。由原癌基因c-kit编码的KIT是属于Ⅲ型跨膜酪氨酸激酶受体家族的Ⅰ型跨膜糖蛋白,其异常表达与多种肿瘤发生密切相关。研究表明KIT与非小细胞肺癌的多种耐药性相关,而miR-137通过下调KIT抑制小细胞肺癌的增殖并削弱其耐药性。
索拉菲尼是第1种用于系统性治疗晚期肝癌的药物,可以显著延长肝癌患者的生存期。在索拉菲尼耐药的肝癌细胞(Huh7-R)中,腺嘌呤核苷酸转运子2(adenine nucleotide translocator 2,ANT2)表达上调,其过表达促进索拉非尼耐药性。miR-137过表达可抑制Huh7-R细胞的ANT2蛋白水平,并且逆转Huh7-R细胞的索拉非尼耐药性[18]。MIR137HG基因多态性与中国黎族人群肝癌易感性有关,因此miR-137与肺癌的增殖、转移及耐药性息息相关,对其深入研究对解决肺癌的耐药性及治疗癌症有重大意义[19]。
5.3 胶质母细胞瘤 miR-137在胶质母细胞瘤中表达量降低,而外源性miR-137可以抑制胶质母细胞瘤的增殖与侵袭。COX-2在许多肿瘤中都过表达,miR-137通过下调COX-2抑制胶质母细胞瘤的增殖与侵袭。miR-137靶向并调控表皮生长因子受体,抑制多形性胶质母细胞瘤的细胞增殖并加速细胞凋亡[20]。在多形性胶质母细胞瘤中,CDK6也是miR-137的靶标之一,miR-137通过抑制CDK6进而诱导多形性胶质母细胞瘤细胞G0/G1细胞周期停滞。miR-137在胶质母细胞瘤中作为肿瘤抑制因子起作用,抑制胶质母细胞瘤的增殖与生长,促进细胞凋亡。
5.4 结直肠癌 miR-137通过直接靶向Cdc42来抑制结肠直肠癌细胞的增殖、侵袭,并诱导细胞周期停滞发挥肿瘤抑制作用,且高度甲基化导致的miR-137沉默是结直肠癌发生的早期事件[21]。在结直肠癌中,一些miRNA(miR-124、miR-137和miR-340)可以改变丙酮酸激酶同工酶(pyruvate kinase M,PKM)基因的表达(由高表达PKM2转变为高表达PKM1),高比例的PKM1/PKM2可抑制癌细胞糖酵解速率,通过消除癌细胞的Warburg效应(癌细胞中异常的糖代谢行为)而抑制结直肠癌生长。此外,在结直肠癌中,桩蛋白也是miR-137的靶标之一,miR-137对桩蛋白的抑制可以明显抑制肿瘤细胞的增长、侵袭和转移。与正常结肠干细胞相比,结肠癌干细胞的miR-137表达下调,双肾上腺皮质激素样激酶1与miR-137含量呈负相关。荧光素酶测定和免疫印迹分析表明,miR-137通过抑制双肾上腺皮质激素样激酶1表达抑制不受控制的细胞增殖与结肠癌干细胞的致瘤性。
5.5 其他癌症 上调内源性的miR-137可以抑制胰腺癌细胞的生长、转移,并提高其对5-氟尿嘧啶等化学药物的敏感性。在胰腺癌细胞系中,多效生长因子是miR-137的靶标,通过siRNA敲除多效生长因子可造成PANC-1和MIA PaCa-2细胞转移能力降低。FXYD家族是一类跨膜蛋白,具有离子通道或调节离子通道的作用,在骨肉瘤细胞中,miR-137通过靶标并抑制包含FXYD氨基酸链的离子转运调节因子成员6(FXYD6)进而抑制骨肉瘤细胞的生长、增殖与转移。在子宫内膜癌中,miR-137的过表达能抑制癌细胞的增殖及癌细胞群落的形成[22]。星形胶质细胞升高的基因1(astrocyte elevated gene-1,AEG-1)是在多种人类癌症中过表达的致癌基因,miR-137通过抑制AEG-1发挥肿瘤抑制剂作用,导致细胞周期停滞,抑制细胞生长与克隆。此外,miR-137在胃癌中靶标Cdc42,作为肿瘤抑制因子发挥作用。在口腔鳞状细胞癌中,miR-137发挥控制细胞周期的作用,且其启动子区域同样受到高度甲基化的调控。
6 结 论
miR-137在正常的生理过程中发挥重要作用,如调节神经发育成熟、突触形成、细胞周期、细胞增殖、细胞分化和细胞凋亡等。同时,miR-137也与精神分裂症、自闭症、抑郁症、亨廷顿舞蹈症的发生发展存在很大联系,miR-137在许多癌症中抑制肿瘤的增殖、转移、侵袭,促进细胞程序性死亡,并增加癌细胞对化疗药物的敏感性。值得注意的是,精神疾病通常会成为癌症的并发症之一。30%~35%癌症患者产生焦虑、抑郁、认知障碍或谵妄等精神疾病,且癌症的类型和时期可影响精神疾病的种类及程度[23]。肝癌、肺癌患者早期、中期抑郁情况严重,宫颈癌、前列腺癌患者后期抑郁情况严重[24]。对miR-137功能、分子机制及靶基因的深入研究对伴有精神疾病并发症的癌症患者而言是个福音。
目前,虽然可以通过生物信息学预测大量miR-137靶基因,但只有一小部分被研究证实,这表明对miR-137分子机制及功能的了解还不够全面。因此,对miR-137下游靶基因的研究,有助于理解miR-137在肿瘤与精神疾病中的确切作用,miR-137下游靶基因也极有可能成为治疗疾病的药物靶点。此外,miR-137作为肿瘤抑制因子,在许多癌症中表达下调,而miR-137启动子区域CpG岛的甲基化会使其失活,表明miR-137甲基化调控有望成为治疗癌症、精神疾病的新方法。
[1] 张瑞涛,史惠蓉,刘哲颖,等.卵巢上皮性癌组织中miR-338-3p的表达[J].郑州大学学报(医学版),2019,54(5):780-783.
[2] Alamoudi AA,Alnoury A,Gad H. miRNA in tumour metabolism and why could it be the preferred pathway for energy reprograming[J]. Brief Funct Genomics,2018,17(3):157-169.
[3] Mahmoudi E,Cairns MJ. MiR-137:an important player in neural development and neoplastic transformation[J]. Mol Psychiatry,2017,22(1):44-55.
[4] Huang B,Huang M,Li Q. MiR-137 suppresses migration and invasion by targeting EZH2-STAT3 signaling in human hepatocellular carcinoma[J]. Pathol Res Pract,2018,214(12):1980-1986.
[5] Huang Y,Zou Y,Zheng R,et al. MiR-137 inhibits cell proliferation in acute lymphoblastic leukemia by targeting JARID1B[J]. Eur J Haematol,2019,103(3):215-224.
[6] Gao L,Dai C,Feng Z,et al. MiR-137 inhibited inflammatory response and apoptosis after spinal cord injury via targeting of MK2[J].J Cell Biochem,2018,119(4):3280-3292.
[7] Luo M,Wu L,Zhang K,et al. miR-137 regulates ferroptosis by targeting glutamine transporter SLC1A5 in melanoma[J]. Cell Death Differ,2018,25(2):1457-1472.
[8] Yan HL,Sun XW,Wang ZM,et al. MiR-137 deficiency causes anxiety-like behaviors in mice[J]. Front Mol Neurosci,2019,12:260.
[9] Fatima A,Farooq M,Abdullah U,et al. Genome-wide supported risk variants in MIR137,CACNA1C,CSMD1,DRD2,and GRM3contribute to schizophrenia susceptibility in pakistani population[J]. Psychiatry Investig,2017,14(5):687-692.
[10] Khalid M,Driessen TM,Lee JS,et al. Association of CACNA1C with bipolar disorder among the Pakistani population[J]. Gene,2018,664:119-126.
[11] Thomas KT,Anderson BR,Shah N,et al. Inhibition of the schizophrenia-associated microRNA miR-137 disrupts nrg1α neurodevelopmental signal transduction[J]. Cell Rep,2017,20(1):1-12.
[12] He E,Lozano MAG,Stringer S,et al. MIR137 schizophrenia-associated locus controls synaptic function by regulating synaptogenesis,synapse maturation and synaptic transmission[J]. Hum Mol Genet,2018,27(11):1879-1891.
[13] Saraiva C,Esteves M,Bernardino L. MicroRNA:basic concepts and implications for regeneration and repair of neurodegenerative diseases[J]. Biochem Pharmacol,2017,141:118-131.
[14] Thomas KT,Gross C,Bassell GJ. MicroRNAs sculpt neuronal communication in a tight balance that is lost in neurological disease[J]. Front Mol Neurosci,2018,11:455.
[15] 李婷,边莉.microRNAs在肺癌中的相关研究及进展[J].昆明医科大学学报,2017,38(7):130-135.
[16] Liu X,Chen L,Tian XD,et al.MiR-137 and its target TGFA modulate cell growth and tumorigenesis of non-small cell lung cancer[J]. Eur Rev Med Pharmacol Sci,2017,21(3):511-517.
[17] Chen R,Zhang Y,Zhang C,et al. miR-137 inhibits the proliferation of human non-small cell lung cancer cells by targeting SRC3[J]. Oncol lett,2017,13(5):3905-3911.
[18] Lu AQ,Lv B,Qiu F,et al. Upregulation of miR-137 reverses sorafenib resistance and cancer-initiating cell phenotypes by degrading ANT2 in hepatocellular carcinoma[J]. Oncol Rep,2017,37(4):2071-2078.
[19] Wang C,Zhuang X,Xu J,et al. Variants of MIR137HG genes are associated with liver cancer risk in chinese li population[J]. Onco Targets Ther,2020,13:1809-1818.
[20] Zhang Z,Song X,Tian H,et al. MicroRNA-137 inhibits growth of glioblastoma through EGFR suppression[J]. Am J Transl Res,2017,9(3):1492-1499.
[21] Chu PC,Lin PC,Wu HY,et al. Mutant KRAS promotes liver metastasis of colorectal cancer,in part,by upregulating the MEK-Sp1-DNMT1-miR-137-YB-1-IGF-IR signaling pathway[J]. Oncogene,2018,37(25):3440-3455.
[22] Zhang W,Chen JH,Shan T,et al. miR-137 is a tumor suppressor in endometrial cancer and is repressed by DNA hypermethylation[J]. Lab Invest,2018,98(11):1397-1407.
[23] Caruso R,Nanni MG,Riba MB,et al. The burden of psychosocial morbidity related to cancer: patient and family issues[J]. Int Rev Psychiatry,2017,29(5):389-402.
[24] 刘海涛,赵外荣,张伟强,等.肿瘤患者并发抑郁的调查研究[J].昆明医科大学学报,2019,40(11):142-146.