主动脉夹层(aortic dissection,AD)是临床上常见的主动脉疾病,病理学特征为主动脉中层出现囊样退行性改变,其年发病率为2.6~3.6/10万,若治疗不及时,约有90%患者在1年内死亡,严重威胁患者生命健康[1]。急性肺损伤(acute lung injury,ALI)是AD常见的严重并发症之一,病死率高,并直接影响AD患者预后[2]。AD常伴有严重炎症反应,而C反应蛋白(C-reactive protein,CRP)是重要炎性标记物,有研究报道CRP在AD患者血清中表达水平升高[3]。单核细胞趋化蛋白1(monocyte chemotactic protein-1,MCP-1)是趋化性细胞因子,能促进肺部炎症反应及肺纤维化[4]。基质金属蛋白酶9(matrix metalloproteinase-9,MMP9)能降解AD患者主动脉壁细胞外基质(extracellular matrix,ECM),促进血管重构,是AD早期诊断标志物[5]。但关于CRP、MCP-1、MMP9在AD合并ALI患者血清中表达水平及相关性研究报道较少。因此,本研究旨在探讨AD合并ALI患者血清CRP、MCP-1、MMP9表达水平及相关性,寻找ALI早期诊断生物标记物。
1 资料与方法
1.1 一般资料 选取2016年10月-2019年3月邯郸市中心医院收治的AD患者92例,其中发生ALI患者42例为ALI组,无发生ALI患者50例为非ALI组,选取同期体检健康者50例为对照组。ALI组男性32例,女性10例;年龄40~65岁,平均(48.43±4.25)岁;Stanford 分型为A型19例,B型23例;合并症为合并高血压者24例,合并糖尿病者9例。非ALI组男性34例,女性16例;年龄42~64岁,平均(47.35±2.70)岁;Stanford分型为A型22例,B型28例;合并症为合并高血压者28例,合并糖尿病者11例。对照组男性36例,女性14例,年龄41~68岁,平均(48.96±4.05)岁。3组受试者性别、年龄、Stanford分型和合并症比较差异均无统计学意义(P>0.05),具有可比性。
本研究经医院伦理委员会审核批准。所有受试者均知情并签署知情同意书。
1.2 纳入标准与排除标准 纳入标准:①经动脉CT血管成像确诊为AD;②符合ALI诊断标准[6]:急性起病,氧合指数≤300 mmHg(1 mmHg=0.133 kPa),肺动脉嵌顿压<18 mmHg即为ALI。排除标准:①合并心脏功能衰竭者;②合并肺炎、间质性肺炎等呼吸系统疾病者;③合并肺癌及其他部位恶性肿瘤者;④近期内使用抗炎药或激素类药物者;⑤合并严重肝、肾功能障碍者。
1.3 样本采集 受试者入院后采集早晨空腹肘静脉血5 mL于离心管中,室温静止20 min,2 800 r/min,离心10 min,取上清,-80 ℃冻存备用待检。
1.4 检测方法 酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)检测血清CRP、MCP-1、MMP9、白细胞介素6(interleukin-6,IL-6)、IL-10、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)水平,CRP、MCP-1、MMP9、IL-6、IL-10、TNF-α试剂盒均购自武汉博士德生物工程有限公司,全自动酶标仪购自美国赛默飞世尔公司。具体步骤如下:①稀释标准品,酶标板上设置待检样品孔、标准品孔和空白孔,各孔加入对应样品,混匀,37 ℃孵育40 min;②洗涤液反复洗板4~5次,吸水纸上拍干;③加一抗工作液(空白孔除外),混匀,37 ℃孵育20 min;④洗涤液反复洗板4~5次,吸水纸上拍干;⑤各孔均加入酶标二抗工作液,混匀,37 ℃孵育10 min;⑥洗涤液反复洗板4~5次,吸水纸上拍干;⑦各孔均加入底物工作液,37 ℃避光反应15 min;⑧各孔均加终止液终止反应;⑨采用酶标仪在450 nm处检测,计算各待检样品浓度。
1.5 统计学方法 应用SPSS 18.0统计软件分析数据。计量资料比较采用单因素方差分析和SNK-q检验,计数资料比较采用χ2检验,相关性分析采用Pearson相关性分析,预测CRP、MCP-1、MMP9对ADALI的诊断价值采用受试者工作特征曲线(receiver operating characteristic curve,ROC曲线)。P<0.05为差异有统计学意义。
2 结 果
2.1 3组血清CRP、MCP-1、MMP9水平比较 非ALI组和ALI组血清CRP、MCP-1、MMP9水平均高于对照组,ALI组高于非ALI组,差异均有统计学意义(P<0.05)。见表1。
表1 3组血清CRP、MCP-1、MMP9水平比较
Table 1 Comparison of serum CRP,MCP-1 and MMP9 levels in three groups ![]()
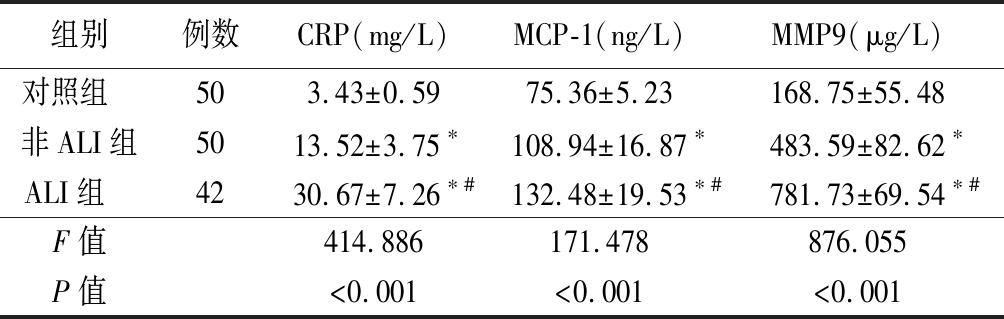
组别例数CRP(mg/L)MCP-1(ng/L)MMP9(μg/L)对照组 503.43±0.5975.36±5.23168.75±55.48非ALI组5013.52±3.75∗108.94±16.87∗483.59±82.62∗ALI组 4230.67±7.26∗#132.48±19.53∗#781.73±69.54∗#F值414.886171.478876.055P值<0.001<0.001<0.001
*P值<0.05与对照组比较 #P值<0.05与非ALI组比较(SNK-q检验)
2.2 3组患者炎症因子比较 非ALI组和ALI组血清IL-6、TNF-α水平均高于对照组,ALI组均高于非ALI组;非ALI组和ALI组血清IL-10均低于对照组,且ALI组低于非ALI组,差异均有统计学意义(P<0.05)。见表2。
表2 3组患者血清IL-6、IL-10、TNF-α水平比较
Table 2 Comparison of serum levels of IL-6,IL-10 and TNF-alpha in three groups ![]()
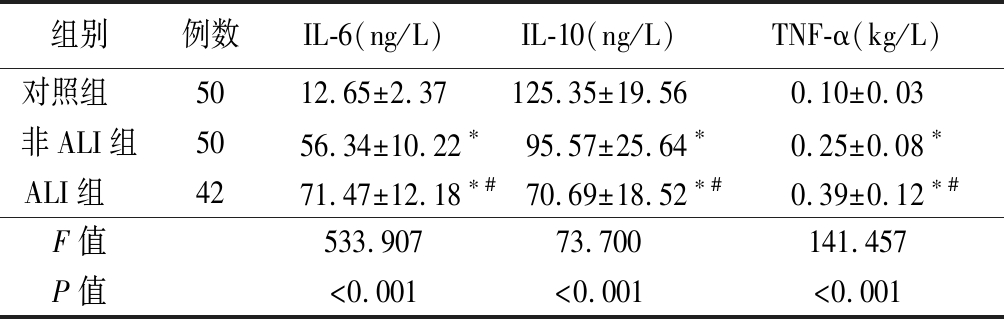
组别例数IL-6(ng/L)IL-10(ng/L)TNF-α(kg/L)对照组 5012.65±2.37125.35±19.560.10±0.03非ALI组5056.34±10.22∗95.57±25.64∗0.25±0.08∗ALI组 4271.47±12.18∗#70.69±18.52∗#0.39±0.12∗#F值533.90773.700141.457P值<0.001<0.001<0.001
*P值<0.05与对照组比较 #P值<0.05与非ALI组比较(SNK-q检验)
2.3 ALI组血清CRP、MCP-1、MMP9表达相关性 通过Pearson相关性分析显示,ALI组血清CRP与MCP-1、MMP9呈正相关性(r=0.827,P<0.001;r=0.868,P<0.001),MCP-1与MMP9呈正相关性(r=0.741,P<0.001)。
2.4 血清CRP、MCP-1、MMP9对ALI患者诊断价值 分别以ALI组血清CRP、MCP-1、MMP9表达水平绘制ROC曲线显示,CRP的AUC为0.856,截断值>26.85 mg/L,诊断敏感度为66.70%,特异度为88.00%,95%CI:0.768~0.921,约登指数为0.5467;MCP-1的AUC为0.769,截断值>122.57 ng/L,诊断敏感度为69.00%,特异度为76.00%,95%CI:0.670~0.851,约登指数为0.4505,MMP9的AUC为0.884,截断值>651.87 μg/L,诊断敏感度为81.00%,特异度为90.00%,95%CI:0.801~0.942,约登指数为0.7095,三者联合检测的AUC为0.930,诊断敏感度为83.30%,特异度为90.00%,95%CI:0.857~0.972,约登指数为0.7333。
3 讨 论
AD是威胁生命的严重心血管急症之一,高血压、动脉粥样硬化、胸主动脉瘤、创伤、感染等皆为其发病危险因素,随着高血压发病率不断升高,其发病率呈明显增加趋势[7]。AD病变广泛,可累及心、肾、肺等多个器官,而ALI发生可明显增加AD治疗风险,且易引发患者术后呼吸衰竭,导致预后不良[8]。因此,如何预防及治疗AD合并ALI成为当今心血管科医生面临的难点和急需解决的问题。
CRP、MCP-1、MMP9均为临床常见的炎症标记物物。CRP又称为急性期反应蛋白,由肝细胞合成分泌,当机体受微生物侵入、组织损伤等刺激时,机体内CRP急剧增加,可反应患者炎症程度和炎症组织活动性,是一种非特异性、临床应用广泛的炎症反应标记物。有研究报道AD患者肺氧合损伤和机体凝血功能紊乱、炎症反应相关,CRP水平越高,患者肺氧合损伤过程中炎症反应越严重,预后较差[9]。MCP-1为典型的C-C家族趋化因子,其能趋化及激活单核/巨噬细胞、淋巴细胞向炎症部位聚集,促进血管生成,气道平滑肌增生,肺纤维化发生,广泛参与局部损伤及炎症反应[10]。MMP9是一种蛋白水解酶,其能降解ECM中的Ⅳ型胶原、Ⅴ型胶原及明胶,即可降解肺毛细血管ECM和基底膜,破坏肺泡-毛细血管屏障,增加肺毛细血管通透性,引起肺水肿,导致肺损伤形成[11]。Liao等[12]研究显示MMP9在动脉夹层患者单核细胞中表达升高,并经miR-320调节干扰动脉夹层发育。本研究结果显示,ALI组、非ALI组血清CRP、MCP-1、MMP9水平均高于对照组,且ALI组明显高于非ALI组,与Wu等[13]研究结果相似,提示AD合并ALI患者血清CRP、MCP-1、MMP9水平升高,即存在严重系统炎症反应。进一步分析显示,ALI组、非ALI组血清IL-6、TNF-α水平均高于对照组,ALI组高于非ALI组;ALI组、非ALI组IL-10低于对照组,且ALI组低于非ALI组,与Vianello等[14]研究结果相似,提示AD合并ALI患者出现炎症和抗炎平衡失调。IL-6、TNF-α为促炎因子,IL-10为抗炎因子,IL-10表达可抑制IL-6、TNF-α表达,减轻炎症反应[15]。通过相关性分析显示,ALI患者血清CRP与MCP-1、MMP9呈正相关性,MCP-1与MMP9呈正相关性,与赖永坤等[16]研究相似,提示血清CRP、MCP-1、MMP9可能通过相互协同作用参与AD合并ALI患者发生发展。可能是AD患者发生系统性炎症反应,CRP水平上升,加重炎症反应,导致血液中MCP-1与MMP9浓度增加,通过肺循环参与肺损伤,同时随着MCP-1与MMP9水平升高进一步加重肺损伤程度,加重炎症反应。
本研究与李懿等[17]研究结果相似,提示血清CRP、MCP-1、MMP9对AD合并ALI均有较高敏感度和特异度,而三者联合诊断高敏感度和特异度更高,对AD合并ALI预测具有较高临床价值。
综上所述,本研究通过对AD合并ALI患者血清CRP、MCP-1、MMP9水平检测结果显示,患者血清CRP、MCP-1、MMP9水平升高,3者呈正相关性,有明显炎症反应,CRP、MCP-1、MMP9联合诊断敏感度和特异度都较高,对AD合并ALI具有较高诊断价值。由于本研究样本量有限,单中心研究,研究结果可能具有一定误差,在进一步研究中尽可能扩大样本量,开展多中心研究,以验证三者联合检测对AD合并ALI诊断价值。
[1] 任怡辉,刘芬,周欣荣,等.APACHEⅡ评分对A型急性主动脉夹层患者院内死亡的预测价值[J].临床心血管病杂志,2018,34(1):61-65.
[2] Ren W,Wang Z,Wu Z,et al. JAK2/STAT3 pathway was associated with the protective effects of IL-22 on aortic dissection with acute lung injury[J]. Dis Markers,2017,2017:1917804.
[3] 刘群,张琦.CRP、IL-6在AD患者血清中的表达情况及其价值分析[J].国际检验医学杂志,2017,38(17):2426-2428.
[4] Di Stefano A,Coccini T,Roda E,et al. Blood MCP-1 levels are increased in chronic obstructive pulmonary disease patients with prevalent emphysema[J]. Int J Chron Obstruct Pulmon Dis,2018,13:1691-1700.
[5] Wu Z,Ruan Y,Chang J,et al. Angiotensin Ⅱ is related to the acute aortic dissection complicated with lung injury through mediating the release of MMP9 from macrophages[J]. Am J Transl Res,2016,8(3):1426-1436.
[6] Niu X,Liu F,Li W,et al. Cavidine ameliorates lipopolysaccharide-induced acute lung injury via NF-κB signaling pathway in vivo and in vitro[J]. Inflammation,2017,40(4):1111-1122.
[7] 肖子亚,王豪俊,姚晨玲,等.主动脉夹层患者多层螺旋CT血管成像表现及其与院内死亡的关系[J].中华心血管病杂志,2017,45(3):217-222.
[8] 许志锋.主动脉夹层患者肾素-血管紧张素系统功能紊乱与急性肺损伤研究进展[J].中国心血管病研究,2017,15(3):204-207.
[9] 侯小东,丁凡,尤涛,等.炎性反应与急性A型主动脉夹层术前并发肺损伤的相关性[J].实用医学杂志,2017,33(15):2532-2535.
[10] 石惠荣,王德伟,赵丹丹,等.大株红景天注射液对不稳定型心绞痛患者经皮冠状动脉介入术后血清MCP-1、hsCRP的影响[J].河北医科大学学报,2015,36(10):1125-1128.
[11] 肖归,王桂良,陈广文,等.HSF1对LPS诱导的急性肺损伤小鼠的保护作用及其相关差异表达基因的筛选[J].中国病理生理杂志,2017,33(11):2073-2077,2083.
[12] Liao M,Zou S,Bao Y,et al. Matrix metalloproteinases are regulated by MicroRNA 320 in macrophages and are associated with aortic dissection[J]. Exp Cell Res,2018,370(1):98-102.
[13] Wu Z,Wang Z,Xu P,et al. A novel finding:macrophages involved inflammation participated in the acute aortic dissection complicated with acute lung injury[J]. Curr Mol Med,2017,17(8):568-579.
[14] Vianello E,Dozio E,Barassi A,et al. A pilot observational study on magnesium and calcium imbalance in elderly patients with acute aortic dissection[J]. Immun Ageing,2017,14:1.
[15] 曾昭凡,武金才,戚悠飞,等.炎症反应与急性主动脉夹层肺损伤相关性研究[J/CD].中国血管外科杂志(电子版),2018,10(3):183-187.
[16] 赖永坤,吕伟标,李锦荣.血清S1OOB,MCP-1,COX-2及hs-CRP与急性冠脉综合征的相关性分析[J].标记免疫分析与临床,2016,23(6):672-675.
[17] 李懿,侯旭阳,吴益蓉,等.Caveolin-1/MCP-1/IL-12在LPS诱导的急性肺损伤模型中的作用[J].湖南师范大学学报(医学版),2018,15(2):9-13.