骨组织可持续再生,但在病理状态下这种自我修复能力会被降低。糖尿病等疾病破坏骨转换平衡,导致骨组织再生障碍,骨修复能力受损,骨微结构异常而易于发生脆性骨折[1]。骨髓间充质干细胞(bone marrow derived mesenchymal stem cells,BMSCs)具有多向分化潜能,可分化为成骨细胞、成软骨细胞、脂肪细胞、神经细胞等[2],其向成骨细胞分化能力在骨质疏松症发病中具有重要意义。BMSCs分化方向受多种因素调节,尤其是转录后调节因子。其中,具有盘状同源区域结合序列的转录共活化因子(transcriptional coactivator with PDZ-binding motif,TAZ)具有广泛生物学功能,参与调节BMSCs成骨-成脂分化平衡[3]。TAZ通过结合Runt相关转录因子2(runt related transcription factor 2,RUNX2)促进成骨分化,或结合过氧化物酶体增生物激活受体γ(peroxisome proliferator activated receptorγ,PPARγ)抑制成脂分化[4-5]。作为胰岛素通路的枢纽因子,胰岛素受体底物1(insulin receptor substrate 1,IRS-1)在糖尿病、骨质疏松症中的作用举重若轻。目前,关于IRS-1对BMSCs分化的影响尚有争议。据报道,IRS-1胞内蓄积有利于细胞向成软骨方向分化[6]。也有其他学者认为,IRS-1是细胞分化的抑制因子[7-8]。据此,本研究将进一步探索IRS-1/TAZ信号转导调节BMSCs向成骨细胞分化的潜在机制,为干细胞分化调控程序提供新靶点。报告如下。
1 材料与方法
1.1 实验动物 3月龄SPF级雌性未受孕SD(Sprague Dawley)大鼠15只,用于动物实验;4周龄SD大鼠9只,用于BMSCs的原代培养。实验动物购于河北医科大学实验动物中心,动物合格证书号 1708080。
1.2 动物分组及骨质疏松模型的构建 将15只3月龄SD大鼠随机分为对照组、假手术组、去卵巢手术(ovariectomy,OVX)组,每组5只。去卵巢手术操作步骤如下:大鼠禁食禁水12 h后,对其进行麻醉,于俯卧位对大鼠卵巢进行定位,消毒手术部位,依次剪开皮肤、肌肉及筋膜,分离脂肪团,手术结扎输卵管,完整切除双侧卵巢,止血并逐层缝合。假手术组仅切除卵巢等体积大小脂肪组织,保留卵巢。术后3 d内连续应用抗生素预防感染。术后12周用于后续实验。
1.3 大鼠BMSCs的原代培养及成骨分化 将4周龄SD大鼠CO2麻醉后处死,用75%乙醇浸泡5 min。在无菌条件下取双侧股骨,剪除股骨近端骨骺,用5 mL注射器吸取DMEM培养基反复冲洗骨髓腔,用1 mL注射器反复抽吸制成细胞悬液。细胞取出后,以5×106/cm2的密度接种于含12%胎牛血清及1%青链霉素的DMEM培养基中,放入细胞培养箱中培养。原代细胞达到80%融合后传代,P3代细胞用于后续实验。应用成骨诱导培养基(DMEM含12%胎牛血清,1%青链霉素,10 nmol/L地塞米松,10 mmol/L β-甘油磷酸和50 mg/L抗坏血酸)诱导BMSCs向成骨细胞分化。
1.4 微型电脑断层成像(micro-computed tomography,μCT)分析 取SD大鼠股骨,用4%多聚甲醛固定,4 ℃,24 h。应用高分辨率μCT (SkyScan,1176)对股骨进行扫描分析(65 kv,153 μA),分辨率9.0 μm/pixel。应用重建软件(NRecon,v1.6,SkyScan)、数据分析软件(CTAn,v1.9,SkyScan)和三维模型可视化软件(CTVol,v2.0,SkyScan)对扫描图像进行处理和分析。分析指标包括骨小梁体积分数(bone volume fraction,BV/TV),骨小梁厚度(trabecular thichness,Tb.Th)和骨小梁分离度(trabecular separation,Tb.Sp)。
1.5 免疫荧光分析 取SD大鼠股骨,用4%多聚甲醛固定,4 ℃,24 h;0.5 mol/L乙二胺四乙酸脱钙3周,4 ℃,摇床;应用8%明胶包埋,制作20 μm冰冻切片。将冰冻切片于37 ℃烘干,浸泡于PBS液15 min,5% BSA封闭1 h,一抗孵育(抗大鼠IRS-1,Abcam),4 ℃,过夜;TBST清洗,荧光二抗孵育1 h,TBST清洗,DAPI封片。采用Image J软件对荧光强度进行统计分析。
1.6 质粒转染 课题组在前期实验中已经自行构建IRS-1高表达质粒(pCMV-IRS-1)[9]。本实验构建了分别用于敲除IRS-1和TAZ表达的质粒,即嵌入敲除IRS-1表达的小干扰RNA(SiIRS-1)的质粒,和嵌入敲除TAZ表达的小干扰RNA(SiTAZ)的质粒(上海吉凯基因化学有限公司)。应用脂质体3 000(Thermo)对BMSCs进行转染。细胞转染24 h后,更换为成骨诱导培养基进行培养。同时为上述实验设立对照,未进行质粒转染组设置为“空白对照组”,转染空白质粒组作为“阴性对照组”。
1.7 茜素红染色 将细胞接种至35 mm塑料培养皿中,成骨诱导基培养14 d。PBS清洗2次,4%多聚甲醛室温固定20 min。蒸馏水清洗3次后,0.1%茜素红染色,37 ℃,30 min。蒸馏水清洗3次后,显微镜下拍照。然后,应用10%氯化十六烷基吡啶对茜素红进行脱色,室温,30 min。应用酶标仪(562 nm)读取其吸光度值。
1.8 蛋白免疫印迹(Western blot) 将细胞接种至60 mm塑料培养皿中,成骨诱导基培养3 d。利用RIPA裂解液提取蛋白。应用12% SDS-PAGE胶对蛋白进行电泳分离后,采用半干法将其转移至PVDF膜。5%牛奶封闭,37 ℃,室温。一抗孵育(抗TAZ,Cell Signaling;抗RUNX2,Boster;抗骨钙蛋白(osteocalcin,OCN),Boster;抗GAPDH,Bioworld),4 ℃,过夜。二抗37 ℃孵育1 h。应用image J软件分析蛋白条带灰度值,并计算目的蛋白与内参蛋白条带灰度值的比值。
1.9 统计学方法 应用SPSS 20.0统计软件分析数据。计量资料比较采用单因素方差分析和SNK-q检验。P<0.05为差异有统计学意义。
2 结 果
2.1 不同组别大鼠股骨μCT和IRS-1免疫荧光染色比较 采用μCT对大鼠股骨的松质骨相关指标进行分析,结果显示,3组间BV/TV值、Tb.Th值、Tb.Sp值差异有统计学意义(P<0.05);OVX组BV/TV值、Tb.Th值低于对照组和假手术组,Tb.Sp值高于对照组和假手术组,差异有统计学意义(P<0.05);对照组和假手术组BV/TV值、Tb.Th值、Tb.Sp值差异无统计学意义(P>0.05)。采用免疫荧光染色定量分析大鼠股骨IRS-1的表达量,结果显示,3组间IRS-1+荧光强度百分比差异有统计学意义(P<0.05);OVX组IRS-1+荧光强度百分比低于对照组和假手术组,差异有统计学意义(P<0.05);对照组和假手术组IRS-1+荧光强度百分比差异无统计学意义(P>0.05)。见图1,表1。
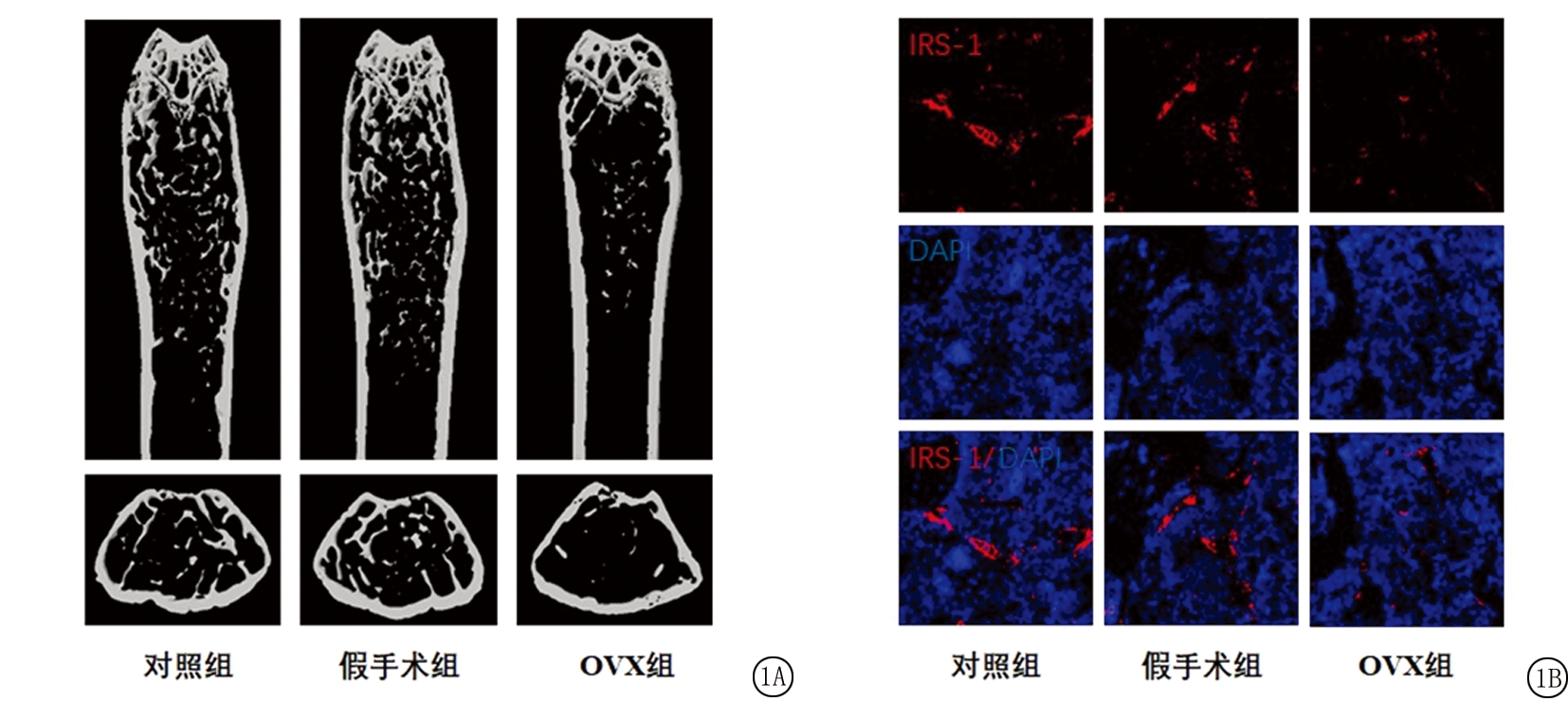
图1 不同组别大鼠股骨μCT结果和IRS-1荧光染色的比较
A.不同组别大鼠股骨μCT比较;B.不同组别大鼠股骨IRS-1比较(荧光染色 ×200)
Figure 1 The μCT results of rat femurs and IRS-1 immunofluorescence results in different groups
表1 不同组别大鼠股骨μCT定量分析和IRS-1
免疫荧光染色定量分析比较
Table 1 The quantitative analysis of μCT results of rat femurs and IRS-1 immunofluorescence results in different groups ![]()
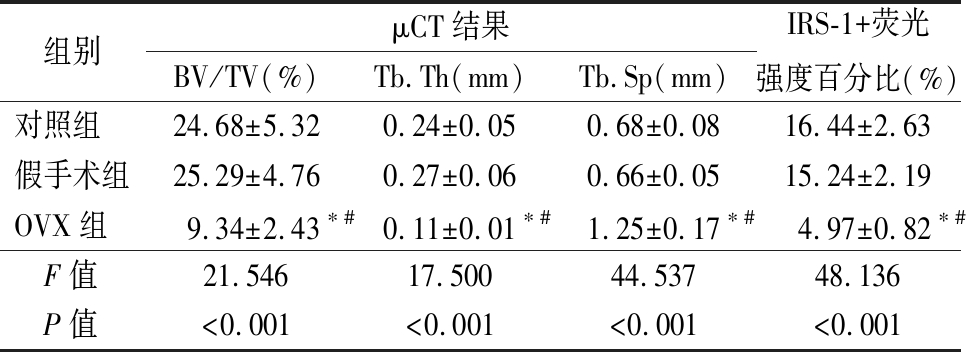
组别μCT结果BV/TV(%)Tb.Th(mm)Tb.Sp(mm)IRS-1+荧光强度百分比(%)对照组24.68±5.320.24±0.050.68±0.0816.44±2.63假手术组25.29±4.760.27±0.060.66±0.0515.24±2.19OVX组9.34±2.43∗#0.11±0.01∗#1.25±0.17∗#4.97±0.82∗# F值21.54617.50044.53748.136 P值<0.001<0.001<0.001<0.001
*P值<0.05与对照组比较 #P值<0.05与假手术组比较(SNK-q检验)
2.2 IRS-1基因高表达对茜素红染色结果和成骨分化相关蛋白表达的影响 BMSCs成骨诱导14 d后,对其进行茜素红染色,结果显示,应用pCMV-IRS-1转染后,IRS-1组BMSCs的钙结节明显多于空白对照组和阴性对照组(图2A)。进一步对茜素红吸光度进行定量分析后发现,3组间茜素红吸光度差异有统计学意义(P<0.05);IRS-1组茜素红吸光度高于空白对照组和阴性对照组,差异有统计学意义(P<0.05);空白对照组和阴性对照组茜素红吸光度差异无统计学意义(P>0.05)。BMSCs成骨诱导3 d后,采用Western blot方法分析成骨分化相关蛋白TAZ、RUNX2、OCN的表达水平,结果显示,IRS-1组TAZ、RUNX2、OCN的表达量明显高于空白对照组和阴性对照组(图2B)。进一步对蛋白条带灰度值进行定量分析后发现,3组间TAZ、RUNX2、OCN的表达量差异有统计学意义(P<0.05);IRS-1组TAZ、RUNX2、OCN的表达量高于空白对照组和阴性对照组,差异有统计学意义(P<0.05);空白对照组和阴性对照组TAZ、RUNX2、OCN的表达量差异无统计学意义(P>0.05)。见图2,表2。
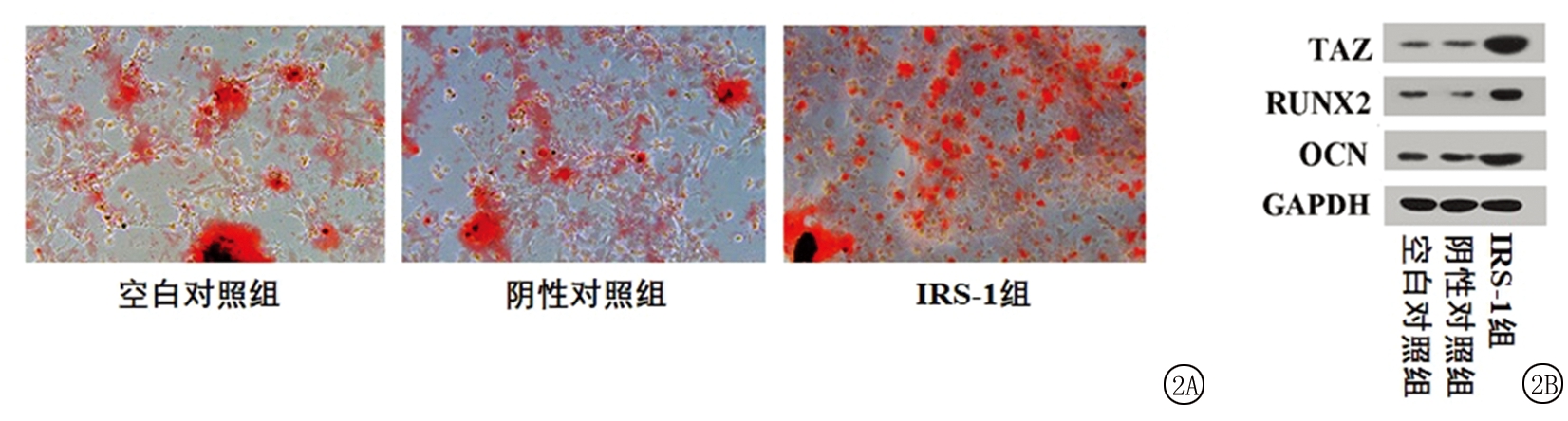
图2 IRS-1基因高表达对茜素红染色结果和成骨分化相关蛋白表达的影响
A.IRS-1基因高表达对茜素红染色结果的影响(×200);B.IRS-1基因高表达对成骨分化相关蛋白表达的影响
Figure 2 The effects of high expression of IRS-1 mRNA on alizarin red staining results and the expression of osteogenic differentiation related proteins
表2 IRS-1基因高表达对茜素红染色和TAZ、RUNX2、OCN表达影响的定量分析 Table 2 The quantitative analysis of the effects of high expression of IRS-1 mRNA on alizarin red staining results and the expression of osteogenic differentiation related proteins ![]()
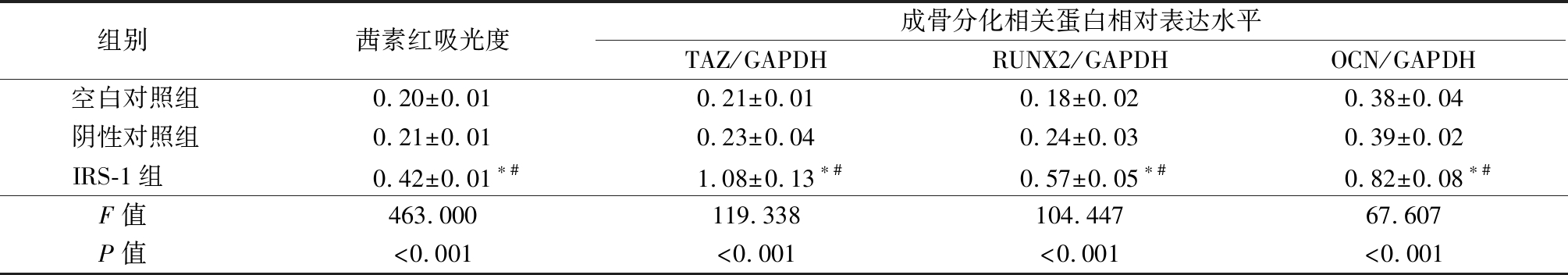
组别 茜素红吸光度成骨分化相关蛋白相对表达水平TAZ/GAPDHRUNX2/GAPDHOCN/GAPDH空白对照组0.20±0.010.21±0.010.18±0.020.38±0.04阴性对照组0.21±0.010.23±0.040.24±0.030.39±0.02IRS-1组 0.42±0.01∗#1.08±0.13∗#0.57±0.05∗#0.82±0.08∗#F值 463.000119.338104.44767.607P值 <0.001<0.001<0.001<0.001
*P值<0.05与空白对照组比较 #P值<0.05与阴性对照组比较(SNK-q检验)
2.3 IRS-1或TAZ基因敲除对茜素红染色结果和成骨分化相关蛋白表达的影响 茜素红染色结果提示, SiIRS-1组和SiTAZ组的钙结节明显少于空白对照组和阴性对照组(图3A)。进一步对茜素红吸光度进行定量分析后发现,4组间茜素红吸光度差异有统计学意义(P<0.05);SiIRS-1组和SiTAZ组茜素红吸光度低于空白对照组和阴性对照组,差异有统计学意义(P<0.05);空白对照组和阴性对照组、SiIRS-1组和SiTAZ组差异无统计学意义(P>0.05)。Western blot结果显示,SiIRS-1组和SiTAZ组TAZ、RUNX2、OCN的蛋白表达量明显低于空白对照组和阴性对照组(图3B)。进一步对蛋白条带灰度值进行定量分析后发现,4组间TAZ、RUNX2、OCN的表达量差异有统计学意义(P<0.05);SiIRS-1组和SiTAZ组TAZ、RUNX2、OCN的表达量低于空白对照组和阴性对照组,差异有统计学意义(P<0.05);空白对照组和阴性对照组、SiIRS-1组和SiTAZ组间TAZ、RUNX2、OCN的表达量差异无统计学意义(P>0.05)。见表3。
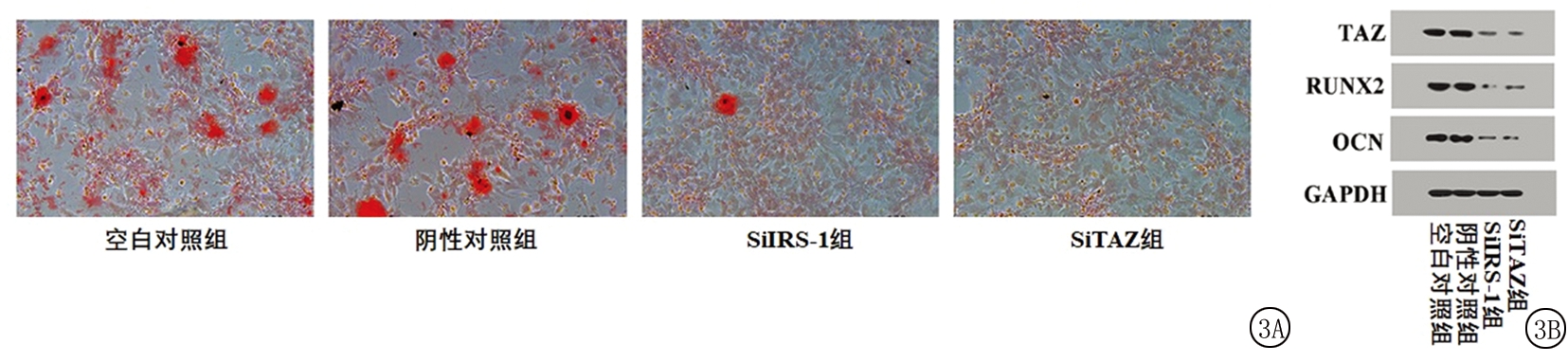
图3 IRS-1或TAZ基因敲除对茜素红染色结果和成骨分化相关蛋白表达的影响
A.IRS-1或TAZ基因敲除对茜素红染色结果的影响(×200);B.IRS-1或TAZ基因敲除对成骨分化相关蛋白表达的影响
Figure 3 The effects of IRS-1 or TAZ knockout on alizarin red staining results and the expression of osteogenic differentiation related proteins
表3 IRS-1或TAZ基因敲除对茜素红染色和TAZ、RUNX2、OCN表达影响的定量分析
Table 3 The quantitative analysis of the effects of IRS-1 or TAZ knockout on alizarin red staining results and the expression of osteogenic differentiation related proteins ![]()
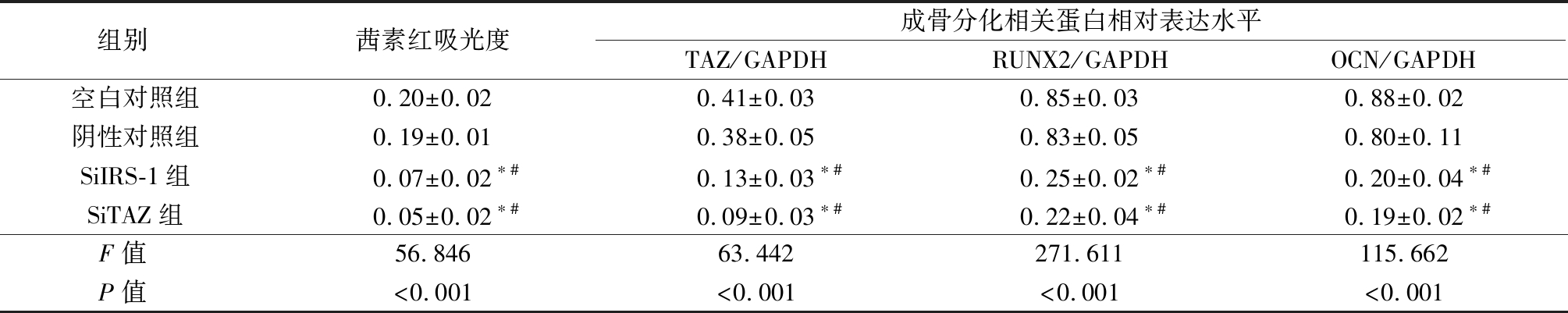
组别 茜素红吸光度成骨分化相关蛋白相对表达水平TAZ/GAPDHRUNX2/GAPDHOCN/GAPDH空白对照组0.20±0.020.41±0.030.85±0.030.88±0.02阴性对照组0.19±0.010.38±0.050.83±0.050.80±0.11SiIRS-1组0.07±0.02∗#0.13±0.03∗#0.25±0.02∗#0.20±0.04∗#SiTAZ组0.05±0.02∗#0.09±0.03∗#0.22±0.04∗#0.19±0.02∗#F值 56.84663.442271.611115.662P值 <0.001<0.001<0.001<0.001
*P值<0.05与空白对照组比较 #P值<0.05与阴性对照组比较(SNK-q检验)
3 讨 论
骨质疏松症是一种以骨形成受损、骨吸收增加为特征的骨代谢疾病,骨量降低、骨微结构损害,骨折风险明显增加。近来,学者发现基因修饰干细胞可促进BMSCs向成骨细胞分化,改善骨细胞功能,在来源上增加骨形成[10]。同时,体外培养BMSCs在骨生理学研究领域广为应用,可作为干细胞基因修饰的种子细胞。本研究结果显示,IRS-1和TAZ之间存在相互作用,这种相互作用是调节BMSCs向成骨细胞定向分化的潜在机制,是联络糖尿病和骨质疏松症的关键因素,可作为基因修饰干细胞治疗的新靶点。
IRS-1是胰岛素信号转导的船坞蛋白,在胰岛素受体结合SH2结构蛋白中起锚定作用。同时,IRS-1本身含有21个酪氨酸磷酸化位点,可直接与SH2结构蛋白结合,进而激活下游信号通路[11]。此外,IRS-1还包含丝氨酸/苏氨酸残基,可被丝氨酸/苏氨酸蛋白激酶磷酸化,抑制胰岛素受体酪氨酸蛋白激酶活性,进而参与调节细胞增殖、生长、分化等多种功能[12]。近来,研究发现IRS-1在成骨细胞和软骨细胞中表达,而不在破骨细胞表达[13-14]。进一步研究,IRS-1基因特异性敲低小鼠表现为成骨分化抑制,成骨细胞数量减少,导致骨形成率降低[15]。可见,IRS-1不仅是胰岛素抵抗的候选基因,在骨代谢中的作用也不容忽视。但是,目前关于IRS-1对细胞分化的作用尚存争议。IRS-1是一种细胞分化抑制因子。Xi等[16]体内外实验发现,敲低IRS-1减少p53/Kruppel样因子4复合体形成,促进血管平滑肌细胞增殖和分化。与此相反,多数学者认为IRS-1是一种细胞分化促进因子[17]。这可能是因为,不同细胞类型中,IRS-1对细胞分化的作用不尽相同。成肌细胞中研究发现,IRS-1是成肌细胞分化的必需因子,敲低IRS-1成肌细胞分化减少[18]。本研究部分结果表明,IRS-1是间充质干细胞成骨分化的必需因子,敲低IRS-1则TAZ表达下调,成骨分化抑制;过表达IRS-1则TAZ表达上调,成骨分化加强。
另一方面,本研究还发现了IRS-1和TAZ之间的密切联系。TAZ是调节BMSCs成骨-成脂分化平衡的关键因子。最初,TAZ作为14-3-3结合蛋白被发现,其89位丝氨酸位点磷酸化后可以与14-3-3结合,进而阻滞于细胞质[19]。TAZ在哺乳动物广泛表达,与Yes相关蛋白(Yes-associated protein,YAP)有约50%同源性,且在拓扑结构上十分相似[20]。TAZ和YAP一样具有转录激活功能,最先发现TAZ可分别与成骨分化关键转录因子RUNX2及成脂分化关键转录因子PPARγ结合,激活RUNX2转录,抑制PPARγ转录活性,从而促进成骨分化而抑制成脂分化,即调节干细胞定向分化[21]。本研究首次发现了IRS-1和TAZ之间的相互作用,这种相互作用可能是IRS-1促进BMSCs向成骨细胞分化的潜在机制。
综上所述,IRS-1可通过上调TAZ表达,促进BMSCs向成骨细胞分化。IRS-1/TAZ可能作为基因修饰干细胞治疗糖尿病骨质疏松症的新靶点。
[1] Paschou SA,Dede AD,Anagnostis PG,et al. Type 2 Diabetes and osteoporosis: a guide to optimal management[J]. J Clin Endocrinol Metab,2017,102(10):3621-3634.
[2] Wang B,Wen H,Smith W,et al. Regulation effects of melatonin on bone marrow mesenchymal stem cell differentiation[J]. J Cell Physiol,2019, 34(2):1008-1015.
[3] Totaro A,Castellan M,Di Biagio D,et al. Crosstalk between YAP/TAZ and notch signaling[J]. Trends Cell Biol,2018,28(7):560-573.
[4] Jang EJ,Jeong H,Kang JO,et al. TM-25659 enhances osteogenic differentiation and suppresses adipogenic differentiation by modulating the transcriptional co-activator TAZ[J]. Br J Pharmacol,2012,165(5):1584-1594.
[5] Xiong J,Almeida M,O'Brien CA. The YAP/TAZ transcriptional co-activators have opposing effects at different stages of osteoblast differentiation[J]. Bone,2018,112:1-9.
[6] Longobardi L,Granero-Molto F,O′Rear L,et al. Subcellular localization of IRS-1 in IGF-I-mediated chondrogenic proliferation, differentiation and hypertrophy of bone marrow mesenchymal stem cells[J]. Growth Factors,2009,27(5):309-320.
[7] Contaldo C,Myers TJ,Zucchini C,et al. Expression levels of insulin receptor substrate-1 modulate the osteoblastic differentiation of mesenchymal stem cells and osteosarcoma cells[J]. Growth Factors,2014,32(1):41-52.
[8] Teitelbaum SL. Stem cells and osteoporosis therapy[J]. Cell Stem Cell,2010,7(5):553-554.
[9] Ma H,Ma JX,Xue P,et al. Osteoblast proliferation is enhanced upon the insulin receptor substrate 1 overexpression via PI3K signaling leading to down-regulation of NFkappaB and BAX pathway[J]. Exp Clin Endocrinol Diabetes,2015,123(2):126-131.
[10] Xue P,Wu X,Zhou L,et al. IGF1 promotes osteogenic differentiation of mesenchymal stem cells derived from rat bone marrow by increasing TAZ expression[J]. Biochem Biophys Res Commun,2013,433(2):226-231.
[11] Gorgisen G,Balci MK,Celik FC,et al. Differential activation and expression of insulin receptor substrate 1 (IRS1) in mononuclear cells of type 2 diabetes patients after insulin stimulation[J]. Cell Mol Biol(Noisy-le-grand), 2016,62(2):25-30.
[12] Peng J,He L. IRS posttranslational modifications in regulating insulin signaling[J]. J Mol Endocrinol,2018,60(1):R1-R8.
[13] Yamaguchi M,Ogata N,Shinoda Y,et al. Insulin receptor substrate-1 is required for bone anabolic function of parathyroid hormone in mice[J]. Endocrinology,2005,146(6):2620-2628.
[14] Guo Y,Tang CY,Man XF,et al. Insulin receptor substrate-1 time-dependently regulates bone formation by controlling collagen Ialpha2 expression via miR-342[J]. FASEB J,2016,30(12):4214-4226.
[15] Granero-Molto F,Myers TJ,Weis JA,et al. Mesenchymal stem cells expressing insulin-like growth factor-I(MSCIGF) promote fracture healing and restore new bone formation in Irs1 knockout mice: analyses of MSCIGF autocrine and paracrine regenerative effects[J]. Stem Cells,2011,29(10):1537-1548.
[16] Xi G,Shen X,Wai C,et al. Hyperglycemia induces vascular smooth muscle cell dedifferentiation by suppressing insulin receptor substrate-1-mediated p53/KLF4 complex stabilization[J]. J Biol Chem,2019,294(7):2407-2421.
[17] Mi L,Chen Y,Zheng X,et al. MicroRNA-139-5p suppresses 3T3-L1 preadipocyte differentiation through notch and IRS1/PI3K/Akt insulin signaling pathways[J]. J Cell Biochem,2015,116(7):1195-1204.
[18] Wang J,Tan J,Qi Q,et al. miR-487b-3p suppresses the proliferation and differentiation of myoblasts by targeting IRS1 in skeletal muscle myogenesis[J]. Int J Biol Sci,2018,14(7):760-774.
[19] Kanai F,Marignani PA,Sarbassova D,et al. TAZ:a novel transcriptional co-activator regulated by interactions with 14-3-3 and PDZ domain proteins[J]. EMBO J,2000,19(24):6778-6791.
[20] Fullenkamp CA,Hall SL,Jaber OI,et al. TAZ and YAP are frequently activated oncoproteins in sarcomas[J]. Oncotarget,2016,7(21):30094-30108.
[21] Men T,Piao SH,Teng CB. Regulation of differentiation of mesenchymal stem cells by the Hippo pathway effectors TAZ/YAP[J]. Yi Chuan,2013,35(11):1283-1290.