急性胰腺炎通常由各种病因作用下诱使胰酶过度激活,胰腺局部出现炎症反应特征,患者多见上腹部剧烈疼痛并向背部放射,且伴有腹胀或呕吐[1],属于临床常见急腹症之一。尤其重症急性胰腺炎(severe acute pancreatitis,SAP)因炎症损伤范围较广,病情发展迅速且极为凶险,病死率高达20%~30%,患者往往出现腹腔积液、腹膜刺激征及腰腹部皮下淤斑等典型症状[2]。腹腔积液往往聚集较多炎性介质、血管活性因子与内毒素,是导致多个脏器连带受累的主要诱因之一,目前临床主要通过腹腔引流进行治疗,且由于微创的经皮穿刺技术已应用较为成熟,SAP患者可获益较多[3]。此外,SAP病理过程对人体营养储备损耗较大,故早期肠内营养支持也已成为当前治疗SAP的标准环节,相对肠外营养可提供全面营养素,患者预后改善效果较为理想[4]。然而近年来有较多研究将免疫增强型营养液应用于重症肺炎、胃癌等危症患者肠内营养方案中,均能确保患者肠黏膜屏障与免疫功能获得进一步优化,对提高肠内营养支持的临床疗效有较大助益[5-6],但针对SAP患者的肠内营养方案改良仍报道较少。基于此,本研究旨在分析免疫增强型肠内营养方案联合微创腹腔引流治疗SAP的临床价值,现报告如下。
1 资料与方法
1.1 一般资料 回顾性分析2017年1月—2018年12月期于我院接受治疗的136例SAP患者的临床资料,均常规采用微创腹腔引流在内的综合性治疗措施。根据营养方案不同分为对照组62例(给予普通肠内营养治疗)和联合组74例(采用免疫增强型肠内营养方案)。联合组男性42例,女性32例;年龄29~74岁,平均(49.83±9.59)岁;胆源性35例,酒精性12例,高血脂性23例,其他病因4例;合并腹腔感染40例,腹膜炎34例;急性生理和慢性健康评估系统Ⅱ(Acute Physiology and Chronic Health Evaluation Ⅱ,APACHEⅡ)评分(16.53±3.20)分。对照组男性37例,女性25例;年龄27~73岁,平均(48.20±9.74)岁;胆源性29例,酒精性10例,高血脂性19例,其他病因4例;合并腹腔感染32例,合并腹膜炎30例;APACHEⅡ评分(16.37±3.46)分。2组性别、年龄、疾病类型、并发症、APACHEⅡ评分差异均无统计学意义(P>0.05),具有可比性。
纳入标准:①临床症状、影像学与生化指标检查结果均符合SAP相关诊断标准[7];②年龄18~75岁;③具备腹腔引流治疗指征,腹腔积液≥50 mL且腹腔压力≥15 mmHg(1 mmHg=0.133 kPa),抗生素非手术治疗无效、伴有胰管狭窄/结石/梗阻或合并胰腺坏死、十二指肠梗阻、胆道梗阻、感染;④病程≥48 h;⑤对肠内营养支持疗法与腹腔引流疗法知情同意。排除标准:①合并其他消化系统炎症疾病、肠梗阻、恶性肿瘤、自身免疫性疾病导致的胃肠功能异常或慢性肝肾功能障碍;②有外科手术治疗指征;③近半年内有激素或免疫抑制剂应用史;④因妊娠、瘢痕体质、出血倾向、腹腔广泛粘连而无法行腹腔穿刺;⑤临床资料不完整。
1.2 治疗方法 所有患者确诊后入住重症监护病房(intensive care unit,ICU),常规给予禁食、胃肠减压基础疗法及镇痛、抑酸、胰酶抑制药物治疗,并针对胆源性、高血脂性等病因进行对症处理,超声确认腹腔积液情况,取积液最低位置作为穿刺点,常规消毒铺巾,1%利多卡因表面麻醉,采用7~12 F腹腔一次性引流导管,进行Seldinger穿刺技术置管引流,超声引导下确认针头所处脓腔位置,密切观察引流量及性状,色泽转为淡黄色且引流量<50 mL/d时可拔除引流管;发病后48 h内开展早期肠内营养支持治疗,患者取半坐位,对昏迷患者将床头抬高45 °,采用纽迪希亚制药公司生产的复尔凯螺旋形鼻肠管,液体石蜡将管道外壁进行润滑,床边盲插法将其送入胃腔,变换体位为右侧卧位,并向其胃腔注气以便开放幽门,超声引导下将其头部缓缓送入屈氏韧带下25 cm处,妥善固定管道并撤出导丝。对照组给予肠内营养混悬液(能全力,生产企业 纽迪希亚制药有限公司,规格500 mL,国药准字H20010284),联合组在其基础上加用精氨酸粉剂(生产企业:浙江海力生集团有限公司,规格 10 g,国药准字H20174027)10 g/d、谷氨酰胺颗粒(安凯舒,生产企业 重庆药友制药有限责任公司,规格2.5 g,国药准字H20020054)0.2 g·kg-1·d-1、多烯酸乙酯软胶囊(双鲸,规格0.25 g,国药准字H20003635)0.1 g·kg-1·d-1,将添加剂加入肠内营养混悬液中充分混匀。2组患者均采用克利夫顿营养学公式对日均所需总能量进行计算,换算为对应营养液体积开展喂养,首日喂养总能量剂量减半,喂养时将患者床头抬高30~45 °,初始泵速根据患者耐受情况控制在20~50 mL/h,每次喂养前泵入适量温开水湿润肠道,往后逐日增加25%总能量,2 d后维持总能量不变,逐日根据患者耐受程度适当加大泵速,最高不超过100 mL/h。2组患者均在肠内营养支持1周后观察疗效。
1.3 观察指标 统计2组治疗7 d和治疗30 d时的死亡情况。治疗7 d时有死亡患者,只比较存活患者的各项指标。于治疗前及治疗7 d后常规采集患者静脉血5 mL,4 ℃下凝血反应0.5 h,4 000 r/min离心机处理10 min后,提取上层血清在-70 ℃冰箱冻存,平衡融化后分别采用白蛋白(albumin,Alb)、前白蛋白(prealbumin,PA)、转铁蛋白(transferrin,Tf)、免疫球蛋白(immunoglobulin,Ig)A、IgG、IgM对应试剂盒,严格按照说明书指示,通过免疫比浊法测定上述指标在血清中的浓度水平。回顾病历资料统计基本康复指标:恢复经口进食时间、引流时间、住ICU时间、住院时间。
1.4 统计学方法 应用SPSS 20.0统计学软件处理数据。计量资料比较采用独立样本t检验和配对t检验,计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 2组死亡情况比较 2组7 d病死率差异无统计学意义(P>0.05);联合组30 d病死率低于对照组,差异有统计学意义(P<0.05)。见表1。
表1 2组死亡情况比较
Table 1 Comparison of mortality between two groups (例数,%)
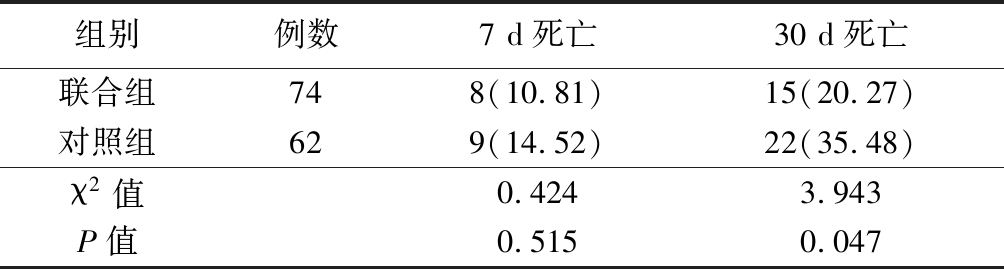
组别例数7 d死亡30 d死亡联合组748(10.81)15(20.27)对照组629(14.52)22(35.48)χ2值0.4243.943P值0.5150.047
2.2 2组血清营养指标比较 治疗前,2组Alb、PA、Tf水平差异无统计学意义(P>0.05);治疗7 d后,2组血清Alb、PA、Tf水平均明显高于治疗前,联合组血清Alb、PA、Tf水平均明显高于对照组,差异有统计学意义(P<0.05),见表2。
表2 2组治疗前后前后血清Alb、PA、Tf水平比较
Table 2 Comparison of levels of serum Alb,PA and Tf before and after treatment between two groups ![]()
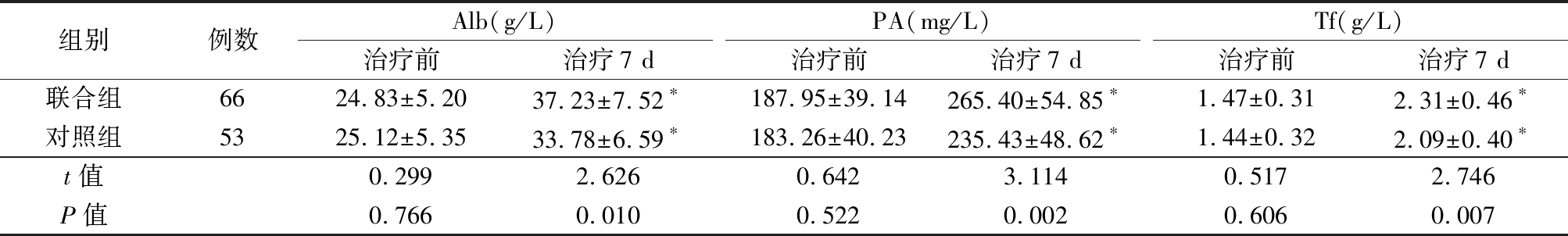
组别例数Alb(g/L)治疗前治疗7 dPA(mg/L)治疗前治疗7 dTf(g/L)治疗前治疗7 d联合组6624.83±5.2037.23±7.52∗187.95±39.14265.40±54.85∗1.47±0.312.31±0.46∗对照组5325.12±5.3533.78±6.59∗183.26±40.23235.43±48.62∗1.44±0.322.09±0.40∗t值0.2992.6260.6423.1140.5172.746P值0.7660.0100.5220.0020.6060.007
*P值<0.05与治疗前比较(配对t检验)
2.3 2组血清体液免疫指标比较 治疗前,2组血清IgA、IgG、IgM水平差异无统计学意义(P>0.05);治疗7 d后,2组血清IgA、IgG、IgM水平均明显高于治疗前,联合组血清IgA、IgG、IgM水平均明显高于对照组,差异有统计学意义(P<0.05),见表3。
表3 2组治疗前后血清IgA、IgG、IgM水平比较
Table 3 Comparison of levels of serum IgA,IgG and IgM before and after treatment between two groups ![]()
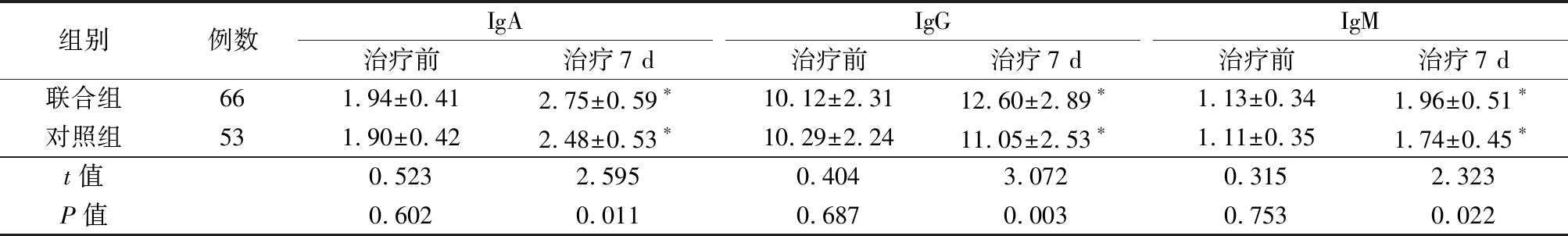
组别例数IgA治疗前治疗7 dIgG治疗前治疗7 dIgM治疗前治疗7 d联合组661.94±0.412.75±0.59∗10.12±2.3112.60±2.89∗1.13±0.341.96±0.51∗对照组531.90±0.422.48±0.53∗10.29±2.2411.05±2.53∗1.11±0.351.74±0.45∗t值0.5232.5950.4043.0720.3152.323P值0.6020.0110.6870.0030.7530.022
*P值<0.05与治疗前比较(配对t检验)
2.4 2组基本康复指标比较 联合组恢复经口进食时间、引流时间、住ICU时间及住院时间均明显短于对照组,差异有统计学意义(P<0.05),见表4。
表4 2组基本康复指标比较
Table 4 Comparison of basic rehabilitation indicators between two groups ![]()
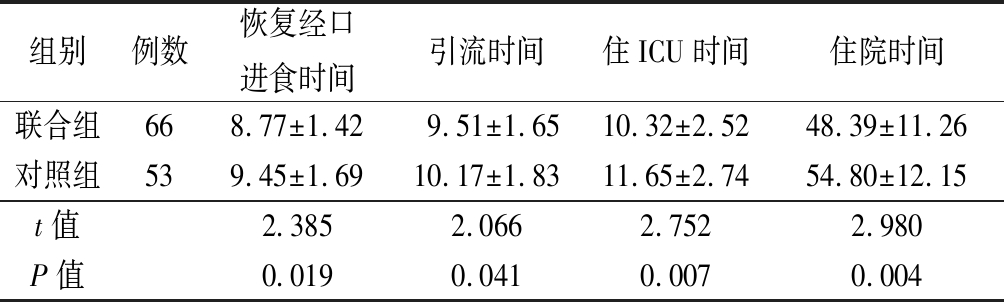
组别例数恢复经口进食时间引流时间住ICU时间住院时间联合组668.77±1.429.51±1.6510.32±2.5248.39±11.26对照组539.45±1.6910.17±1.8311.65±2.7454.80±12.15t值2.3852.0662.7522.980P值0.0190.0410.0070.004
3 讨 论
SAP患者腹腔积液通常为无菌性积液,早期临床并不主张开展腹腔引流术,可规避侵入性操作可能导致的医源性感染,以免病情持续加重,尽管如此,由于渗出液体中富含炎症因子、内毒素等物质,长时间潴留并与血管产生持续性的物质交换,将导致不同部位器官组织受到损伤,仍将对SAP转归产生不利影响[8]。据相关文献报道,随着微创外科技术的不断演进,腹腔引流的安全性也获得一定提升,且借由影像学引导,穿刺操作也更为简便、准确,侵入性操作时间减少,且证实引流导致微生物丧失增殖的有利环境、感染风险进一步降低,有利于SAP患者病情转归[9]。本研究结果显示,联合组恢复进食时间、引流时间、住ICU时间、住院时间均显著短于对照组,表明采用免疫增强型肠内营养方案可进一步缓解SAP患者病情,通过补充相关营养物质直接提高免疫功能,有效控制炎症反应,从而减少腹腔渗液生成,缩短微创腹腔引流持续时间。
SAP患者由于过度代谢导致机体对谷氨酰胺的需求量急剧增加,尤其应激状态下肠黏膜细胞、淋巴细胞与巨噬细胞以谷氨酰胺作为代谢能量来源,导致其储备量严重不足,亟需从外源性途径补充谷氨酰胺[10]。有学者提出,谷氨酰胺能通过为B淋巴细胞转化与浆细胞形成提供核酸合成前体的材料来源,还可增进Ig表达,还将调控T淋巴细胞分化平衡[11],也为巨噬细胞发挥免疫调节功能提供充足的能量来源。本研究结果显示,治疗后,2组患者血清IgA、IgG、IgM水平均显著高于治疗前,联合组提高幅度更大,提示免疫增强型肠内营养支持能通过尽快优化SAP患者免疫系统状态,及时补充足量谷氨酰胺,为免疫应答打下坚实物质基础。小肠黏膜细胞将谷氨酰胺作为应激状态下的唯一能量来源,及时补充可避免产生肠道功能衰竭,并通过增进分泌型IgA合成,直接抑制肠道细菌与相关毒素产生移位,对继发性肠源性败血症有良好预防作用[12]。
正常情况下精氨酸属于典型非必须氨基酸,但对于危症患者而言,可成为机体康复必不可少的必需氨基酸,能通过刺激淋巴细胞发挥免疫抗炎作用,尤其可为术后恢复切口愈合提供较大助益[13]。免疫增强型肠内营养方案可通过为患者补充精氨酸,促进肠黏膜结构与屏障功能尽早恢复正常,SAP患者对肠内营养的耐受性获得提升,且能充分抑制瀑布级联反应扩大化,减少炎症经由血道对其他脏器产生损伤的风险。相关专家表示,外周血游离精氨酸水平<40 μmol/L时,T淋巴细胞转化效率将减低,细胞免疫机制可受到严重影响[14],继发感染性疾病风险增高,对入住ICU的高危患者尤其不利。
多烯酸乙酯富含二十碳五烯酸与二十二碳六烯酸,可改变生物膜磷脂构成比,对细胞膜流动性、受体亲和性与信号传递效率产生直接影响[15],并结合调控前列腺素、白三烯等细胞活性物质亚型表达比例趋于平衡,对增进机体免疫耐受性有利,也能借由激发过氧化酶增殖激活受体活性,抑制局部或广泛存在的炎症反应,加之结合只当算稳定细胞核核因子κB及其抑制蛋白复合体结构,从根本上抑制致炎因子基因表达[16]。本研究结果显示,治疗后,2组血清营养指标均出现显著改善,其中联合组改善效果更佳,且30 d病死率明显低于对照组,表明采用免疫增强型肠内营养方案可调控免疫功能,尽快恢复SAP患者肠道摄取营养效率,并减少病症对机体营养物质的过度损耗,从而优化患者营养状态,为避免病情恶化提供前提条件。李冰清等[17]认为,ω-3多不饱和脂肪酸能减少淋巴细胞因子与单核细胞因子合成,减少细胞表面分子与黏附分子的表达,从而影响上述细胞对抗原的呈递敏感性,促炎因子基因更难以接收到信号,在免疫功能维持基础上,炎症反应可获得大幅抑制。
综上所述,免疫增强型肠内营养支持联合微创腹腔引流治疗SAP患者,可加快其营养状态、免疫功能改善效率,肠道更易于耐受营养液,对提高整体临床疗效有利,有较高临床应用价值。
[1] 徐海峰,李勇,颜骏,等.急性胰腺炎病因与其严重程度的关系[J].中华医学杂志,2014,94(41):3220-3223.
[2] 黄志寅,唐承薇.重症急性胰腺炎内科规范治疗建议[J].临床内科杂志,2014,31(2):138-140.
[3] 杨耀成,黄耿文,李宜雄,等.经皮穿刺置管引流治疗急性胰腺炎合并坏死感染的预后分析[J].肝胆胰外科杂志,2015,27(2):94-96,99.
[4] 陈春华,刘春玲.肠内和肠外营养在重症急性胰腺炎患者早期营养支持中的临床效果研究[J].实用临床医药杂志,2016,20(22):67-69,76.
[5] 宋歌,吕月涛,狄林林,等.免疫肠内营养对重症肺炎病人肠黏膜屏障及免疫功能的影响[J].肠外与肠内营养,2017,24(2):86-89,93.
[6] 王晋喜,赵雷,郭强,等.免疫增强型肠内营养对胃癌患者术后免疫功能影响的Meta分析[J].肿瘤研究与临床,2017,29(6):398-403.
[7] 中华医学会外科学分会胰腺外科学组.慢性胰腺炎诊治指南(2014版)[J].中华消化外科杂志,2015,14(3):173-178.
[8] 秦胜旗.经皮穿刺置管引流术治疗重症急性胰腺炎合并胰腺坏死感染的临床效果[J].肝胆外科杂志,2016,24(3):186-189.
[9] 沈绚丽,杨建锋,楼立兰.经皮穿刺腹腔置管引流治疗重症急性胰腺炎并发腹腔感染的效果分析[J].中华医院感染学杂志,2014,24(6):1491-1493.
[10] 赵丽艳,王萍.早期肠内营养联合谷氨酰胺对老年重症急性胰腺炎营养状况的影响[J].中国老年学杂志,2015,35(12):3361-3362.
[11] 余婷媛,税金凤,李亚男.奥美拉唑联合免疫肠内营养治疗重症急性胰腺炎的临床疗效及对T淋巴细胞亚群和细胞因子的影响[J].解放军医药杂志,2018,30(3):73-76.
[12] 纪晓霞,陆肖娴,鲍洁,等.谷氨酰胺联合早期肠内营养治疗重症急性胰腺炎的临床疗效[J].江苏医药,2016,42(17):1880-1882.
[13] 李素芬,韦江红,李芳莲,等.强化精氨酸肠内营养对口腔头颈部恶性肿瘤病人术后效果的临床研究[J].肠外与肠内营养,2015,22(2):79-81.
[14] 刘佐军,李若凡,齐辉,等.精氨酸和谷氨酰胺对围术期结直肠肿瘤患者免疫功能和营养状况的影响[J].川北医学院学报,2017,32(2):175-177.
[15] Zhang B,Wei G,Li R,et al. N-3 fatty acid-based parenteral nutrition improves postoperative recovery for cirrhotic patients with liver cancer:a randomized controlled clinical trial[J]. Clin Nutr,2016,36(5):1239-1244.
[16] 蔡晨,夏正国,徐庆连,等.ω-3多不饱和脂肪酸对严重烧伤大鼠早期肠黏膜损伤的影响及其机制[J].中华烧伤杂志,2017,33(8):476-480.
[17] 李冰清,钱涛.ω-3脂肪酸肠内营养制剂对神经重症患者C反应蛋白和营养代谢的影响[J].河北医科大学学报,2016,37(7):784-788.