基因增强子和抑制子的鉴定和特性(基因相互作用)是发现基因功能与基因和(或)通路间串扰的一种非常有效的方法。基因增强子是一个基因在另一个突基因的背景下,突变基因的功能降低,加入增强子后该背景下的突变基因功能进一步降低,即增强子基因加重了突变基因的功能,增加了突变基因表型的严重性。在相同培养条件、温度下,当对线虫的基因的增强程度进行评分时,联合作用产生的致死率必须高于任何一个基因单独作用产生的致死率。另一方面,基因减弱子是对一个基因功能降低的减少,可以减轻突变基因的杀伤力或表型。在半数致死量的温度下,加入抑制基因的突变,使致死率降低,该基因即为背景基因的减弱子。秀丽隐杆线虫结构简单、生长周期短、基因与人类基因具有高度同源性、易培养,是研究遗传、基因组和分子网络的重要模式。小头激酶2(minibrain kinase 2,mbk-2)是秀丽隐杆线虫双特异性丝氨酸/苏氨酸蛋白激酶(serine/threonine protein kinase,Yak-1)相关激酶家族中的两种丝氨酸/苏氨酸激酶之一。mbk-2在早期胚胎发育,特别是在单细胞胚胎的多个微管依赖过程中起重要作用,包括原核迁移、纺锤体定位、微管稳定性和染色体分离[1]。研究mbk-2在早期胚胎发育过程中的特殊功能,可通过增强或抑制mbk-2的突变表型表达,观察基因间的遗传相互作用来确定。寻找基因相互作用的有效方法是在携带温度敏感(temperature-sensitive,ts)致死突变的线虫株背景下进行RNAi筛选[2]。前期在纽约大学Patricia G.Cipriani和Fabio Piano实验室做了大规模RNAi的高通量检测筛查线虫的基因,通过使用这种温度敏感性突变株,即ts线虫株,同时减少两个基因的功能,筛查了超过200 000 000对可能的相关基因。其中筛选出了可调控mbk-2表达的增强子rsa基因(regulator of spindle assembly,纺锤体集合调控)[3]。本研究采用秀丽隐杆线虫mbk-2突变体观察rsa基因对mbk-2的调控作用,温度敏感性mbk-2突变株可以在控制温度的情况下调节基因的功能从而控制胚胎致死率。在培养温度敏感性突变线虫时,宽容温度即胚胎致死率很少时的温度,限制温度即100%致死率时的温度。实验将培养温度调整在15 ℃、20 ℃、22.5 ℃和25 ℃。发现对于mbk-2突变株,在25 ℃时致死率为100%,此即该株的限制温度,在15 ℃时未孵化的胚胎数很少,即为该株的宽容温度。在温度敏感性的mbk-2突变株显示出mbk-2蛋白作用在第1次有丝分裂,该ts株显示出mbk-2功能丧失的表现型,当在一个细胞阶段将培养温度上升到限制温度时表现出100%的胚胎致死率。当将胚胎发育为两细胞以后再上升温度至限制温度,则有50%的胚胎存活。当胚胎发育到靶细胞以后的阶段再升高温度至限制温度,显示出100%存活率。
1 材料与方法
1.1 线虫株系与菌株 野生型线虫N2、mbk-2基因敲除型线虫株系、大肠埃希菌OP50购自美国秀丽线虫遗传中心(Caenorhabditis Genetics Center)。
1.2 主要仪器及试剂 氨苄青霉素(上海BBI,A610028);羧苄青霉素(美国Sigma,A6140);L4440质粒(美国Addgene)。体式解剖显微镜(厦门Motic);低温高速离心机(德国eppendorf);激光共聚焦成像系统(德国Leica)。
1.3 实验方法
1.3.1 线虫生长培养 采用线虫培养基(nematode growth medium,NGM)培养线虫,称取NaCl 3 g,琼脂20 g,蛋白胨2.5 g,溶于975 mL双蒸水,高压灭菌。冷却后,加入1 mol/L CaCl2 1 mL,5 g/L胆固醇1 mL,1 mol/L MgSO4 1 mL和1 mol/L KPO4缓冲液25 mL,混匀后导入细菌培养皿中。室温放置2 d后,铺上OP 50菌,室温放置2 d后即可培养线虫。
1.3.2 线虫同步化 将线虫分为mbk-2突变组和N2正常组,每组50只,常规培养在NGM培养基上,15 ℃生化培养箱中生长繁殖。用Bleach裂解液冲洗NGM培养基,震荡,低速离心,吸取上清液,再加入S-basal溶液,震荡,离心,吸取上清。重复2次后加入S-buffer溶液于15 ℃生化恒温箱中培养过夜。第2天离心,吸取上清,将剩余部分混匀后,涂抹在NGM培养基上。培养7 d待NGM培养基中的线虫进入产卵期,将正处于产卵期的线虫挑到NGM培养基上进行产卵。2~3 h后将线虫挑走杀死后,将NGM培养基放进15 ℃的生化培养箱中进行培养。第2天观察存活情况,发育至幼虫的最后阶段L4期后可用来进行相关实验。
1.3.3 RNAi干扰试验 RNAi细菌在含有50 g/L氨苄青霉素的LB溶液中于37 ℃振荡过夜。将细菌溶液点在NGM琼脂平板上(含有100 g/L氨苄青霉素、12.5 g/L四环素和1 mmol/L IPTG),并在室温下诱导细菌过夜。在20 ℃条件下,将同步化好的N2及mbk-2基因缺陷线虫分为2组,各150只线虫,每组3个亚组,每亚组50只线虫,每组在NGM培养基中培养至L4期,喂食RNAi细菌,分别含有沉默rsa-1和rsa-2基因的质粒(沉默组)和L4440空载质粒(对照组)。
1.3.4 孵化率测定 将大约50只线虫放在装有300 μL细菌的RNAi平板上进行培养,直到L4期。然后将线虫转移到装有30 μL RNAi细菌的新鲜琼脂培养平板(每块平板上有三只蠕虫),并将其孵育24 h。然后这些线虫(新的成虫)被转移到另一个RNAi平板上,24 h后移除。将平板上的子代培养24 h后,对幼虫和未孵化的虫卵数量进行计数。
1.3.5 幼虫发育分析 线虫从L1阶段喂食RNAi细菌,直到线虫成年产卵前2 d。预先准备约0.4 mm厚的琼脂垫,并在使用前与M9溶液和盖玻片一起放入温控培养箱中孵育2 h。在盖玻片上滴加的2 μL M9缓冲液,并在其中解剖8~10只成虫,用熔化的凡士林封片,显微镜下观察并拍照记录。
1.4 统计学方法 应用SPSS 19.0软件处理数据。计量资料采用单因素方差分析和SNK-q检验,计数资料比较采用Fisher确切概率法。P<0.05为差异有统计学意义。
2 结 果
2.1 rsa基因沉默对N2线虫以及mbk-2突变线虫孵化的影响 采用含rsa-1和rsa-2的RNAi细菌喂养线虫,观察抑制rsa对线虫孵化率的影响,对照组采用含L4440质粒的细菌喂养。结果显示,抑制rsa-1和rsa-2表达后,虫卵未孵化率高于对照组(P<0.05)。同时,RNAi筛选结果显示,rsa-1和rsa-2可能是mbk-2的增强子,调控其表达。为验证其调控作用,采用rsa-1和rsa-2的RNAi细菌喂养mbk-2突变型线虫。结果显示,与N2组相比,mbk-2突变会增加虫卵的未孵化率。而采用RNAi抑制rsa-1和rsa-2后,mbk-2突变线虫的虫卵未孵化率显著增加,显著高于mbk-2突变组,见表1。从培养皿的拍摄图片也可以直观的看出,使用L4440的对照组,幼虫的数量多,孵化率很高。rsa-1和rsa-2喂养的mbk-2突变线虫,卵子数量明显增多,幼虫数量减少(图1~2)。
表1 线虫虫卵孵化率统计表
Table 1 Statistics of hatchability ![]()
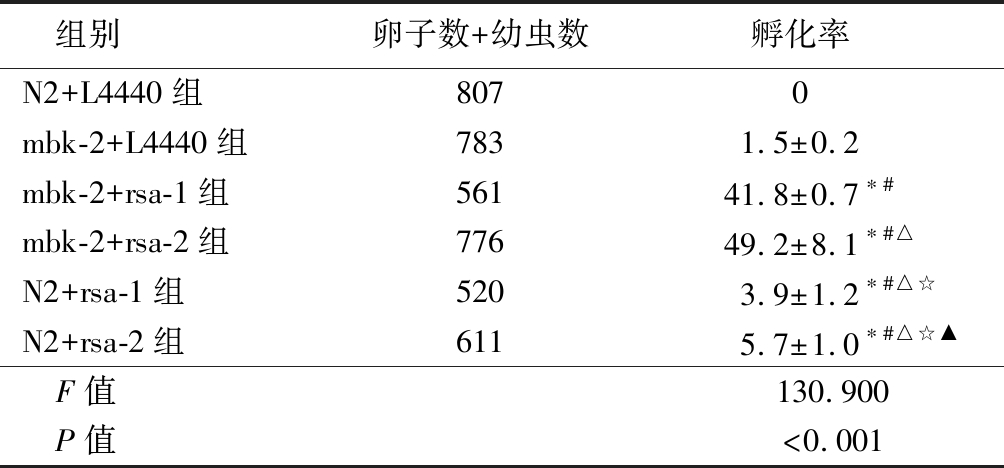
组别卵子数+幼虫数孵化率N2+L4440组8070mbk-2+L4440组7831.5±0.2mbk-2+rsa-1组56141.8±0.7∗#mbk-2+rsa-2组77649.2±8.1∗#△N2+rsa-1组5203.9±1.2∗#△☆N2+rsa-2组6115.7±1.0∗#△☆▲ F值130.900 P值<0.001
*P值<0.05与N2+L4440组比较 #P值<0.05与mbk-2+L4440组比较 △P值<0.05与mbk-2+rsa-1组比较 ☆P值<0.05与mbk-2+ rsa-2组比较 ▲P值<0.05与N2+ rsa-1组比较(SNK-q检验)

图1 N2线虫虫卵孵化检测
A.RNAi抑制的L4440;B.RNAi抑制的rsa-1;C.RNAi抑制的rsa-2
Figure 1 N2 nematode egg hatching detection
图2 mbk-2突变线虫的孵化检测
A.RNAi抑制的L4440;B.RNAi抑制的rsa-1;C.RNAi抑制的rsa-2
Figure 2 Incubation detection of mbk-2 mutant nematode
2.2 rsa-2基因沉默对mbk-2突变线虫胚胎发育的影响 为研究rsa-2对mbk-2的调控作用,采用rsa-2 RNAi细菌喂养mbk-2突变线虫。对胚胎发育表型的研究显示,在单细胞阶段,原核迁移出现缺陷,表现为父原核向中心迁移,并从胚胎后部进一步与母原核相遇,并在相遇位置形成纺锤体。并且纺锤体与A-P轴方向不同,可见于电镜拍摄图(图3)。这些缺陷在rsa-2 RNAi干预的mbk-2突变型线虫表现的最明显,但在野生型N2线虫,使用rsa-2 RNAi单因素处理线虫及L4440喂养的mbk-2突变型线虫中表现不明显。这种表型类似微管不稳定性,见表2。
表2 线虫胚胎发育表型检测
Table 2 Detection of embryonic development phenotype of nematode (例数)
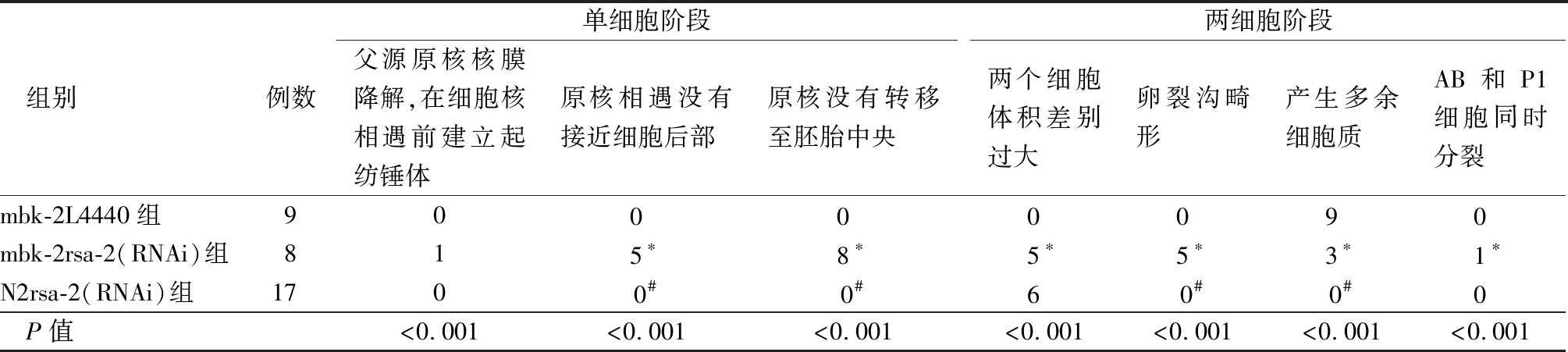
组别例数单细胞阶段父源原核核膜降解,在细胞核相遇前建立起纺锤体原核相遇没有接近细胞后部原核没有转移至胚胎中央两细胞阶段两个细胞体积差别过大卵裂沟畸形产生多余细胞质AB 和 P1 细胞同时分裂mbk-2L4440组900 0 0 0 9 0 mbk-2rsa-2(RNAi)组815∗8∗5∗5∗3∗1∗N2rsa-2(RNAi)组1700#0#6 0#0#0 P值<0.001<0.001<0.001<0.001<0.001<0.001<0.001
*P值<0.05与mbk-2 L4440组比较 #P值<0.05与mbk-2 rsa-2(RNAi)组比较(Fisher确切概率法)

图3 单细胞阶段发育异常情况
Figure 3 One cell stage alloplasia
在两细胞阶段,观察到rsa-2 RNAi喂养的mbk-2突变型线虫胚胎表现为AB和P1细胞显著的不对称,也表现为细胞卵裂沟异常,可见于电镜拍摄图(图4)。这种缺陷与rsa-2 RNAi处理的对照N2线虫相似,这表明胚胎表型的异常可能仅由rsa-2的缺失引起。
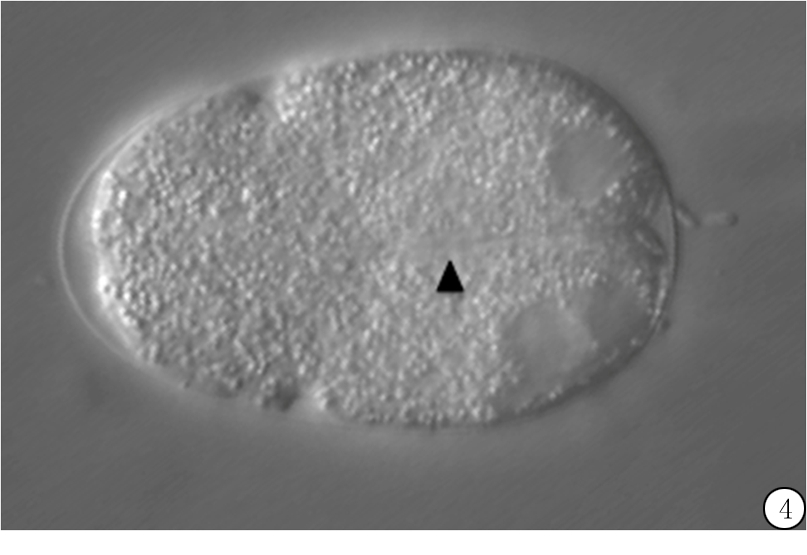
图4 两细胞阶段发育异常情况
Figure 4 Two cell stage alloplasia
3 讨 论
mbk-2在秀丽隐杆线虫早期胚胎发育中的两个主要作用是微管依赖过程的调节和后决定因子的不对称分布。mbk-2影响纺锤体方向和位置、原核迁移、微管稳定性和染色体分离[4]。这些表型是微管分离蛋白Katanin的同源蛋白减数分裂纺锤体形成蛋白(meiotic spindle formation protein,MEI-1)控制产生。mbk-2和分裂后期促进复合物(anaphase promotingcomplex,APC)通过直接磷酸化下调减数分裂后的MEI-1,使MEI-1失活,以便稳定地组装更大的有丝分裂纺锤体[5]。
mbk-2也是P颗粒不对称分布所必需的,也是磷酸化和靶向降解锌金属钛酶(OMA1 zinc metallopeptidase, OMA1)、咽肠过剩蛋白1(pharynx and intestine in excess protein 1,PIE-1)和后置分离蛋白1(posterior segregation-1,POS-1)等蛋白母体蛋白所必需的[6]。锌指蛋白OMA-1调节卵母细胞向胚胎转变。在第一次细胞分裂期间,需要降解OMA-1以启动细胞命运决定因子的蛋白水解。mbk-2通过磷酸化调节OMA-1的降解。mbk-2还通过MEX-5/6调节PIE-1和POS-1的不对称分布[7]。
mbk-2的定位是高度变动的。mbk-2定位于卵母细胞和新受精的受精卵的细胞皮质,并在减数分裂后期迅速转移到皮质点。EGG-3是一种卵子激活所需的卵母细胞蛋白[8],与mbk-2形成复合物,并在减数分裂前保持其在皮质处于非活性状态。在减数分裂期间,EGG-3被内化和降解,从皮层释放出mbk-2[9]。在有丝分裂期间,mbk-2主要发现于中心体和染色体上。使用温度敏感的mbk-2突变体进行胚胎升温实验已经证明,mbk-2活性在第1次有丝分裂期间是必需的[10]。当温度在单细胞阶段上升到非许可温度时,胚胎表现出mbk-2功能丧失表型和100%胚胎致死率。然而温度升高时,如果在双细胞阶段,有50%胚胎存活,如果在八细胞阶段之后,则有100%胚胎存活率。本研究结果显示,当温度升高时,mbk-2突变体线虫胚胎发育出现显著异常。在单细胞阶段,95%受精卵无原核迁移,在双细胞阶段,95%细胞出现卵裂沟缺陷。
蛋白磷酸化酶2A(protein phosphatase 2A,PP2A)是一个广泛参与细胞有丝分裂的酶[11],其功能包括调控进入有丝分裂周期,复制中心粒,染色体向中板集合,着丝粒和微管的相互作用,纺锤体集中的管卡,控制有丝分裂的出口[12-13],PP2A酶有一个异源三聚体的结构,rsa-1和rsa-2蛋白形成一种复合物(RSA复合物),这种复合物是微管从中心体和纺锤体组件中生长出来所必需的。中心体蛋白SPD-5与rsa-2结合,并将RSA复合物募集到中心体中[14]。RSA复合物在有丝分裂纺锤体形成中特异性地起作用,并且通过纺锤体装配调节剂微管解聚驱动蛋白KLP-7的下调来调节从中心体发出的微管的数量。RSA复合物还通过将微管不稳定蛋白TPXL-1募集到中心体来调节有丝分裂纺锤体装配[15]。
秀丽隐杆线虫使用Wnt/β连环蛋白信号通路完成不均质的细胞分裂(asymmetric cell division,ACD),因此子代细胞分化自Wnt极化的母代细胞,并且展示出Wnt信号[10],这条信号通路在线虫发育过程中控制了连续的前后向的ACD细胞,指导了反复的二进制细胞凋亡过程。这条通路的核心组成部分是SYS-1,它是β连环蛋白的同源物,也是TCF链接的位置,且作用于激活Wnt目标基因[16]。在ACD细胞后,SYS-1不均等的集中到带有Wnt信号的子代细胞核,从而激活Wnt目标基因的转录。Wnt目标基因的表达激活了细胞分化程序,区别于非Wnt信号的子代细胞[17]。近期有关于SYS-1(SYmmetrical Sister cell hermaphrodite gonad defect)不均等的姐妹细胞雌雄同体性腺缺陷和rsa-2的相关研究表面,线虫的中心体细胞相关的SYS-1/β连环蛋白的降解限制了其在不均等细胞分化后在子代细胞中的表达。SYS-1和中心体蛋白rsa-2相互作用,并且在胚胎细胞有丝分裂过程中,rsa-2使SYS-1移动到细胞的中心体。在ACD过程后,rsa-2使SYS-1从中心体分解,并且促进依靠Wnt的细胞凋亡。rsa-2促进SYS-1在中心体上聚集,但是限制SYS-1在分化后保留在子代细胞[18]。
本研究结果显示,利用RNAi细菌抑制mbk-2突变体线虫中的rsa-1 和rsa-2后,虫卵致死率显著高于L4440喂养的mbk-2突变体线虫。并且rsa-2 RNAi处理组也显著高于rsa-1 RNAi处理组,提示mbk-2更多受rsa-2的调节作用影响。
rsa-1可以使PP2A全化酶置于细胞中心体,并且在有丝分裂的纺锤体的聚集起到关键作用。当去掉rsa-1功能的时候会出现两个主要的表现,中心微管减少和纺锤体倒塌,因此细胞中心体在纺锤体汇合的时候移向染色质[19]。
对于mbk-2和rsa-2的相互作用,微分干涉差显微镜结果显示,在单细胞阶段显示明显缺陷,如原核迁移缺陷,这类似于mbk-2因微管不稳定而丧失功能。这些表型表明,在微管形成过程中,mbk-2可能需要rsa-2的调节。mbk-2在减数分裂后保持着MEI-1的活性。MEI-1的激活扰乱了有丝分裂纺锤体的稳定性。rsa-1和rsa-2复合物通过减少纺锤体组件调节器KLP-7在有丝分裂纺锤体形成和微管数量控制中起作用。rsa复合物还可以通过募集微管去稳定蛋白TPXL-1来调节纺锤体组装[15]。在两细胞阶段,相互作用的胚胎产生了夸大的AB和P1细胞不对称,这也出现在N2和rsa-2RNAi对照中。那么这种表型可能仅仅来自rsa-2 RNAi的抑制作用。两细胞期也出现了胞质体,这与15 ℃时的mbk-2突变体相同。这意味着胞质体是仅由降低mbk-2功能产生的。
[1] Wang S,Ochoa SD,Khaliullin RN,et al. A high-content imaging approach to profile C. elegans embryonic development[J]. Development,2019,146(7):dev174029.
[2] Spracklin G,Fields B,Wan G,et al. The RNAi inheritance machinery of caenorhabditis elegans[J]. Genetics,2017,206(3):1403-1416.
[3] Cipriani PG,Piano F. RNAi methods and screening: RNAi based high-throughput genetic interaction screening[J]. Methods Cell Biol,2011,106:89-111.
[4] Joly N,Beaumale E,Van Hove L,et al. Phosphorylation of the microtubule-severing AAA+ enzyme Katanin regulates C. elegans embryo development[J]. J Cell Biol,2020,219(6):e201912037.
[5] Beard SM,Smit RB,Chan BG,et al. Regulation of the MEI-1/MEI-2 microtubule-severing katanin complex in early caenorhabditis elegans development[J]. G3 (Bethesda),2016,6(10):3257-3268.
[6] Kipreos ET,van den Heuvel S. Developmental control of the cell cycle:insights from caenorhabditis elegans[J]. Genetics,2019,211(3):797-829.
[7] Tsukamoto T,Gearhart MD,Spike CA,et al. LIN-41 and OMA ribonucleoprotein complexes mediate a translational repression-to-activation switch controlling oocyte meiotic maturation and the oocyte-to-embryo transition in caenorhabditis elegans[J]. Genetics,2017,206(4):2007-2039.
[8] Sala AJ,Bott LC,Brielmann RM,et al. Embryo integrity regulates maternal proteostasis and stress resilience[J]. Genes Dev,2020,34(9/10):678-687.
[9] Kelley CA,Cram EJ. Regulation of actin dynamics in the C. elegans somatic gonad[J]. J Dev Biol,2019,7(1):6.
[10] Kaur S,Mélénec P,Murgan S,et al. Wnt ligands regulate the asymmetric divisions of neuronal progenitors in C. elegans embryos[J]. Development,2020,147(7):dev183186.
[11] Kruse T,Gnosa SP,Nasa I,et al. Mechanisms of site-specific dephosphorylation and kinase opposition imposed by PP2A regulatory subunits[J]. EMBO J,2020,39(13):e103695.
[12] Varadkar P,Abbasi F,Takeda K,et al. PP2A-B56γ is required for an efficient spindle assembly checkpoint[J]. Cell Cycle,2017,16(12):1210-1219.
[13] Liu Y,Zhang Z,Liang H,et al. Protein phosphatase 2A (PP2A) regulates eg5 to control mitotic progression[J]. Sci Rep,2017,7(1):1630.
[14] Enos SJ,Dressler M,Gomes BF,et al. Phosphatase PP2A and microtubule-mediated pulling forces disassemble centrosomes during mitotic exit[J]. Biol Open,2018,7(1):bio029777.
[15] Lange KI,Suleman A,Srayko M. Kinetochore recruitment of the spindle and kinetochore-associated (Ska) complex is regulated by centrosomal PP2A in caenorhabditis elegans[J]. Genetics,2019,212(2):509-522.
[16] van der Horst SEM,Cravo J,Woollard A,et al. C. elegans Runx/CBFβ suppresses POP-1 TCF to convert asymmetric to proliferative division of stem cell-like seam cells[J]. Development,2019,146(22):dev180034.
[17] Rui Q,Dong S,Jiang W,et al. Response of canonical Wnt/β-catenin signaling pathway in the intestine to microgravity stress in Caenorhabditis elegans[J]. Ecotoxicol Environ Saf,2019,186:109782.
[18] Vora S,Phillips BT. Centrosome-associated degradation limits β-catenin inheritance by daughter cells after asymmetric division[J]. Curr Biol,2015,25(8):1005-1016.
[19] Qadota H,Matsunaga Y,Bagchi P,et al. Protein phosphatase 2A is crucial for sarcomere organization in Caenorhabditis elegans striated muscle[J]. Mol Biol Cell,2018,29(17):2084-2097.