结核病是最常见并可致命的一种传染病,尽管目前全球在医疗技术方面取得了新进展,但结核病仍然是公共卫生方面的一项重要挑战[1]。世界卫生组织报告2016年新增结核病1 100万例,死亡140万例[2]。由于结核病诊断方法的局限性,所以缺乏最佳诊断方法,临床医生仍然面临着早期诊断的困惑[3]。结核病早期检测在控制疾病和防止感染蔓延方面具有重要作用,引入新的诊断生物标志物有非常重要的应用价值[4]。CXC趋化因子配体8(cysteine X chemokine ligand 8,CXCL8)被认为是一种典型的趋化因子,属于CXC家族,负责免疫细胞在炎症部位的募集和激活。CXCL8在生理状态下表达较少,但可由促炎性细胞因子如肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)和白细胞介素1β(interleukin-1β,IL-1β)等迅速诱导。CXCL8的功能主要依赖于其与特定细胞表面G蛋白偶联受体CXC趋化因子受体1(cysteine X chemokine receptor 1,CXCR1)和CXC趋化因子受体2(cysteine X chemokine receptor 2,CXCR2)的相互作用。趋化因子在结核分枝杆菌的正常免疫应答中起着核心作用[5],可以招募免疫细胞,是肉芽肿形成的绝对必要条件。本研究采用逆转录-聚合酶反应(reverse transcription-polymerase chain reaction,RT-PCR)测定活动性肺结核患者、潜伏性结核感染者及健康对照者外周血中CXCL8、CXCR1和CXCR2的mRNA表达水平,评价在肺结核诊断中的临床意义。报告如下。
1 资料与方法
1.1 一般资料 收集2017年3—12月我院结核科住院的初治肺结核患者(肺结核组)125例,男性77例,女性48例,年龄21~63岁,平均(40.2±11.7)岁,肺结核诊断参照中华人民共和国卫生行业标准(WS288-2017),以病原学实验室检查为主,结合胸部影像学、流行病学、临床表现及其他相关辅助检查和鉴别诊断进行综合分析作出诊断。根据影像学诊断,分为肺部形成空洞组31例,无空洞组94例;所有肺结核患者给予标准化治疗,包括异烟肼、利福平、吡嗪酰胺、乙胺丁醇联合强化治疗2个月后,异烟肼、利福平巩固治疗4个月,即抗结核方案治疗6个月。收集同期潜伏性结核感染109例,男性51例,女性58例,年龄22~65岁,平均(41.3±13.6)岁,细菌学检测即痰涂片及培养确定阴性,结核菌素试验阳性,有结核病接触史,结合临床症状及影像学表现无肺结核特征;同期体检健康者(健康对照组)112例,男性65例,女性47例,年龄26~60岁,平均(38.9±10.5)岁。3组性别、年龄差异无统计学意义(P>0.05),具有可比性。所有研究对象排除糖尿病、高血压、自身免疫性疾病等,无合并病毒性肝炎、获得性免疫缺陷综合征等传染性疾病,均为汉族。
本研究经医院伦理委员会批准通过,所有患者及志愿者签署书面知情同意书。
1.2 主要试剂 总RNA提取试剂Trizol LS购自Invitrogen公司。RT-PCR反应体系购自宝生物工程(大连)有限公司。RT-PCR上下游引物购自英潍捷基(上海)贸易有限公司。RT-PCR扩增仪(LightCycler 480Ⅱ,Roche公司)。
1.3 检测方法
1.3.1 标本采集 所有研究对象空腹采集静脉血4 mL,收集在乙二胺四乙酸抗凝管,3 000 r/min离心10 min,分离血浆置于-80 ℃冰箱保存。肺结核组于抗结核治疗前、抗结核治疗3个月及6个月收集标本。
1.3.2 总RNA提取 分离所得的血浆中加入Trizol LS试剂,体积比为1∶3,操作步骤按说明书进行提取总RNA,最后室温干燥RNA沉淀,加入无RNase的水溶解RNA,放-80 ℃冰箱保存备用。
1.3.3 RNA浓度测定 RNA样品于琼脂糖凝胶中电泳,凝胶成像系统分析28 S和18 S两条亮带,如果260 nm和280 nm处光密度比值为1.8~2.0,即为合格RNA。
1.3.4 RT-PCR实验检测各指标mRNA水平 RNA提取后首先反转录合成cDNA,严格按试剂盒说明书提供的步骤进行操作。以反应产物cDNA为模板进行PCR扩增,体系包括1 μL cDNA模板,2 μL 10倍PCR缓冲液(含Mg2+),0.3 μL TaqDNA聚合酶(5 U/μL),0.5 μL dNTP(10 mmol/L),上、下游引物各0.5 μL(10 mmol/L)。CXCL8上游引物5′-CTTTGTCCATTCCCACTT-CTGA-3′,下游引物,5′-TCCCTAACGGTTGCC-TTTGTAT-3′,扩增片段长度为306 bp;CXCR1上游引物5′-CAGATCCACAGATGTGGGAT-3′,下游引物5′-AGCAGCCAAGACAAACAAACTT-3′,扩增片段长度为468 bp;CXCR2上游引物,5′-CTTTTCTACTAGATGCCGC-3′,下游引物5′-AGATGCTGAGACATATGAATTT-3′,扩增片段长度为417 bp;GAPDH上游引物5′-GACCAC-TTTGTCAAGCTCATTTCC-3′,下游引物5′-GTGAGGGTCTCTCTCTTCCTCTTGT-3′,扩增片段长度为323 bp。PCR扩增条件包括95 ℃预变性2 min,95 ℃变性30 s,56 ℃退火30 s,72 ℃延伸35 s,共38个循环后72 ℃延伸5 min。
1.4 统计学方法 应用SPSS 22.0统计软件处理数据。计量资料比较采用t检验、单因素方差分析和SNK-q检验,受试者工作特征(receiver operator characteristic curve,ROC)曲线分析评价诊断效能,计算曲线下面积(area under curve,AUC)。P<0.05为差异有统计学意义。
2 结 果
2.1 RT-PCR检测各组CXCL8、CXCR1和CXCR2的mRNA比较 RT-PCR结果显示,3组CXCL8、CXCR1和CXCR2的mRNA表达差异有统计学意义(P<0.05)。活动性肺结核组CXCL8、CXCR1和CXCR2的mRNA表达均明显高于对照组和潜伏感染组,差异有统计学意义(P<0.05)。见表1。
表1 RT-PCR检测CXCL8、CXCR1和CXCR2基因表达比较
Table 1 Relative values of gene expression in CXCL8,
CXCR1 and CXCR2 by RT-PCR ![]()
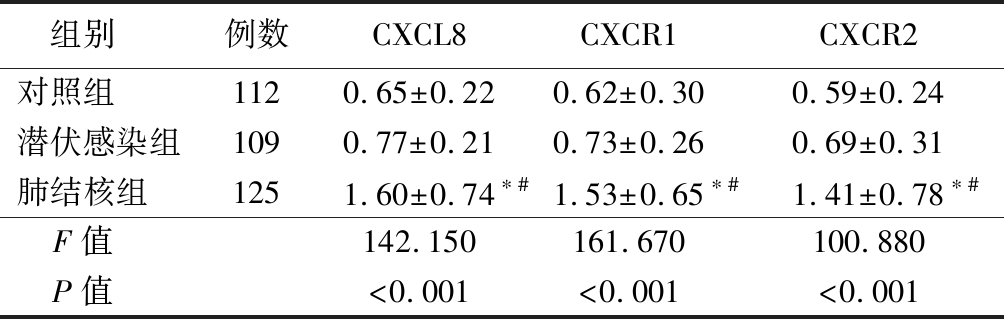
组别 例数CXCL8CXCR1CXCR2对照组 1120.65±0.220.62±0.300.59±0.24潜伏感染组1090.77±0.210.73±0.260.69±0.31肺结核组 1251.60±0.74∗#1.53±0.65∗#1.41±0.78∗#F值 142.150161.670100.880P值 <0.001<0.001<0.001
*P值<0.05与对照组比较 #P值<0.05与潜伏感染组比较(SNK-q检验)
2.2 有无空洞肺结核患者CXCL8、CXCR1和CXCR2的mRNA表达比较 有空洞组肺结核患者CXCL8、CXCR1和CXCR2的mRNA表达显著高于无空洞组,差异有统计学意义(P<0.05),见表2。
表2 有无空洞肺结核患者CXCL8、CXCR1和CXCR2的mRNA表达比较
Table 2 The expression levels of CXCL8, CXCR1 and CXCR2 in patients with pulmonary tuberculosis ![]()
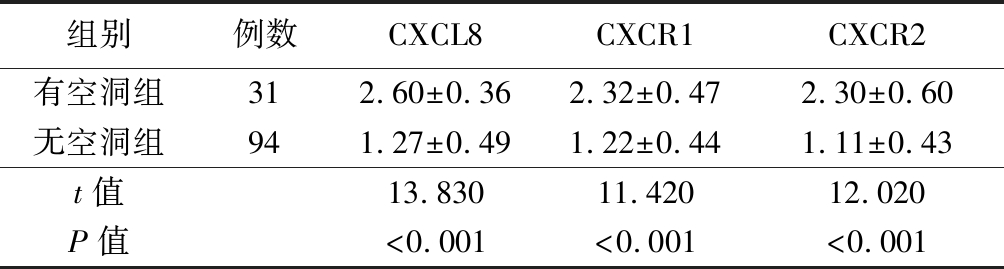
组别例数CXCL8CXCR1CXCR2有空洞组312.60±0.362.32±0.472.30±0.60无空洞组941.27±0.491.22±0.441.11±0.43 t值13.83011.42012.020P值<0.001<0.001<0.001
2.3 肺结核患者抗结核治疗前后CXCL8、CXCR1和CXCR2的mRNA表达比较 治疗3个月时CXCL8、CXCR1和CXCR2的mRNA表达水平均显著低于治疗前,治疗6个月时CXCL8、CXCR1和CXCR2的mRNA表达水平均显著低于治疗前和治疗3个月时,差异有统计学意义(P<0.05)。随访患者抗结核治疗效果良好。见表3。
表3 肺结核患者抗结核治疗前后CXCL8、CXCR1和CXCR2的mRNA表达水平比较
Table 3 The expression levels of CXCL8, CXCR1 and CXCR2 in patients with pulmonary tuberculosis before and after anti-tuberculosis treatment ![]()
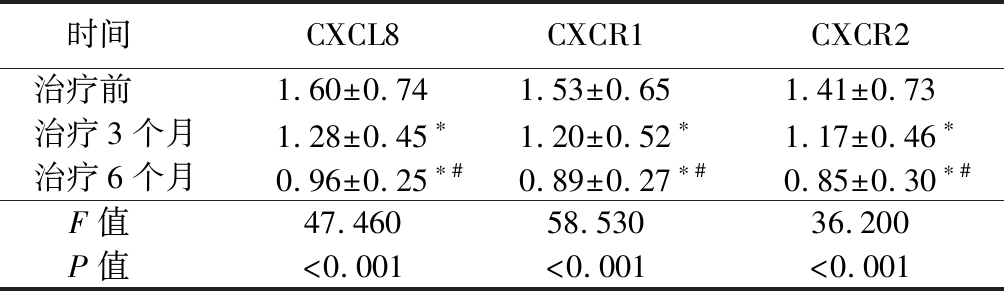
时间 CXCL8CXCR1CXCR2治疗前 1.60±0.741.53±0.651.41±0.73治疗3个月1.28±0.45∗1.20±0.52∗1.17±0.46∗治疗6个月0.96±0.25∗#0.89±0.27∗#0.85±0.30∗#F值 47.46058.53036.200P值 <0.001<0.001<0.001
*P值<0.05与治疗前比较 #P值<0.05与治疗3个月比较(SNK-q检验)
2.4 ROC曲线 绘制肺结核组的ROC曲线(图1),CXCL8、CXCR1和CXCR2的AUC分别为0.888、0.819、0.756。CXCL8鉴别肺结核的敏感度和特异度分别为76.8%和90.5%,以1.0为临界值;CXCR1的敏感度和特异度分别为72.8%和79.2%,以1.09为临界值;CXCR2的敏感度和特异度分别为59.2%和78.8%,以1.08为临界值。
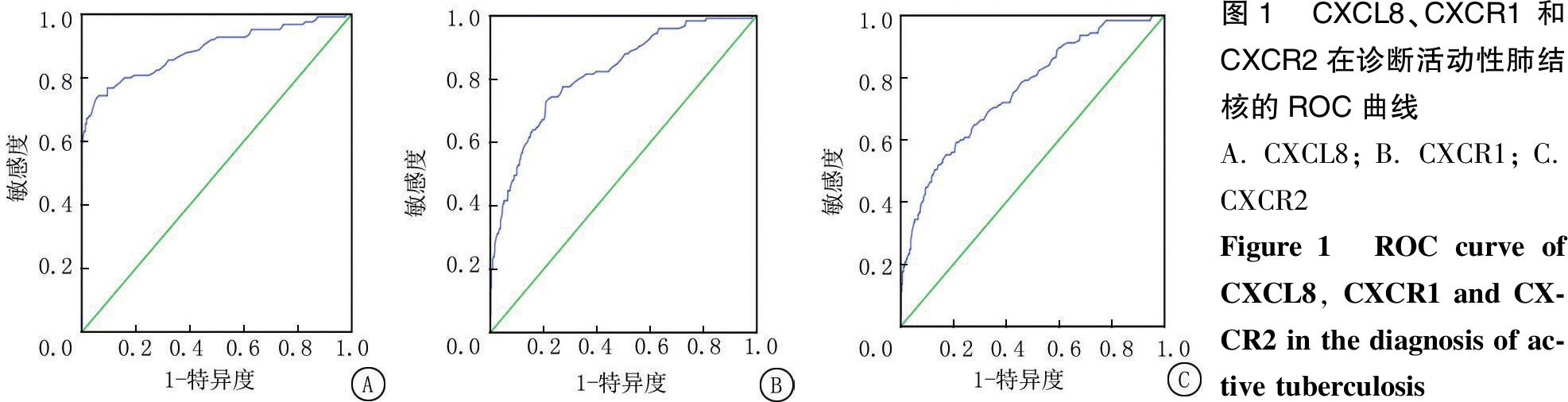
图1 CXCL8、CXCR1 和CXCR2在诊断活动性肺结核的ROC曲线A.CXCL8;B.CXCR1;C.CXCR2Figure 1 ROC curve of CXCL8, CXCR1 and CX-CR2 in the diagnosis of ac-tive tuberculosis
3 讨 论
在先天和适应性免疫系统中趋化因子及其同源受体通过调节免疫细胞的激活和转运发挥重要作用。趋化因子是一种小的分泌蛋白,含有4个至关重要的半胱氨酸残基保持其结构完整性。根据这4个半胱氨酸残基的排列将趋化因子分为CC、CXC、XC和CX3C,迄今为止,已鉴定出50种趋化因子和20种趋化因子受体[6]。
结核分枝杆菌主要通过呼吸道进入肺泡,被中性粒细胞、上皮细胞、肺泡巨噬细胞和树突状细胞等吞噬[7],引起细胞介导的免疫反应,这些靶细胞分泌趋化因子CXCL8并启动趋化因子和细胞因子等级联反应[8]。CXCL8主要有2种生物学活性:趋化作用和白细胞活化,CXCL8可以通过影响包括结核分枝杆菌感染在内的严重传染病的发病机制而产生重要的临床效应。CXCL8的细胞外结合2个G蛋白偶联受体介导其信号转导,影响免疫细胞的增殖、存活及运动,促进多种细胞因子分泌,在炎症、肺疾病、哮喘及肿瘤等多种疾病中发挥重要作用。CXCR1和CXCR2具有76%的序列同源性,以相似的亲和力结合到CXCL8。CXCR1/2的C末端调节受体的磷酸化、内化、G蛋白偶联以及与其他细胞质蛋白的结合,2个CXCL8高亲和力受体的细胞信号传导是非常复杂的[9]。有证据表明,CXCR1是启动磷脂酶D活化的主要受体,CXCR2与细胞迁移相关[10]。CXCL8在肺部炎症中起重要作用,有助于慢性阻塞性肺疾病的发展,有文献表明,慢性阻塞性肺疾病患者痰和支气管肺泡灌洗液中CXCL8的浓度高于健康志愿者,并且与中性粒细胞的积累相关[11]。中性粒细胞是先天免疫系统的重要组成部分,是第一组迁移到感染部位的细胞。在抵御微生物感染和启动组织修复中趋化因子通过及时、协调地招募中性粒细胞发挥关键作用[12-13]。CXCL8-CXCR1/2轴在感染部位使中性粒细胞聚集,并诱导中性粒细胞氧化和颗粒释放,以消除炎症刺激并增加细菌清除率。因此,该轴保护宿主免受进一步感染和组织损伤,CXCL8- CXCR1/2轴的中断可能严重影响宿主对感染的免疫机制[14],甚至导致死亡。
由于CXCL8是炎症介导过程的关键组成部分,CXCL8及其受体的异常调节与许多炎症介导的疾病有关,CXCL8最有可能是将中性粒细胞带到结核病患者感染部位的原因,CXCL8是宿主抗结核防御所必需的。CXCL8与受体CXCR1/2特异性结合后,可诱导大量炎症细胞迁移至特定感染部位,产生局部炎症免疫应答,通过与之偶联的G蛋白变构激活下游的效应分子进行信号转导[15]。结核分枝杆菌感染宿主后引起机体的局部炎症反应,趋化因子及受体同时参与炎症应答的激活。有研究表明,结核患者血浆趋化因子及其相应受体的表达水平显著高于非结核患者[16],推测趋化因子可以迁移到结核感染部位,诱导有效的Th1细胞免疫反应,有利于清除结核分枝杆菌。
对于CXCL8、CXCR1和CXCR2临床意义的探索中,发现趋化性细胞因子CXCL8和受体CXCR1及CXCR2在结核患者保护性免疫中发挥重要作用。本研究通过RT-PCR法检测初治肺结核患者、潜伏性感染者及健康对照组CXCL8、CXCR1和CXCR2的mRNA表达水平,研究结果发现,肺结核组外周血CXCL8、CXCR1和CXCR2的mRNA表达水平均显著高于潜伏感染组和正常对照组(P<0.05),提示在活动性肺结核患者中CXCL8、CXCR1和CXCR2表达升高,但是潜伏性感染组和对照组的结果差异无统计学意义。CXCL8及受体表达的变化与疾病的进展有关,并影响宿主对于结核分枝杆菌的免疫应答,根据不同临床表型进行分组,结果显示,肺部有空洞结核患者CXCL8、CXCR1和CXCR2的mRNA水平均显著高于无空洞患者。活动性肺结核患者接受标准抗结核治疗,且患者抗结核治疗效果良好。随访6个月发现,治疗3个月时CXCL8、CXCR1和CXCR2的mRNA水平表达明显低于治疗前,且随着治疗时间延长,CXCL8、CXCR1和CXCR2的mRNA表达量逐渐降低。
进一步应用ROC曲线分析CXCL8、CXCR1和CXCR2的诊断效能以及鉴别肺结核患者的敏感度和特异度。结果显示,CXCL8、CXCR1和CXCR2均具有较高的敏感度和特异度。提示CXCL8、CXCR1和CXCR2对活动性肺结核诊断有一定的优势,对病情的评估有指导作用,可能是区别活动性和潜伏性结核感染的敏感指标。
综上所述,分析肺结核患者外周血趋化因子CXCL8和受体CXCR1、CXCR2的表达变化,在抗结核感染信号通路过程中的作用与联系,可作为辅助诊断肺结核病的主要依据之一,有望成为诊断活动性肺结核病的重要标志物,更加深入地了解结核分枝杆菌的致病机制,为今后结核病的早期治疗及改善结核病结局,发挥重要的临床应用价值。
[1] Waldman AJ,Balskus EP. The human microbiota, infectious disease, and global health:challenges and opportunities[J]. ACS Infect Dis,2018,4(1):14-26.
[2] Agarwal A,Agrawal R,Gunasekaran DV,et al. The collaborative ocular tuberculosis study(COTS)-1 report 3:polymerase chain reaction in the diagnosis and management of tubercular uveitis:global trends[J]. Ocul Immunol Inflamm,2019,27(3):465-473.
[3] 陈颜强,赵青,李薇,等.结核性脑膜炎伴发肺结核的临床研究及检验方法的对比[J].河北医科大学学报,2019,40(5):504-507.
[4] 吕松琴,赵华,宝福凯,等.TNF-α和IFN-γ与T-SPOT.TB相结合应用于鉴别结核现症感染与隐性感染[J].昆明医科大学学报,2017,38(4):93-97.
[5] 吉萍,胡志东,范小勇.趋化因子与结核病[J].中华结核和呼吸杂志,2017,40(6):475-476.
[6] Hughes CE,Nibbs RJB. A guide to chemokines and their receptors[J]. FEBS J,2018,285(16):2944-2971.
[7] Liu CH,Liu H,Ge B. Innate immunity in tuberculosis:host defense vs pathogen evasion[J]. Cell Mol Immunol,2017,14(12):963-975.
[8] Stone MJ,Hayward JA,Huang C,et al. Mechanisms of regulation of the chemokine-receptor network[J]. Int J Mol Sci,2017,18(2).pii:E342.
[9] Wu S,Saxena S,Varney ML,et al. CXCR1/2 chemokine network regulates melanoma resistance to chemotherapies mediated by NF-κB[J]. Curr Mol Med,2017,17(6):436-449.
[10] Vacchini A,Mortier A,Proost P,et al. Differential effects of posttranslational modifications of CXCL8/interleukin-8 on CXCR1 and CXCR2 internalization and signaling properties[J]. Int J Mol Sci,2018,19(12).pii:E3768.
[11] Ha H,Debnath B,Neamati N. Role of the CXCL8-CXCR1/2 axis in cancer and inflammatory diseases[J]. Theranostics,2017,7(6):1543-1588.
[12] Rajarathnam K,Schnoor M,Richardson RM,et al. How do chemokines navigate neutrophils to the target site:dissecting the structural mechanisms and signaling pathways[J]. Cell Signal,2019,54:69-80.
[13] Cockx M,Gouwy M,Van Damme J. Chemoattractants and cytokines in primary ciliary dyskinesia and cystic fibrosis:key players in chronic respiratory diseases[J]. Cell Mol Immunol,2018,15(4):312-323.
[14] Joseph PRB,Sawant KV,Rajarathnam K. Heparin-bound chemokine CXCL8 monomer and dimer are impaired for CXCR1 and CXCR2 activation:implications for gradients and neutrophil trafficking[J]. Open Biol,2017,7(11).pii:170168.
[15] Alaridah N,Lutay N,Tenland E,et al. Mycobacteria manipulate G-protein-coupled receptors to increase mucosal rac1 expression in the lungs[J]. J Innate Immun,2017,9(3):318-329.
[16] 魏兰,贾新转,秦学博,等.血清CXC趋化因子受体3配体检测在活动性肺结核诊断中的价值[J].中国防痨杂志,2019,41(11):1167-1172.