成骨细胞和脂肪细胞共同来源于骨髓间充质干细胞(bone marrow derived mesenchymal stem cells,BMSCs),因此其分化过程存在竞争关系。脂肪细胞占骨髓细胞的15%~70%,疾病状态下(如骨质疏松症)或者随着年龄增长,脂肪细胞数目增多,替代正常的其他类型细胞分化,如成骨细胞分化[1]。胰岛素受体底物1(insulin receptor substrate 1,IRS-1)是胰岛素信号通路的枢纽因子,可以通过激活下游通路的一系列信号转导,完成对细胞增殖、凋亡、分化等功能的调节[2]。目前,关于IRS-1对成脂分化的作用尚存争议。一项动物实验表明,敲除IRS-1基因可使成脂分化呈进行性降低[3]。Kim等[4]研究发现,过表达IRS-1改善脂肪细胞脂质储存,即IRS-1促进脂质合成。具有盘状同源区域结合序列的转录共活化因子(transcriptional coactivator with PDZ-binding motif,TAZ)是一种调节干细胞增殖、分化等功能的重要转录调控因子[5]。Byun等[6]研究表明,TAZ一方面通过共活化Runt相关转录因子2(Runt related transcription factor 2,RUNX2)促进BMSCs向成骨细胞方向分化,另一方面通过结合过氧化物酶体增生物激活受体γ(Peroxisome proliferator activated receptorγ,PPARγ)抑制成脂分化相关基因转录,抑制BMSCs向脂肪细胞分化。TAZ是否还有其他机制并不明确,且其所受调控的上游信号通路并未完全阐明[7]。本研究旨在探索IRS-1/TAZ信号通路调控BMSCs向成脂细胞分化的潜在机制,为糖尿病发病候选基因IRS-1参与调控骨代谢和脂肪代谢提供新依据。
1 材 料 与 方 法
1.1 实验动物 3月龄SPF级雌性未受孕SD(Sprague Dawley)大鼠15只用于动物实验;另4周龄SD大鼠9只用于BMSCs的原代培养。实验动物购于河北省实验动物中心,动物合格证书号 1708080。
1.2 方法
1.2.1 动物分组及骨质疏松模型的构建 将15只3月龄SD大鼠随机分为对照组、假手术组和去卵巢手术(ovariectomy,OVX)组,每组5只。去卵巢手术操作步骤:大鼠禁食禁水12 h后进行麻醉,俯卧位定位大鼠卵巢,消毒手术部位,依次剪开皮肤、肌肉、筋膜,分离脂肪团,手术结扎输卵管,完整切除双侧卵巢,止血并逐层缝合。假手术组仅切除卵巢等体积脂肪组织,保留卵巢。术后3 d连续应用抗生素预防感染。术后12周用于后续实验。
1.2.2 大鼠BMSCs的原代培养及成脂分化 将4周龄SD大鼠CO2麻醉后处死,用75%乙醇浸泡5 min。在无菌条件下取双侧股骨,剪除股骨近端骨骺,用5 mL注射器吸取DMEM培养基反复冲洗骨髓腔。细胞取出后,以5×106/cm2的密度接种于含12%胎牛血清及1%青链霉素的DMEM培养基中,放入细胞培养箱中培养。原代细胞达到80%融合后传代,P3代细胞用于后续实验。应用成脂诱导培养基(DMEM含12%胎牛血清,1%青链霉素,10 g/L胰岛素,500 mmol/L甲基异丁基黄酸钠和1 μmol/L地塞米松)诱导BMSCs向脂肪细胞分化。
1.2.3 组织化学染色 取SD大鼠股骨,用4%多聚甲醛固定,4 ℃,24 h;0.5 mol/L乙二胺四乙酸脱钙3周,4 ℃,摇床;酒精梯度脱水后石蜡包埋,制作4 μm石蜡,切片。将石蜡切片65 ℃烘干,二甲苯脱蜡,酒精梯度复水。采用苏木精和伊红(hematoxylin and eosin,HE)染色的标准步骤进行染色。显微镜下对脂肪细胞进行计数并拍照。
1.2.4 免疫荧光分析 取SD大鼠股骨,用4%多聚甲醛固定,4 ℃,24 h;0.5 mol/L乙二胺四乙酸脱钙3周,4 ℃,摇床;应用8%明胶包埋,制作20 μm冰冻切片。将冰冻切片37 ℃烘干,浸泡于PBS液15 min,5% BSA封闭1 h,一抗孵育(抗围脂滴蛋白,Sigma),4 ℃,过夜;TBST清洗,荧光二抗孵育1 h,TBST清洗,封片。显微镜下对荧光标记细胞进行计数并拍照。
1.2.5 酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA) 取SD大鼠股骨,将周围组织剔除干净,于液氮条件下研磨,加入RIPA裂解液,超声破碎后离心,取上清液。根据IRS-1 ELISA试剂盒(武汉菲恩生物科技有限公司)操作步骤测定IRS-1浓度。
1.2.6 质粒转染 课题组在前期实验中已经自行构建IRS-1高表达质粒(pCMV-IRS-1)[8]。本研究构建了分别用于敲除IRS-1和TAZ表达的质粒,即嵌入可敲除IRS-1表达的小干扰RNA(SiIRS-1)的质粒,以及嵌入可敲除TAZ表达的小干扰RNA(SiTAZ)的质粒(上海吉凯基因化学有限公司)。应用脂质体3 000(Thermo)对BMSCs进行转染。细胞转染24 h后,更换为成脂诱导培养基进行培养。同时设立对照组,未进行质粒转染组设置为“空白对照组”,转染空白质粒组作为“阴性对照组”。
1.2.7 油红O染色 将细胞接种至35 mm塑料培养皿中成脂诱导14 d后,PBS清洗2次,4%多聚甲醛室温固定20 min,蒸馏水清洗3次。将油红O储存液(0.5 g油红O溶于100 mL异丙醇)与蒸馏水以3∶2的比例配置工作液,室温放置10 min后过滤。应用油红O工作液室温染色15 min。蒸馏水清洗3次后,显微镜下拍照。然后,应用异丙醇对油红O进行脱色,加入等体积PBS液后放入通风橱,室温,30 min。应用酶标仪(520 nm)读取其OD值。
1.2.8 蛋白免疫印迹(Western blot) 将细胞接种至60 mm塑料培养皿中成脂诱导3 d后,利用RIPA裂解液提取蛋白。应用12% SDS-PAGE胶对蛋白进行电泳分离后,采用半干法将其转移至PVDF膜。5%牛奶封闭,37 ℃,室温。一抗孵育(抗TAZ,Cell Signaling;抗CCAAT/增强子结合蛋白β(CCAAT/enhancer binding protein β,C/EBPβ),Boster;抗PPARγ,Boster;抗GAPDH,Bioworld),4 ℃,过夜。二抗37 ℃孵育1 h。分析蛋白条带灰度值,并计算目的蛋白与内参蛋白条带灰度值的比值。
1.3 统计学方法 应用SPSS 20.0统计软件分析数据。所有实验至少重复3次。计量资料比较采用单因素方差分析和SNK-q检验。P<0.05为差异有统计学意义。
2 结 果
2.1 不同组别大鼠股骨内脂肪细胞计数、荧光标记细胞计数、IRS-1浓度比较 对大鼠股骨进行HE染色,计数脂肪细胞,结果发现,3组间脂肪细胞计数差异有统计学意义(P<0.05),OVX组脂肪细胞计数多于对照组和假手术组,差异有统计学意义(P<0.05),对照组和假手术组脂肪细胞计数差异无统计学意义(P>0.05)。利用免疫荧光染色对脂肪细胞标记物围脂滴蛋白进行标记并计数,分析结果与HE染色结果趋势一致。ELISA法测定大鼠股骨内IRS-1浓度,结果发现,3组间IRS-1浓度差异有统计学意义(P<0.05),OVX组IRS-1浓度低于对照组和假手术组,差异有统计学意义(P<0.05),对照组和假手术组IRS-1浓度差异无统计学意义(P>0.05)。见图1,表1。
表1 不同组别大鼠股骨内脂肪细胞、荧光标记细胞计数和IRS-1浓度比较
Table 1 The quantitative analysis of adipocyte count,fluorescent labeled cell count and IRS-1 concentration in rat femurs in different groups![]()
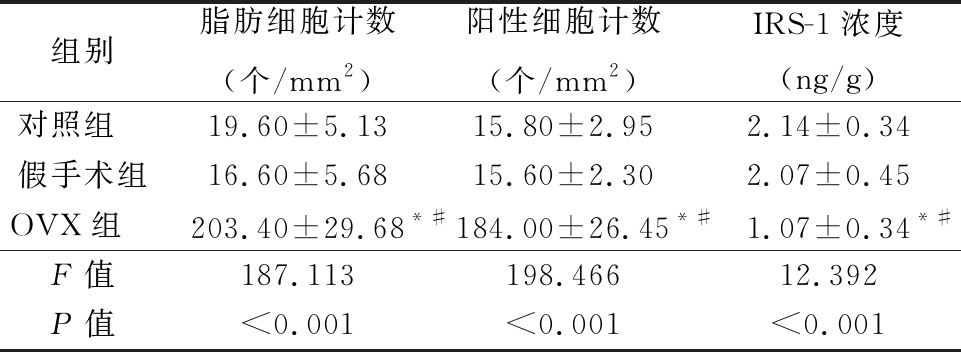
*P值<0.05与对照组比较 #P值<0.05与假手术组比较(SNK-q检验)
组别脂肪细胞计数(个/mm2)阳性细胞计数(个/mm2)IRS-1浓度(ng/g)对照组 19.60±5.1315.80±2.952.14±0.34假手术组16.60±5.6815.60±2.302.07±0.45OVX组 203.40±29.68*#184.00±26.45*#1.07±0.34*#F值187.113198.46612.392P值<0.001<0.001<0.001
2.2 IRS-1基因高表达对油红O染色结果和成脂分化相关蛋白表达的影响 BMSCs成脂诱导14 d后,对其进行油红O染色,结果发现,应用pCMV-IRS-1转染后,IRS-1组BMSCs的脂滴明显少于空白对照组和阴性对照组(图2A)。进一步对油红O吸光度进行定量分析后发现,3组油红O吸光度差异有统计学意义(P<0.05),IRS-1高表达组吸光度值低于空白对照组和阴性对照组,差异有统计学意义(P<0.05),空白对照组和阴性对照组吸光度值差异无统计学意义(P>0.05)。BMSCs成骨诱导3 d后,采用Western blot方法对成脂分化相关蛋白TAZ、C/EBPβ、PPARγ的表达水平进行分析,结果发现,IRS-1组TAZ的表达量明显高于空白对照组和阴性对照组,C/EBPβ、PPARγ的表达量明显低于空白对照组和阴性对照组(图2B)。进一步对蛋白条带灰度值进行定量分析后发现,3组TAZ、C/EBPβ、PPARγ的表达量差异有统计学意义(P<0.05), IRS-1组TAZ的表达量高于空白对照组和阴性对照组,C/EBPβ、PPARγ的表达量低于空白对照组和阴性对照组,差异有统计学意义(P<0.05),空白对照组和阴性对照组TAZ、C/EBPβ、PPARγ的表达量差异无统计学意义(P>0.05)。见表2。
表2 IRS-1基因高表达对油红O染色和TAZ、CEBPβ、PPARγ表达影响的定量分析
Table 2 The quantitative analysis of the effects of high expression of IRS-1 mRNA on oil red O staining results and the expression of adipogenic differentiation related proteins![]()

*P值<0.05与空白对照组比较 #P值<0.05与阴性对照组比较(SNK-q检验)
组别 油红O吸光度成脂分化相关蛋白相对表达水平TAZ/GAPDHCEBPβ/GAPDHPPARγ/GAPDH空白对照组0.51±0.010.16±0.020.91±0.110.62±0.07阴性对照组0.50±0.010.18±0.010.84±0.090.63±0.08IRS-1组 0.38±0.02*#0.88±0.09*#0.20±0.01*#0.12±0.01*#F值 78.500175.95367.87667.131P值 <0.001<0.001<0.001<0.001
2.3 IRS-1或TAZ基因敲除对油红O染色结果和成脂分化相关蛋白表达的影响 油红O染色结果提示,SiIRS-1组和SiTAZ组脂滴明显多于空白对照组和阴性对照组(图3A)。进一步对油红O吸光度进行定量分析后发现,4组间油红O吸光度差异有统计学意义(P<0.05),SiIRS-1组和SiTAZ组吸光度值高于空白对照组和阴性对照组,差异有统计学意义(P<0.05), SiIRS-1组和SiTAZ组、空白对照组和阴性对照组吸光度值差异无统计学意义(P>0.05)。Western blot结果显示,SiIRS-1组和SiTAZ组TAZ的表达量明显低于空白对照组和阴性对照组,C/EBPβ、PPARγ的表达量明显高于空白对照组和阴性对照组(图3B)。进一步对蛋白条带灰度值进行定量分析后发现,4间组TAZ、C/EBPβ、PPARγ的表达量差异有统计学意义(P<0.05),SiIRS-1组和SiTAZ组TAZ的表达量低于空白对照组和阴性对照组;C/EBPβ、PPARγ的表达量高于空白对照组和阴性对照组,差异有统计学意义(P<0.05)。SiIRS-1组和SiTAZ组、空白对照组和阴性对照组TAZ、C/EBPβ、PPARγ的表达量差异无统计学意义(P>0.05)。见表3。
表3 IRS-1或TAZ基因敲除对油红O染色和TAZ、CEBPβ、PPARγ表达影响的定量分析
Table 3 The quantitative analysis of the effects of IRS-1 or TAZ knockout on oil red O staining results and the expression of adipogenic differentiation related proteins![]()
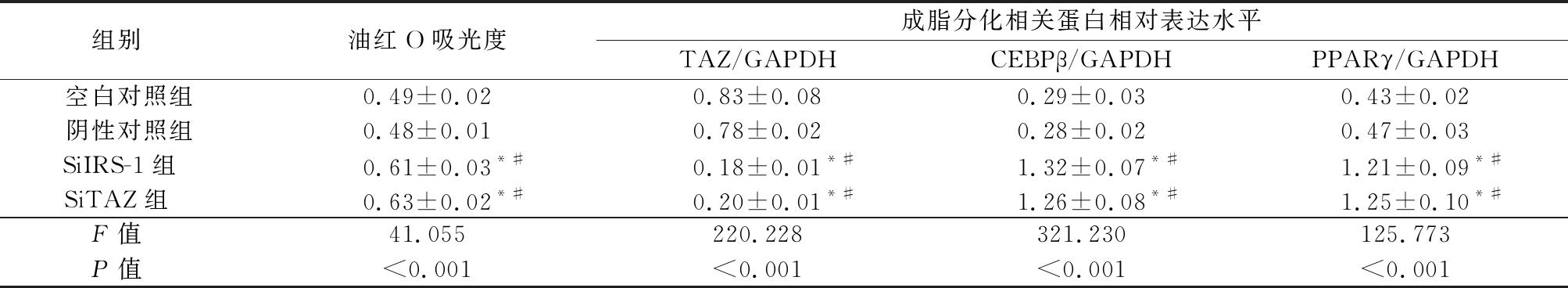
*P值<0.05与空白对照组比较 #P值<0.05与阴性对照组比较(SNK-q检验)
组别 油红O吸光度成脂分化相关蛋白相对表达水平TAZ/GAPDHCEBPβ/GAPDHPPARγ/GAPDH空白对照组0.49±0.020.83±0.080.29±0.030.43±0.02阴性对照组0.48±0.010.78±0.020.28±0.020.47±0.03SiIRS-1组 0.61±0.03*#0.18±0.01*#1.32±0.07*#1.21±0.09*#SiTAZ组 0.63±0.02*#0.20±0.01*#1.26±0.08*#1.25±0.10*#F值 41.055220.228321.230125.773P值 <0.001<0.001<0.001<0.001
3 讨 论
在骨髓微环境中,干细胞除了向成骨细胞分化,还可以向其他类型细胞分化。在干细胞定向分化系统中,成骨细胞和成脂细胞来源于共同的祖细胞,成骨分化和成脂分化之间的信号转导联系最为密切[9]。若BMSCs向成脂细胞分化,则成骨分化信号转导受到抑制,它们之间相互竞争以保持骨髓中不同细胞类型的稳定增长[10]。因此,骨质疏松症患者,尤其是在老年人群,常常伴随骨髓脂肪细胞蓄积。
IRS-1是激素受体后锚定蛋白,能结合下游特定靶分子,进而参与调控多种细胞代谢过程,脂代谢便是其中之一[11]。本研究采用大鼠BMSCs作为研究对象,油红O染色及半定量分析结果表明,过表达IRS-1则BMSCs向成脂细胞分化被抑制,敲低IRS-1则BMSCs向成脂细胞分化增多。既往研究发现,转录共活化因子TAZ可与成脂分化关键转录因子PPARγ结合,减少其下游靶基因转录,从而抑制成脂分化进程[12-13]。作为YAP类似物,TAZ第89位丝氨酸位点被磷酸化后,与14-3-3蛋白结合,将复合体阻滞于细胞质,使复合体进一步蓄积,从而发挥相应信号转导或信号组织作用。目前研究表明,TAZ可能受上游多条信号通路的调控,包括TGFβ、BMP、Wnt等信号通路[14]。可见,胰岛素信号通路的枢纽分子IRS-1也是TAZ的上游信号,可通过靶向调控TAZ表达影响BMSCs向成脂细胞分化的进程。
本研究结果显示,过表达IRS-1则成脂分化标志物C/EBPβ、PPARγ表达下调,敲低IRS-1和TAZ则成脂分化标志物C/EBPβ、PPARγ表达上调。C/EBPs蛋白家族表达于多种细胞类型,广泛参与调控细胞增殖、凋亡、分化等生命过程[15]。目前已发现6个C/EBPs蛋白家族成员:C/EBPα、C/EBPβ、C/EBPγ、C/EBPδ、C/EBPε和C/EBPζ(又称为CHOP-10)。其中,C/EBPβ和C/EBPδ是脂肪细胞分化早期标志物,在成脂分化诱导剂处理后,脂肪细胞前体中C/EBPβ、C/EBPδ表达即可达峰。更重要的是,即使不添加成脂诱导剂,C/EBPβ也可促使脂肪细胞前体进入脂肪细胞分化程序。另一方面,PPARs是一类配体激活核转录因子超家族,包括3种亚型:PPARα、PPARβ和PPARγ[16]。在成脂分化早期,活化的C/EBPβ和C/EBPδ将进一步激活C/EBPα和PPARγ。C/EBPα和PPARγ不仅促进自身表达,同时还能促进相互表达,并且对大部分脂肪细胞分化的特异性基因(如aP2、GLUT4等)的表达是必不可少的[17]。本研究结果显示,过表达IRS-1引起C/EBPβ、PPARγ表达下调,说明成脂分化信号转导部分阻断。反之,敲低IRS-1和TAZ引起C/EBPβ、PPARγ表达上调,说明成脂分化信号转导增强。可见,IRS-1/TAZ信号通路可通过C/EBPβ、PPARγ调控BMSCs成脂分化进程。
综上所述,IRS-1通过上调TAZ表达,抑制BMSCs向脂肪细胞分化。因此,IRS-1/TAZ信号可作为控制骨质疏松症骨髓脂肪化的重要靶点。(本文图见封三)
[1] Muruganandan S,Govindarajan R,Sinal CJ. Bone marrow adipose tissue and skeletal health[J]. Curr Osteoporos Rep,2018,16(4):434-442.
[2] Cignarelli A,Genchi VA,Perrini S,et al. Insulin and insulin receptors in adipose tissue development[J]. Int J Mol Sci,2019,20(3):759.
[3] Tseng YH,Butte AJ,Kokkotou E,et al. Prediction of preadipocyte differentiation by gene expression reveals role of insulin receptor substrates and necdin[J]. Nat Cell Biol,2005,7(6):601-611.
[4] Kim JN,Han SN,Kim HK. Phytic acid and myo-inositol support adipocyte differentiation and improve insulin sensitivity in 3T3-L1 cells[J]. Nutr Res,2014,34(8):723-731.
[5] Kanai F,Marignani PA,Sarbassova D,et al. TAZ: a novel transcriptional co-activator regulated by interactions with 14-3-3 and PDZ domain proteins[J]. EMBO J,2000,19(24):6778-6791.
[6] Byun MR,Jeong H,Bae SJ,et al. TAZ is required for the osteogenic and anti-adipogenic activities of kaempferol[J]. Bone,2012,50(1):364-372.
[7] Park JS,Kim M,Song NJ,et al. A reciprocal role of the Smad4-Taz axis in osteogenesis and adipogenesis of mesenchymal stem cells[J]. Stem Cells,2019,37(3):368-381.
[8] Ma H,Ma JX,Xue P,et al. Osteoblast proliferation is enhanced upon the insulin receptor substrate 1 overexpression via PI3K signaling leading to down-regulation of NFkappaB and BAX pathway[J]. Exp Clin Endocrinol Diabetes,2015,123(2):126-131.
[9] Muruganandan S,Sinal CJ. The impact of bone marrow adipocytes on osteoblast and osteoclast differentiation[J]. IUBMB Life,2014,66(3):147-155.
[10] Muruganandan S,Govindarajan R,McMullen NM,et al. Chemokine-like receptor 1 is a novel wnt target gene that regulates mesenchymal stem cell differentiation[J]. Stem Cells,2017,35(3):711-724.
[11] Yazici D,Sezer H. Insulin resistance,obesity and lipotoxicity[J]. Adv Exp Med Biol,2017,960:277-304.
[12] Byun MR,Lee CH,Hwang JH,et al. Phorbaketal a inhibits adipogenic differentiation through the suppression of PPARgamma-mediated gene transcription by TAZ[J]. Eur J Pharmacol,2013,718(1/3):181-187.
[13] Xue P,Wu X,Zhou L,et al. IGF1 promotes osteogenic differentiation of mesenchymal stem cells derived from rat bone marrow by increasing TAZ expression[J]. Biochem Biophys Res Commun,2013,433(2):226-231.
[14] Futakuchi A,Inoue T,Wei FY,et al. YAP/TAZ are essential for TGF-beta2-mediated conjunctival fibrosis[J]. Invest Ophthalmol Vis Sci,2018,59(7):3069-3078.
[15] Guo L,Li X,Tang QQ. Transcriptional regulation of adipocyte differentiation: a central role for CCAAT/enhancer-binding protein(C/EBP) beta[J]. J Biol Chem,2015,290(2):755-761.
[16] Barquissau V,Ghandour RA,Ailhaud G,et al. Control of adipogenesis by oxylipins,GPCRs and PPARs[J]. Biochimie,2017,136:3-11.
[17] Siersbaek R,Nielsen R,Mandrup S. PPARgamma in adipocyte differentiation and metabolism--novel insights from genome-wide studies[J]. FEBS Lett,2010,584(15):3242-3249.