颅脑损伤作为青壮年致死致残的主要原因之一,严重威胁着全球人类的寿命和生活质量[1]。既往研究表明,格拉斯哥昏迷评分为3~8分的颅脑损伤患者病死率急剧升高,称之为重度颅脑损伤[2]。其中,硬膜下血肿是重度颅脑损伤中最为常见的类型,及时清除硬膜下血肿,减轻颅内压力急剧升高是治疗此类重度颅脑损伤的重要治疗手段[3]。此类患者接受去骨减压术和(或)颅内血肿清除术过程中,围术期并发凝血功能障碍的发生率为29.0%~41.4%,可造成非术区延迟性颅内血肿(delayed traumatic intracranial hematoma,DTIH)和二次手术发生率的增加。DTIH是颅脑损伤行开颅手术后并发非手术区颅内血肿,作为一种严重的神经外科术后并发症,可造成患者远期预后不良[4]。部分学者认为在硬脑膜开放前,早期应用新鲜冰冻血浆可有效纠正重症颅脑损伤患者的凝血功能障碍,改善预后认知功能[5];然而,近年来部分学者认为早期输注新鲜冰冻血浆对颅脑损伤患者的凝血功能改善影响甚微,甚至会增加DTIH的发生率[6]。因此,早期输注新鲜冰冻血浆能否增加术后DTIH的发生率尚不清楚。本课题探讨了早期输注新鲜冰冻血浆对颅脑损伤致硬膜下血肿患者术后DTIH的影响,并筛选术后DTIH发生的相关危险因素。
1 资 料 与 方 法
1.1 一般资料 本研究为回顾性、多中心临床研究,回顾性收集2018年1月1日—2019年6月30日于沧州市中心医院、沧州市人民医院、沧州市第二人民医院在全身麻醉下行硬膜下血肿清除术的急诊重度颅脑损伤患者197例,据患者是否发生DTIH分为DTIH组和非延迟性颅内血肿组(non-delayed traumatic intracranial hematoma,NDTIH)。本研究最终共纳入患者197例,其中DTIH组32例,NDTIH组患者165例,术后非术区DTIH的发生率为16.2%;术后30 d内共有53例患者死亡,病死率为26.9%,其中DTIH组18例,NDTIH组患者35例。
1.2 入选标准和排除标准 入选标准:①年龄18~75岁;②格拉斯哥昏迷评分3~8分;③创伤性昏迷资料库评分≥4分;排除标准:①合并严重的心、肺、肝脏、肾脏功能不全的患者;②痴呆或有先天性中枢神经系统性疾病的患者;③颅脑损伤发生后>24 h;④病例资料不完整。
1.3 研究方法 患者在麻醉诱导前均接受标准的颅脑损伤术中监测,包括有创动脉压、脉搏血样饱和度、5导联心电监护和鼻咽温度。所有患者均在全身麻醉下完成手术,丙泊酚2.0~3.5 mg/L靶控维持,瑞芬太尼0.25~0.4 μg·kg-1·min-1持续泵入,每40~50 min给予顺式阿曲库铵0.1 mg/kg,术中根据血压、心率等情况适当调节麻醉用药量。术中通气模式为容量控制通气模式,潮气量设定为8 mL/kg。调整通气频率维持呼气末二氧化碳为30~35 cmH2O(1 cmH2O=0.098 kPa)。新鲜气体流量为2 L/min,吸入氧气与空气比例为1∶2。监测心电图、有创动脉压、脉搏血氧饱和度(Drager Infinity Delta,德国)、呼气末二氧化碳分压,肺顺应性(Drager Primus,德国),尿量。当术中平均动脉压<60 mmHg(1 mmHg=0.133 kPa)时,间断或持续泵注去甲肾上腺素,并根据患者的出血量以及失液量调整术中输液量,维持脑灌注压力。患者血小板计数≤50×109/L,国际标准化比值(international normalized ratio,INR)≥ 2.0,或血红蛋白≤70 g/L,必须接受相关血制品的输注;血小板计数>50×109/L,INR<2.0,或血红蛋白>70 g/L时,麻醉医生可根据患者的实际状态选择或不选择输注相关血制品。手术结束后,丙泊酚2.0~3.0 mg/L靶控维持,控制呼吸返回神经外科重症监护病房。
1.4 观察指标 记录患者性别、年龄、身高、体重、格拉斯哥昏迷评分、初始损伤评分、血肿部位、血肿量、手术方式、外伤后至手术时间、尿量、手术出血量、红细胞输注量、新鲜冰冻血浆输注量、晶体输注量、胶体输注量。记录患者术后延迟性颅内血肿的发生情况。根据既往文献报道[7-8],将硬脑膜开放前接受新鲜冰冻血浆输注定义为早期输注,并记录早期输注新鲜冰冻血浆情况。记录围术期患者实验室检查指标,包括血红蛋白、血小板计数、INR。术后30 d内每日进行术后随访,记录死亡情况。
1.5 统计学方法 应用SPSS 19.0软件分析数据。计量资料比较采用独立样本t检验,计数资料比较采用χ2检验或Fisher精确性检验,将组间比较差异有统计学意义的因素进行二元逻辑回归分析,筛选术后延迟性颅内血肿发生的危险因素。P<0.05为差异有统计学意义。
2 结 果
2.1 一般资料的比较 与NDTIH组比较,DTIH组患者性别、年龄、体重指数、初始创伤评分、外伤后至手术时间、术前平均动脉压、心率及术前实验室检查差异无统计学意义(P>0.05)。与NDTIH组比较,DTIH组患者术前格拉斯哥昏迷评分显著降低,差异有统计学意义(P<0.05)。见表1。
表1 两组患者一般资料比较
Table 1 Comparison of general data between two groups
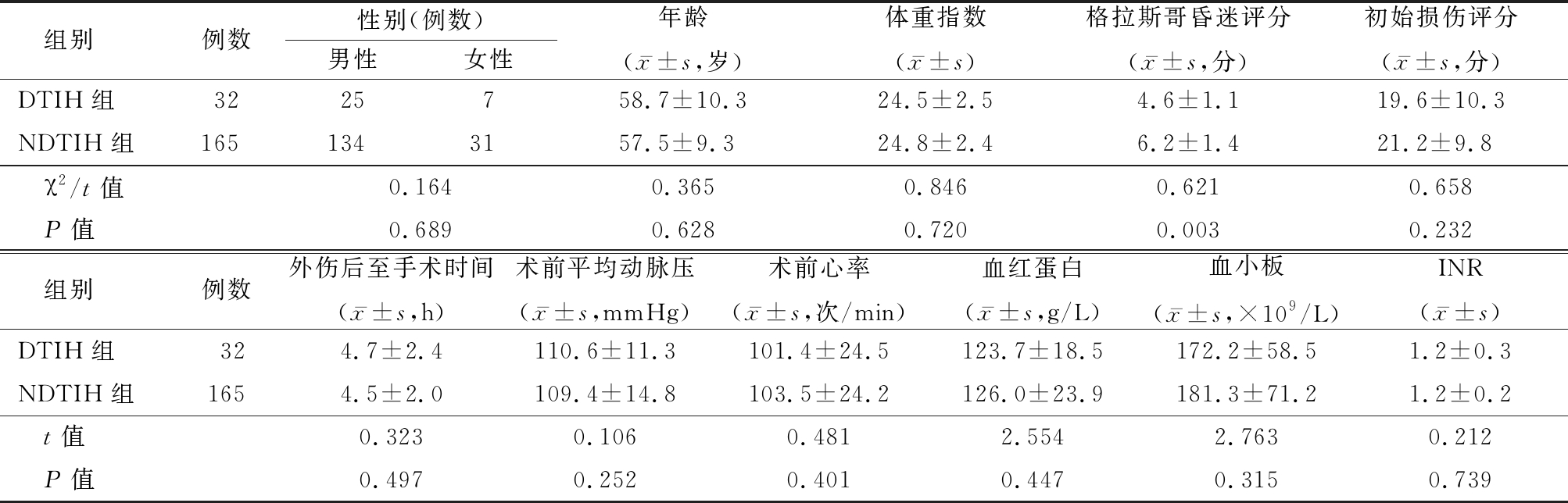
组别例数性别(例数)男性女性年龄(x-±s,岁)体重指数(x-±s)格拉斯哥昏迷评分(x-±s,分)初始损伤评分(x-±s,分)DTIH组3225758.7±10.324.5±2.54.6±1.119.6±10.3NDTIH组1651343157.5±9.324.8±2.46.2±1.421.2±9.8 χ2/t值0.1640.3650.8460.6210.658 P值0.6890.6280.7200.0030.232 组别例数外伤后至手术时间(x-±s,h)术前平均动脉压(x-±s,mmHg)术前心率(x-±s,次/min)血红蛋白(x-±s,g/L)血小板(x-±s,×109/L)INR(x-±s)DTIH组324.7±2.4110.6±11.3101.4±24.5123.7±18.5172.2±58.51.2±0.3NDTIH组1654.5±2.0109.4±14.8103.5±24.2126.0±23.9181.3±71.21.2±0.2 t值0.3230.1060.4812.5542.7630.212 P值0.4970.2520.4010.4470.3150.739
2.2 血肿特征的比较 2组患者在血肿部位和手术方式差异无统计学意义(P>0.05)。与NDTIH组比较,DTIH组患者血肿量显著增加,差异有统计学意义(P<0.05)。见表2。
表2 两组患者血肿特征的比较
Table 2 Comparison of hematoma characteristics between two groups (例数)
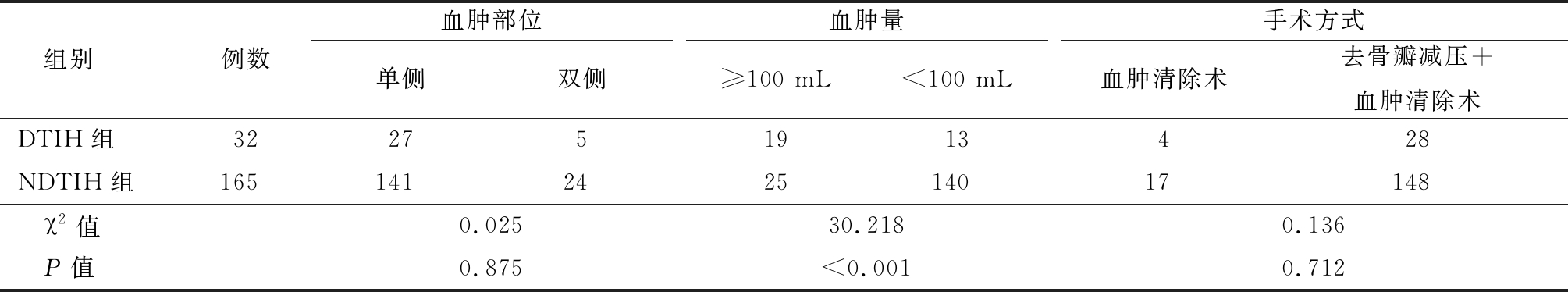
组别例数血肿部位单侧双侧血肿量≥100 mL<100 mL手术方式血肿清除术去骨瓣减压+血肿清除术DTIH组322751913428NDTIH组165141242514017148 χ2值0.02530.2180.136 P值0.875<0.0010.712
2.3 术中指标的比较 与NDTIH组比较,DTIH组患者早期输注新鲜冰冻血浆比例显著增高,差异有统计学意义(P<0.05),2组患者手术时间、晶体输注量、出血量、尿量、红细胞输注量、新鲜冰冻血浆输注量和自体血输注量差异无统计学意义(P>0.05)。见表3。
表3 两组患者术中情况比较
Table 3 Comparison of peri-operative data between two groups![]()
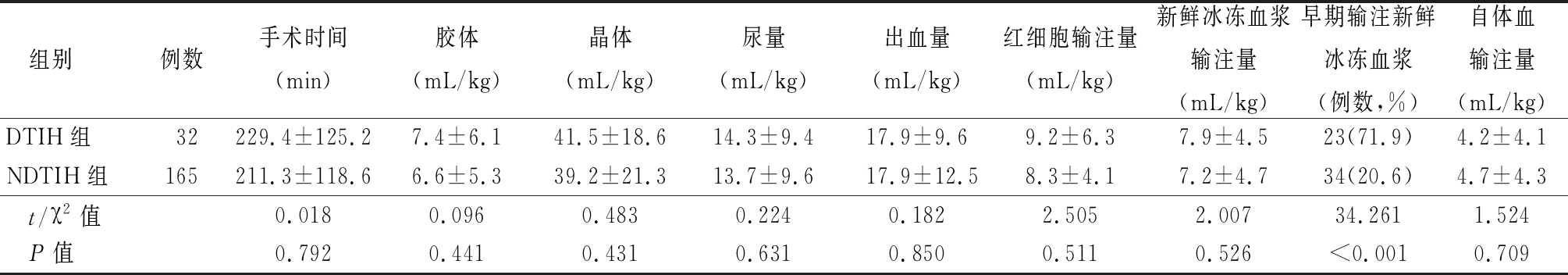
组别例数手术时间(min)胶体(mL/kg)晶体(mL/kg)尿量(mL/kg)出血量(mL/kg)红细胞输注量(mL/kg)新鲜冰冻血浆输注量(mL/kg)早期输注新鲜冰冻血浆(例数,%)自体血输注量(mL/kg)DTIH组32229.4±125.27.4±6.141.5±18.614.3±9.417.9±9.69.2±6.37.9±4.523(71.9)4.2±4.1NDTIH组165211.3±118.66.6±5.339.2±21.313.7±9.617.9±12.58.3±4.17.2±4.734(20.6)4.7±4.3 t/χ2值0.0180.0960.4830.2240.1822.5052.00734.2611.524 P值0.7920.4410.4310.6310.8500.5110.526<0.0010.709
2.4 二元回归分析 根据表4赋值,将数据纳入二元回归分析结果显示,格拉斯哥昏迷评分(OR=4.23,95%CI=1.62~8.72,P<0.001)、血肿量≥100 mL(OR=5.39,95%CI=1.75~9.38,P<0.001)以及早期输注新鲜冰冻血浆(OR=1.54,95%CI=1.27~4.29,P=0.016)是术后DTIH发生的危险因素。见表5。
表4 二元逻辑回归变量赋值
Table 4 Assignment description of binary logistic regression factors

因素赋值格拉斯哥昏迷评分连续型变量早期输注新鲜冰冻血浆有=1;无=0血肿量≥100 mL=1;<100 mL=0
表5 术后延迟性颅内血肿的危险因素分析
Table 5 The analysis of risk factors in patients with post-operative delayed traumatic intracranial hematoma
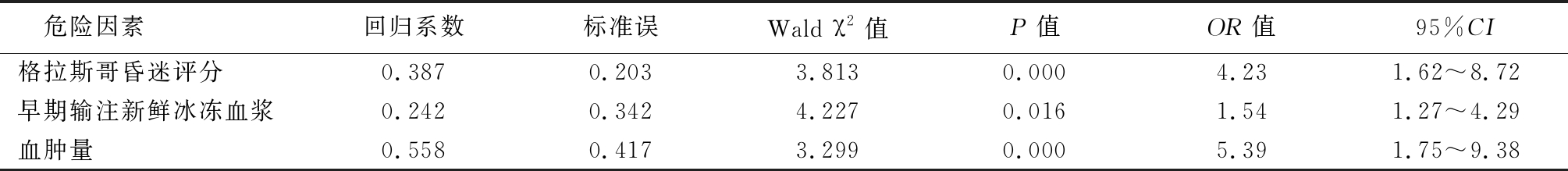
危险因素回归系数标准误Wald χ2值P值OR值95%CI格拉斯哥昏迷评分0.3870.2033.8130.0004.231.62~8.72早期输注新鲜冰冻血浆0.2420.3424.2270.0161.541.27~4.29血肿量0.5580.4173.2990.0005.391.75~9.38
3 讨 论
重度颅脑损伤致硬膜下血肿的患者常需要通过去骨瓣减压和(或)颅内血肿清除术到达降低颅内压力的目的,减少因颅内压力的急剧升高造成的神经细胞缺氧,改善远期预后[9-10]。由于创面消耗大量的凝血物质,因此,围术期凝血功能障碍是影响重度颅脑损伤患者预后的重要因素,而非术区DTIH是凝血功能障碍的严重并发症[11]。本研究结果表明,DTIH的发生率为16.2%,与既往文献报道类似,DTIH可导致颅脑损伤后硬膜下血肿患者病死率的显著升高[12]。
与非DTIH患者比较,DTIH的患者格拉斯哥昏迷评分显著下降,血肿量显著增加,而在二元回归分析中,格拉斯哥昏迷评分的下降和血肿量增加也是DTIH发生的危险因素。既往研究表明,随着格拉斯哥昏迷评分的下降,血肿量增加,重度颅脑损伤的患者生存率显著下降,可能与颅内压力急剧升高相关[13]。颅内压力的急剧升高通常表明硬膜下出血量较大,脑水肿严重,围术期发生凝血功能障碍的风险显著升高[14-15]。因此,对于格拉斯哥昏迷评分显著下降的患者,围术期应当做好应对和改善凝血功能障碍的准备。
为了改善重度颅脑损伤患者围术期凝血功能障碍,输注新鲜冰冻血浆是围术期凝血管理的常用手段。新鲜冰冻血浆中富含有大量的凝血因子,既往研究表明,输注新鲜冰冻血浆可显著改善重症颅脑损伤患者的凝血功能障碍,但是输注的时机仍然存在争议[16]。部分学者认为重度颅脑损伤的患者,当格拉斯哥昏迷评分≤6分时,可经验性的输注新鲜冰冻血浆[5,17];重度颅脑损伤的患者在接受大量输血的情况下,需要提高新鲜冰冻血浆的输注比例[18-19]。但近年来发现重度颅脑损伤的患者即使接受了新鲜冰冻血浆(10~15 mL/kg)输注后,DTIH发生率仍然会增加,并显著升高病死率[20];新鲜冰冻血浆与红细胞的输注比例大于1∶1.5时,术后呼吸窘迫综合征的发生率显著升高[21]。本研究表明,早期输注新鲜冰冻血浆是重症颅脑损伤致硬膜下血肿患者术后延迟性血肿发生的独立危险因素,因此,在颅脑损伤致硬膜下血肿患者中,应当限制性使用新鲜冰冻血浆的输注,减少术后DTIH及二次手术的发生率。
既往研究表明,重度颅脑损伤患者围术期由于创面大,出血速度快,常在短时间内消耗大量的凝血成分,包括纤维蛋白原、凝血因子及血小板[22]。早期输注新鲜冰冻血浆即使能够补充被消耗的纤维蛋白原、凝血因子,但由于本身有较高的胶体渗透压,可导致血容量的迅速升高,血小板浓度被稀释,反而不利于创面血栓的形成[7,23]。
综上所述,颅脑损伤致硬膜下血肿患者术后DTIH的发生可能与早期输注新鲜冰冻血浆相关,因此建议围术期限制性使用新鲜冰冻血浆的输注,减少术后DTIH的发生。
[1] Herbert JP,Guillotte AR,Hammer RD,et al. Coagulopathy in the setting of mild traumatic brain injury:truths and consequences[J]. Brain Sci,2017,7(7):92.
[2] 高维玲,胡玉萍,贾应茂,等.院前急救中不同评分系统评估颅脑损伤患者病情及预后价值比较[J].昆明医科大学学报,2019,40(8):88-92.
[3] 焦保华,赵宗茂. 《第4版美国重型颅脑损伤诊疗指南》解读[J]. 河北医科大学学报,2018,39(2):125-128.
[4] Epstein DS,Mitra B,O'Reilly G,et al. Acute traumatic coagulopathy in the setting of isolated traumatic brain injury:a systematic review and meta-analysis[J]. Injury,2014,45(5):819-824.
[5] Halaweish I,Bambakidis T,He W,et al. Early resuscitation with fresh frozen plasma for traumatic brain injury combined with hemorrhagic shock improves neurologic recovery[J]. J Am Coll Surg,2015,220(5):809-819.
[6] Zhang L,Li R,Zhao X,et al. Increased transfusion of fresh frozen plasma is associated with mortality or worse functional outcomes after severe traumatic brain injury:a retrospective study[J]. World Neurosurg,2017,104:381-389.
[7] Zhang L,Li R,Sun W,et al. Low-dose,early fresh frozen plasma transfusion therapy after severe trauma brain injury:a clinical,prospective,randomized,controlled study[J]. World Neurosurgery,2019,132:e21-e27.
[8] Spinella PC,Holcomb JB. Resuscitation and transfusion principles for traumatic hemorrhagic shock[J]. Blood Rev,2009,23(6):231-240.
[9] Starke RM,Komotar RJ,Connolly ES. Decompressive craniectomy for traumatic intracranial hypertension[J]. Neurosurgery,2017,80(3):N10-N11.
[10] Shih F,Chang H,Wang H,et al. Risk factors for delayed neuro-surgical intervention in patients with acute mild traumatic brain injury and intracranial hemorrhage[J]. World J Emerg Surg,2016,11(1):13.
[11] Orlando A,Levy AS,Carrick MM,et al. Epidemiology of mild traumatic brain injury with intracranial hemorrhage:focusing predictive models for neurosurgical intervention[J]. World Neurosurg,2017,107:94-102.
[12] Almufti F,Amuluru K,Lander M,et al. Low glasgow coma score in traumatic intracranial hemorrhage predicts development of cerebral vasospasm[J]. World Neurosurg,2018,120:e68-e71.
[13] Muballe KD,Sewanirusike CR,Longombenza B,et al. Predictors of recovery in moderate to severe traumatic brain injury[J]. J Neurosurg,2018,1(5):1-10.
[14] Yuan Q,Yu J,Wu X,et al. Prognostic value of coagulation tests for in-hospital mortality in patients with traumatic brain injury[J]. Scand J Trauma Resusc Emerg Med,2018,26(1):3.
[15] Stolla M,Zhang F,Meyer M,et al. Current state of transfusion in traumatic brain injury and associated coagulopathy[J]. Transfusion,2019,59:1522-1528.
[16] Galvagno SM Jr,Fox EE,Appana SN,et al. Outcomes after concomitant traumatic brain injury and hemorrhagic shock:a secondary analysis from the pragmatic,randomized optimal platelets and plasma ratios trial[J].J Trauma Acute Care Surg,2017,83(4):668-674.
[17] Martin G,Shah D,Elson N,et al. Relationship of coagulopathy and platelet dysfunction to transfusion needs after traumatic brain injury[J]. Neurocrit Care,2018,28(3):330-337.
[18] Roquet F,Neuschwander A,Hamada S,et al. Association of early,high plasma-to-red blood cell transfusion ratio with mortality in adults with severe bleeding after trauma[J]. JAMA Netw Open,2019,2(9):e1912076.
[19] Lopez E,Srivastava AK,Burchfield J,et al. Platelet-derived-extracellular vesicles promote hemostasis and prevent the development of hemorrhagic shock[J]. Sci Rep,2019,9(1):17676.
[20] Synnot A,Bragge P,Lunny C,et al. The currency,completeness and quality of systematic reviews of acute management of moderate to severe traumatic brain injury:a comprehensive evidence map[J]. PLoS One,2018,13(6):e0198676.
[21] da Luz LT,Shah PS,Strauss R,et al. Does the evidence support the importance of high transfusion ratios of plasma and platelets to red blood cells in improving outcomes in severely injured patients:a systematic review and meta-analyses[J]. Transfusion,2019,59(11):3337-3349.
[22] Brockman EC,Jackson TC,Dixon CE,et al. Polynitroxylated pegylated hemoglobin:a novel,small volume therapeutic for traumatic brain injury resuscitation:comparison to whole blood and dose response evaluation[J]. J Neurotrauma,2016,34(7):1337-1350.
[23] Furay E,Daley M,Teixeira PGR,et al. Goal-directed platelet transfusions correct platelet dysfunction and may improve survival in patients with severe traumatic brain injury[J]. J Trauma Acute Care Surg,2018,85(5):881-887.