内镜下逆行胰胆管造影术(endoscopic retrograde cholangiopancreatography,ERCP)目前已成为临床诊断和治疗胆胰疾病的重要手段,随着乳头括约肌切开术、乳头气囊扩张术、鼻胆引流管、胆管支架引流等相关技术的不断革新和推广,临床应用越来越广泛。由于ERCP为侵入性手术、操作相对复杂,术后会出现一些并发症,如术后出血、穿孔、胰腺炎和高淀粉酶血症等。其中,ERCP术后胰腺炎(post-ERCP pancreatitis,PEP)是最常见的并发症,其在人群中的发生率约为9.7%,在高危人群中发生率甚至可高达14.7%[1]。研究表明,PEP对患者的生活质量、体力及工作能力可造成长期损伤,严重者甚至危及生命[2]。PEP的发生受患者及操作因素共同影响,早期的干预是降低其发生率和患者损伤、病死率的重要手段[3-4]。近年来通过药物和机械手段预防PEP取得了一些进展,但对于生长抑素预防PEP的作用仍没有统一的意见。该研究旨在探讨生长抑素预防性应用对ERCP术后PEP和高淀粉酶血症发生率的作用,并观察不同用药时间的预防效果,以期为临床用药提供试验依据。
1 资 料 与 方 法
1.1 一般资料 选取2017年6月—2018年12月在河北省沧州市中心医院拟行ERCP治疗的280例患者。纳入标准:①术前淀粉酶在正常范围;②无急慢性胰腺炎病史;③无十二指肠乳头切开患者;④无严重心肺功能障碍等ERCP禁忌证患者。采用随机数字表平均分为4组,每组70例。A组年龄20~95岁,胆总管结石46例,其中胆道术后12例,胆总管结石合并胆囊结石10例,胰头癌4例,胆管恶性肿瘤10例,高血压病、冠心病、糖尿病等共43例,其他手术史共5例;B组年龄24~99岁,胆总管结石49例,其中胆道术后15例,胆总管结石合并胆囊结石8例,胰头癌5例,胆管恶性肿瘤8例,高血压病、冠心病、糖尿病等共40例,其他手术史共8例;C组年龄33~97岁,胆总管结石50例,其中胆道术后11例,胆总管结石合并胆囊结石7例,胰头癌5例,胆管恶性肿瘤8例,高血压病、冠心病、糖尿病等共37例,其他手术史共9例;D组年龄21~98岁,胆总管结石47例,其中胆道术后14例,胆总管结石合并胆囊结石9例,胰头癌5例,胆管恶性肿瘤9例,高血压病、冠心病、糖尿病等疾病共40例,其他手术史共7例。不同组间患者性别、年龄及内镜手术情况比较差异无统计学意义(P>0.05),具有可比性。见表1。
表1 患者一般资料和内镜手术情况
Table 1 Basic characteristics of patients and details of endoscopic surgery (n=70,例数)
组别男性年龄(x-±s,岁)胆道术后乳头括约肌切开术乳头括约肌切开术+乳头气囊扩张术胆道金属支架引流胆道塑料支架引流鼻胆管引流胰管插管≥3A组3165.6±16.912462486568B组3367.9±14.515432758575C组3869.9±13.311492197547D组3467.1±15.0144525710538χ2/F值1.4870.9830.9451.1831.1831.3461.2700.8480.952P值0.6850.4010.8150.7570.7570.7180.7360.8380.813
1.2 方法
1.2.1 术前常规准备 术前完善血常规+凝血常规、肝肾功能、血淀粉酶、常规心电图等检查,评估患者一般情况;术前禁食水6 h以上,根据患者情况术前30 min肌肉注射地西泮、山莨菪碱、盐酸哌替啶,增加患者对手术的耐受性;术前5 min口服盐酸达克罗宁胶浆1支,起到咽部麻醉、润滑、去除术中泡沫情况。术中常规心电监测、吸氧3 L/分。
1.2.2 预防方法 所有患者均由同一个医师操作,A组(对照组)不使用生长抑素(3 mg/支,扬子江药业集团,国药准字H20066708);试验组分为三组即B组、C组、D组,分别于术前1 h、术后即刻、术后3 h微量泵泵入生长抑素氯化钠溶液(3 mg生长抑素溶于48 mL 0.9%氯化钠)4 mL/h(生长抑素250 μg/h)持续24 h,共计6 mg。
ERCP术后观察患者生命体征,腹痛、发热等情况,禁食水,常规吸氧、心电监测6 h,给予抑酸、抗感染、补液等治疗。
1.2.3 观察指标 分别于术前、术后5 h、24 h检测血淀粉酶水平,观察高淀粉酶血症及PEP发生情况。
PEP诊断标准:①存在与急性胰腺炎相符合的腹痛症状及体征;② 术后24 h内血淀粉酶超过正常上限3倍以上;③ 影像学检查提示胰腺肿大、渗出等表现,3项指标具备其中2项即刻诊断为PEP[5];高淀粉酶血症诊断:ERCP术后血淀粉酶高于正常上限即定义为高淀粉酶血症[6]。
1.3 统计学方法 应用SPSS 21.0软件处理数据。计数资料比较采用χ2检验,计量资料组间比较采用重复测量方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1 并发症情况比较 B、C、D组术后高淀粉酶血症和PEP发生率均显著低于A组,差异有统计学意义(P均<0.05)。B、C、D组ERCP术后高淀粉酶血症及PEP的发生率组间比较差异无统计学意义(P>0.05),见表2。
表2 ERCP术后高淀粉酶血症和PEP的发生情况
Table 2 Incidence of hyperamylasemia and pancreatitis after ERCP (n=70,例数,%)
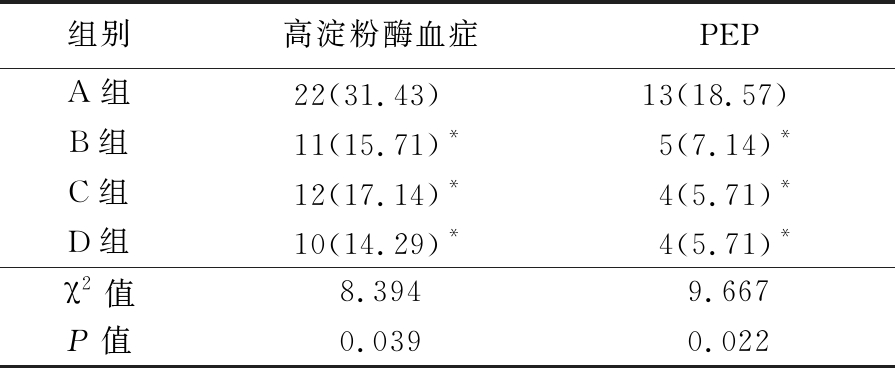
*P值<0.05与A组比较(χ2检验)
组别高淀粉酶血症PEPA组22(31.43) 13(18.57) B组11(15.71)*5(7.14)*C组12(17.14)*4(5.71)*D组10(14.29)*4(5.71)*χ2值8.3949.667P值0.0390.022
2.2 各组ERCP术前、术后5 h、术后24 h血淀粉酶水平比较 各组血淀粉酶水平均呈先上升再下降趋势。术前四组间比较均差异均无统计学意义(P>0.05),术后5 h,B、C、D组与A组比较差异有统计学意义(P<0.05),术后24 h,B、C、D组与A组比较差异有统计学意义(P<0.05)。A组各时间比较差异均有统计学意义(P<0.05),B、C组各时间点比较术后5 h和术后24 h差异无统计学意义(P>0.05),D组各时间点比较差异均有统计学意义(P<0.05),见表3。
表3 ERCP术前、术后5 h、术后24 h血淀粉酶水平
Table 3 Serum amylase levels before,5 h and 24 h after ERCP![]()

组别 血清淀粉酶术前术后5 h术后24 hA组 78.1±65.31 167.3±851.5514.9±232.3B组 84.6±61.2299.2±247.5251.4±178.2C组 71.7±53.8332.7±218.9218.3±140.8D组 89.7±61.2345.7±209.3224.4±151.6组间 F值=83.336 P值<0.001 时点间 F值=173.435 P值<0.001 组间·时点间F值=38.888 P值<0.001
2.3 预后 A组发生1例重症胰腺炎,所有胰腺炎患者均经过治疗后痊愈出院,未出现穿孔、死亡等情况。
3 讨 论
ERCP作为临床常用的胆胰疾病诊疗技术,近年来在诊疗手段和并发症的预防方面取得了一些新的进展[7]。PEP是ERCP术后最常见的严重并发症之一,不仅增加了住院时间、住院费用,还给患者增加了痛苦、对患者生活质量和劳动能力造成长期损伤,甚至可恶化为重症胰腺炎危及患者生命。目前PEP的发生机制尚不明确,以下因素可能是其高危因素[8]:①合并异常或怀疑存在Oddi括约肌功能障碍(oddi sphincter dysfunction,SOD)的女性患者;②反复乳头插管或多次进入胰管,导致乳头水肿,括约肌痉挛,胰管内压力增高导致PEP;且胰管插管次数越多,术后PEP的发生率越高;③胰管内高压注入造影剂或造影剂注入过多或多次胰管造影会造成胰腺实质显影,这是造成PEP的另一个重要原因;④胆管或胰管括约肌切开、局部出血热凝固导致胰管开口水肿,胰液流出不畅;⑤外源性物质如胆汁、胃液进入胰管激活蛋白水解酶引起酶的损伤;⑥以上多种因素最终导致胰管内高压,腺泡内Ca2+水平显著上升,溶酶体在腺泡细胞内提前激活酶原,大量活化的胰酶消化胰腺自身,进而损伤胰腺细胞,激活炎症反应因子及炎症介质释放增加血管通透性,导致渗出;或造成胰腺微循环障碍使胰腺出血坏死。
目前,PEP的预防主要采用机械性预防和药物预防。研究充分证实,预防性胰管支架可显著降低PEP的发生率,尤其是高危患者[9-11]。Sugimoto等[12]的研究表明,胰管支架对PEP发生率的作用与其植入部位有关,支架植入胰体或胰尾部可显著降低率PEP及高淀粉酶血症发生率,而支架植入胰头部仍是PEP发生的独立风险因素。常用的预防性药物有非甾体抗炎药(吲哚美辛、双氯芬酸等)、生长抑素类药物、蛋白酶抑制剂等,分别通过作用于炎症反应、胰腺分泌、蛋白酶活性等环节,预防PEP的发生[13-15]。
生长抑素是由胰岛D细胞分泌的一种内源性物质,预防术后胰腺炎可能主要通过下列机制:①胃酸、胃蛋白酶可刺激胰液分泌,生长抑素可抑制胃酸分泌而减少胰液的分泌,缓解胰管高压;②还可以通过抑制胰泌素和缩胆囊素刺激的胰液基础分泌;③生长抑素可以松弛Oddis括约肌降低插管难度和风险,促进术后胰液流出预防PEP[16];④有研究表明生长抑素减少内脏血流量和抑制迷走神经兴奋作用,从而减少胰酶和胰液的分泌[17];⑤急性胰腺炎早期炎症介质的释放等多因素参与可以正反馈方式相互作用,形成瀑布效应,有研究表明生长抑素对重症急性胰腺炎时炎症有调控作用[18];⑥马晓莹[19]研究生长抑素可以通过刺激肝脏的网状内皮细胞系统,增加细胞的吞噬功能,有利于消除患者血液中的内毒素,从而缓解全身炎症反应。尽管生长抑素常用于急性胰腺炎的临床治疗,但其对ERCP术后PEP的发生的预防作用迄今为止尚无确切定论。Wang等[20]的研究表明,24 h持续泵入生长抑素12 mg仅对高淀粉酶血症有预防作用,而对PEP发生无明显预防作用(术前、术后应用生长抑素组及对照组PEP发生率分别为16.7%、10.6%、14.6%,P=0.715)。潘树波等[21]对包含3 268例患者数据的临床研究进行Meta分析,认为大剂量持续泵入生长抑素可预防PEP的发生,而小剂量或单次注射无效。Hu等[22]对包含4 192例患者数据的临床研究进行Meta分析,认为单次注射、长期泵注或大剂量应用生长抑素,均可明显减少PEP、高淀粉酶血症的发生率。Wang等[23] 认为大剂量持续泵入生长抑素(≥2.5 mg,持续至少10 h)可预防PEP、高淀粉酶血症的发生。本研究纳入的患者组间具有可比性,排除了性别、年龄、手术情况的干扰;采用24 h持续微量泵泵入生长抑素6 mg,分别于术前、术后即刻、术后3 h大剂量预防性应用,可显著降低高淀粉酶血症(15.7%、17.1%、14.3% vs 31.4%)、PEP(7.1%、5.7%、5.7% vs 18.6%)的发生率。药代动力学表明生长抑素75 μg/h持续泵入,15 min后可达到峰值浓度,该研究以250 μg/h持续用药维持了峰值浓度,结果降低了ERCP术后高淀粉酶血症及PEP发生率,表明预防作用肯定。对于术前1 h、术后3 h内应用预防效果无明显差别,推测可能是因为胰腺炎发生时血清淀粉酶水平一般在数小时内升高,该研究术前、术后3 h内大剂量持续应用生长抑素可很快达到并维持峰值浓度,有效抑制血清淀粉酶水平的升高,使其均维持在一个较低水平,组间比较差异无统计学意义。
综上所述,采用24 h持续微量泵泵入生长抑素6 mg,分别于术前、术后即刻、术后3 h预防性应用,可降低ERCP术后高淀粉酶血症及PEP的发生率,术前和术后3 h内用药的预防效果未见明显差别。生长抑素预防性应用的时机、剂量优化还需要大样本的临床研究进一步确证。
[1] Kochar B,Akshintala VS,Afghani E,et al. Incidence,severity,and mortality of post-ERCP pancreatitis:a systematic review by using randomized,controlled trials[J]. Gastrointest Endosc,2015,81(1):143-49.e9.
[2] Leerhoy B,Shabanzadeh DM,Nordholm CA,et al. Quality of life,performance status,and work capacity after post-endoscopic retrograde cholangiopancreatog raphy pancreatitis[J]. Scand J Gastrointerol,2018,53(8):994-999.
[3] 谷保红,李雪梅,胡继科,等.ERCP术后胰腺炎的预防策略[J].中南大学学报(医学版),2019,44(2):209-215.
[4] Morales SJ,Sampath K,Gardner TB. A review of prevention of post-ERCP pancreatitis[J]. Gastrointerol Hepatol(NY),2018,14(5):286-292.
[5] 尹福忠,师水生.生长抑素联合吲哚美辛预防经内镜逆行胰胆管造影术后胰腺炎的作用[J].中华消化内镜杂志,2017,34(5):358-359.
[6] 李兆申,张文俊,潘雪,等.奥曲肽预防ERCP术后胰腺炎及高淀粉酶血症的多中心随机对照临床研究[J].中华消化内镜杂志,2004,21(5):301-305.
[7] 王向平,潘阳林,郭学刚.经内镜逆行胰胆管造影术的若干进展[J].临床肝胆病杂志杂志,2018,34(3):473-481.
[8] Tryliskyy Y,Bryce GJ. Post-ERCP pancreatitis:pathophysiology,early identification and risk stratification[J]. Adv Clin Exp Med,2018,27(1):149-154.
[9] Phillip V,Pukitis A,Epstein A,et al. Pancreatic stenting to prevent post-ERCP pancreatitis:a randomized multicenter trial[J]. Endosc Int Open,2019,7(7):E860-68.
[10] Sahar N,Ross A,Lakhtakia S,et al. Reducing the risk of post-endoscopic retrograde cholangiopancreatography pancreatitis using 4-Fr pancreatic plastic stents placed with common-type guidewires:results from a prospective multinational registry[J]. Dig Endosc,2019,31(3):299-302.
[11] Hakuta R,Hamada T,Nakai Y,et al. Early pancreatic stent placement in wire-guided biliary cannulation:a multicenter retrospective study[J]. J Gastrointerol Hepatol,2019,34(6):1116-1122.
[12] Sugimoto M,Takagi T,Suzuki R,et al. Pancreatic stents for the prevention of post-endoscopic retrograde cholangiopancreatography pancreatitis should be inserted up to the pancreatic body or tail[J]. World J Gastrointerol,2018,24(22):2392-2399.
[13] Serrano JPR,de Moura DTH,Bernardo WM,et al. Nonsteroidal anti-inflammatory drugs versus placebo for post-endoscopic retrograde cholangiopancreatography pancreatitis:a systematic review and meta-analysis[J]. Endosc Int Open,2019,7(4):E477-486.
[14] 蒋鹏,苏树英,费凛,等.吲哚美辛联合生长抑素预防ERCP术后胰腺炎[J].肝胆胰外科杂志,2019,31(4):217-220.
[15] Guglielmi V,Tutimo M,Guerra V,et al. Rectal indomethacin or intravenous gabexate mesylate as prophylaxis for acute pancreatitis post-endoscopic retrograde cholangiopancreatography [J]. Eur Rev Med Pharmacol Sci,2017,21(22):5268-5274.
[16] 毕晓飞,张俊文.不同时期使用生长抑素对预防ERCP术后胰腺炎及高淀粉酶血症的作用[J].重庆医学,2014,29(13):3885-3886.
[17] Berindan-Neagoe I,Burz C,Balaceseu O,et al. Molecular angiogenesisprofile as a tool todiscriminate chronic pancreatitis(CP) from pancreatic cancer(PC) [J]. Pancreas,2011,40(3):482-483.
[18] Szymanskhmed PT,Muley P,Ahmed SA,et al. Sarcophine-diol inhibits xpression of COX-2,inhibits activity of cPLA2,enhances degradation of PLA2 and PLC1 and inhibits cell membrane permeability in mouse melanoma B16F10 cells[J]. Marine Drugs,2012,10(10):2166-2180.
[19] 马晓莹.生长抑素治疗急性胰腺炎90例患者的应用分析[J].当代医学,2013,19(32):84-85.
[20] Wang ZK,Yang YS,Cai FC,et al. Is prophylactic somatostatin effective to prevent post-endoscopic retrograde cholangiopancreatography pancreatitis or hyperamylasemia?A randomized,placebo-controlled pilot trial[J]. Chin Med J(Engl),2013,26(13):2403-2408.
[21] 潘树波,耿小平. 生长抑素预防内镜逆行胰胆管造影术后胰腺炎效果的Meta分析[J]. 中华外科杂志,2016,54(6):466-472.
[22] Hu J,Li PL,Zhang T,et al. Role of somatostatin in preventing post-endoscopic retrograde cholangiopancreatography(ERCP) pancreatitis:an update meta-analysis[J]. Front Phamacol,2016,7:489.
[23] Wang G,Xiao G,Xu L,et al. Effect of somatostatin on prevention of post-endoscopic retrograde cholangiopancreatography pancreatitis and hyperamylasemia:a systematic review and meta-analysis[J]. Pancreatology,2018,18(4):370-378.