宫颈癌在我国临床具有较高的发病率,其发生与高危型人类乳头瘤病毒(human papillomavirus,HPV)感染有密切的关系,高危型HPV是宫颈癌发生的必要条件,故高危型HPV感染是临床研究重点。宫颈腺癌与宫颈鳞癌的预后存在一定差异[1-2]。另外,有研究显示,HPV18感染可能与宫颈腺癌的发生有关,感染HPV18的宫颈癌前病变进展更快,因此对于HPV18感染宫颈癌患者的miRNA表达差异研究意义较高[3-4]。本研究就HPV18在不同病理类型宫颈癌中miRNA表达差异进行探究,现将结果报告如下。
1 资 料 与 方 法
1.1 一般资料 选取2016年7月—2018年6月期间北京大学深圳医院的30例HPV18阳性宫颈腺癌患者为A组,同时期的30例HPV18阳性宫颈鳞癌患者为B组,同时期的15例宫颈正常者为C组。A组年龄29~65岁,平均(46.2±5.0)岁,其中≤45岁者15例,>45岁者15例;分期:Ⅰ~Ⅱ期者13例,Ⅲ~Ⅳ期者17例;分化程度:高分化者11例,中分化者10例,低分化者9例;转移情况:是者13例,否者17例。B组年龄29~65岁,平均(46.5±5.5)岁,其中≤45岁者15例,>45岁者15例;分期:Ⅰ~Ⅱ期者15例,Ⅲ~Ⅳ期者15例;分化程度:高分化者11例,中分化者10例,低分化者9例;转移情况:是者12例,否者18例。C组年龄26~60岁,平均(45.1±5.7)岁,其中≤45岁者8例,>45岁者7例。三组的年龄、A组与B组的分期、分化程度及转移情况比较,差异无统计学意义(P>0.05),具有可比性。纳入标准:①年龄20~65岁者;②未进行相关治疗者;③对研究知情同意者。排除标准:①进行化疗放疗及其他相关治疗者;②合并其他高危型HPV感染者;③合并慢性基础疾病者;④多系统器官功能不全者;⑤妊娠期及哺乳期者;⑥精神与认知异常者。
本研究经医院医学伦理委员会批准,患者签订知情同意书。
1.2 方法 采集A组与B组的病灶组织标本、C组的正常宫颈组织标本送检,标本收集后放-80 ℃保存。随机选取HPV18阳性的宫颈腺癌和鳞癌组织标本各6例以及正常宫颈组织标本6例送往康成生物公司进行miRNA芯片表达检测:样品RNA抽提;RNA质量检测;制备荧光标记探针;芯片杂交图像采集。miRNA芯片检测结果由数据分析员分析,通过芯片中位值对miRNA芯片原始信号值进行标准化,通过标准化后的信号值计算出每个miRNA在不同样品间的表达变化,并计算样品间miRNA表达量变化的统计学显著性。表达变化倍数≥2,P<0.05的miRNA被挑选出来,为显著性差异表达的miRNA。参照TakaRa SYBR PrimeScript miRNA RT-PCR Kit说明书,将提取的RNA逆转录,将筛查出的差异miRNA进行Real-time PCR反应,由罗氏480Ⅱ荧光定量PCR仪完成。U6作为内参,每个样品设3个复孔。根据同一个样本的CT值(目标基因和内参基因)计算△CT值,miRNA表达相对量采用2-△△CT进行计算比较三组的差异表达miRNA及靶基因的表达情况,并比较A组中不同年龄(45岁及>45岁)、分期(Ⅰ~Ⅱ期及Ⅲ~Ⅳ期)、分化程度(高分化、中分化及低分化)及转移(是与否)情况者的上述差异表达miRNA及靶基因表达情况。
1.3 统计学方法 应用SPSS 16.0统计软件分析数据。计数资料比较采用χ2检验,计量资料比较采用t检验、单因素方差分析和SNK-q检验。P<0.05为差异有统计学意义。
2 结 果
2.1 三组的差异表达miRNA及靶基因的表达情况比较 A组与B组的差异表达miRNA为miR-34、miR-19,A组的miR-19及survivin表达显著高于B组,miR-34及PTEN表达显著低于B组,且A组与B组miR-19和survivin表达高于C组,miR-34和PTEN表达低于C组,三组之间的比较结果差异有统计学意义(P<0.001),见表1。
表1 三组的差异表达miRNA及靶基因的表达情况比较
Table 1 Comparison on the differentially expressed miRNA and target gene of three groups![]()

*P值<0.05与A组比较 #P值<0.05与B组比较(SNK-q检验)
组别例数miR-34miR-19survivinPTENA组300.33±0.05 3.35±0.31 3.56±0.29 0.29±0.05 B组300.72±0.10*1.60±0.23*1.52±0.20*0.60±0.11*C组151.00*#1.00*#1.00*#1.00*#F值495.459600.236909.110436.846P值<0.001<0.001<0.001<0.001
2.2 A组不同年龄者的差异表达miRNA及靶基因的表达情况比较 A组中不同年龄者的miR-34、miR-19、survivin及PTEN表达比较,差异无统计学意义(P>0.05),见表2。
2.3 A组不同分期者的差异表达miRNA及靶基因的表达情况比较 A组中分期较高者的miR-19及survivin表达显著高于分期较低者,miR-34及PTEN表达则显著低于分期较低者,差异有统计学意义(P<0.05),见表3。
2.4 A组中不同分化程度者的差异表达miRNA及靶基因的表达情况比较 A组中分化程度较低者的miR-19及survivin表达显著高于分化程度较高者,miR-34及PTEN表达则显著低于分化程度较高者,不同分化程度患者之间的比较结果差异有统计学意义(P<0.001),见表4。
2.5 A组中不同转移情况者的差异表达miRNA及靶基因的表达情况比较 A组中存在转移者的miR-19及survivin表达显著高于无转移者,miR-34及PTEN表达则显著低于无转移者,差异有统计学意义(P<0.05),见表5。
表2 A组中不同年龄者的差异表达miRNA及靶基因的表达情况比较
Table 2 Comparison on the differentially expressed miRNA and target gene of group A with different ages![]()
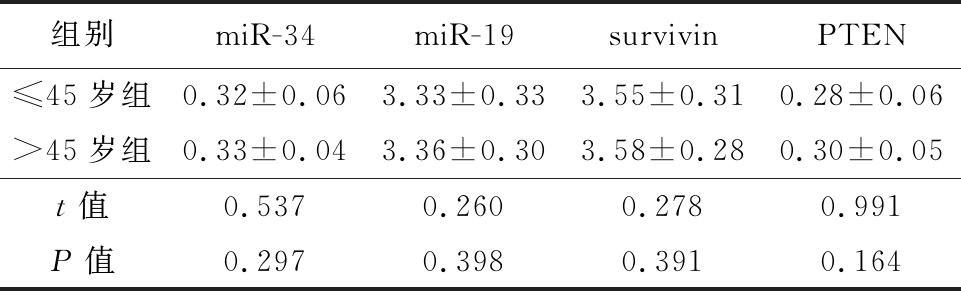
组别miR-34miR-19survivinPTEN≤45岁组0.32±0.063.33±0.333.55±0.310.28±0.06>45岁组0.33±0.043.36±0.303.58±0.280.30±0.05t值0.5370.2600.2780.991P值0.2970.3980.3910.164
表3 A组中不同分期者的差异表达miRNA及靶基因的表达情况比较
Table 3 Comparison on the differentially expressed miRNA and target gene of group A with different stages![]()
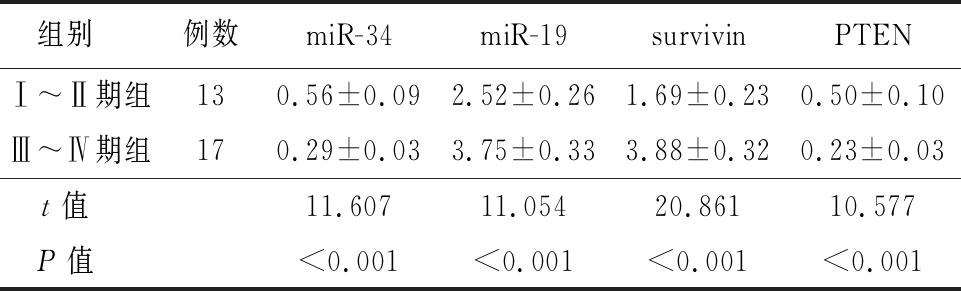
组别 例数miR-34miR-19survivinPTENⅠ~Ⅱ期组130.56±0.092.52±0.261.69±0.230.50±0.10Ⅲ~Ⅳ期组170.29±0.033.75±0.333.88±0.320.23±0.03t值 11.60711.05420.86110.577P值 <0.001<0.001<0.001<0.001
表4 A组中不同分化程度者的差异表达miRNA及靶基因的表达情况比较
Table 4 Comparison on the differentially expressed miRNA and target gene of group A with different differentiation degree![]()

*P值<0.05与低分化组比较 #P值<0.05与中分化组比较(SNK-q检验)
组别例数miR-34miR-19survivinPTEN低分化组90.20±0.033.89±0.363.91±0.310.19±0.03中分化组100.30±0.06*3.32±0.30*3.30±0.27*0.28±0.06*高分化组110.58±0.10*#1.79±0.25*#1.75±0.22*#0.53±0.09*#F值76.782131.685179.08071.076P值<0.001<0.001<0.001<0.001
表5 A组中不同转移情况者的差异表达miRNA及靶基因的表达情况比较
Table 5 Comparison on the differentially expressed miRNA and target gene of group A with different transfer situation![]()
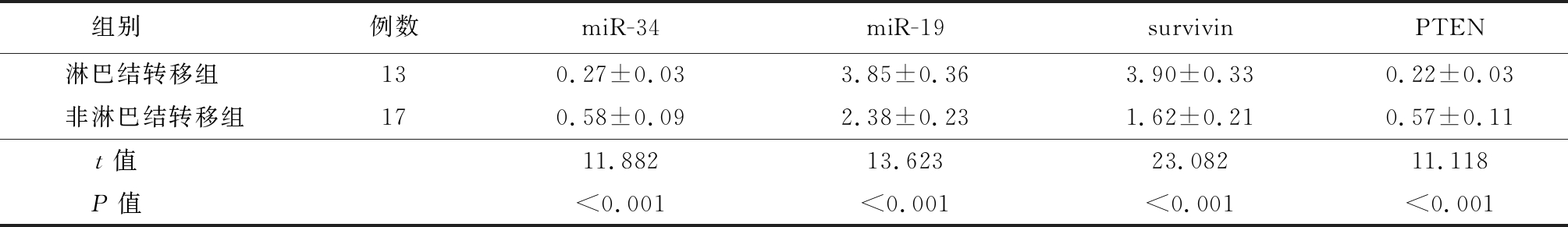
组别 例数miR-34miR-19survivinPTEN淋巴结转移组 130.27±0.033.85±0.363.90±0.330.22±0.03非淋巴结转移组170.58±0.092.38±0.231.62±0.210.57±0.11t值 11.88213.62323.08211.118P值 <0.001<0.001<0.001<0.001
3 讨 论
宫颈癌作为女性第二大恶性肿瘤,在我国具有较高的发病率,关于本病发生发展的研究众多。对于本病的研究显示,高危型HPV感染几乎是所有宫颈癌发生的必要条件,故高危型HPV感染一直是本病的研究重点[5-6]。研究显示,HPV16感染与宫颈鳞癌的发生密切相关,而HPV18感染倾向于宫颈腺癌的发生,而宫颈腺癌的淋巴和卵巢转移率均相对较高[7-8],且对放化疗的敏感性相对较低,因此预后较差,病死率也较高,因此对宫颈腺癌的临床发病机制等方面的研究意义更高[9-11]。临床中与宫颈癌相关的miRNA相关研究众多,且在宫颈癌患者中表达显著异常的miRNA指标多见,但是用于宫颈癌病理类型鉴别的miRNA指标研究相对不足,同时,HPV18感染对宫颈癌中miRNA表达差异研究,尤其是对不同病理类型宫颈癌的表达差异研究极为匮乏。对本方面的研究有助于了解HPV18感染病理分型及miRNA表达的检测意义[12-13],为疾病的诊治与防控提供参考依据。
本研究就HPV18在不同病理类型宫颈癌中miRNA表达差异进行探究,结果显示,HPV18阳性宫颈腺癌患者及HPV18阳性宫颈鳞癌患者的差异表达miRNA为miR-34、miR-19,对上述mRNA及其靶基因的进一步研究显示,HPV18阳性宫颈腺癌患者的miR-19及survivin显著高于HPV18阳性宫颈鳞癌患者,miR-34及PTEN显著低于HPV18阳性宫颈鳞癌患者,且HPV18阳性宫颈腺癌患者与HPV18阳性宫颈鳞癌患者的上述检测结果显著异于健康宫颈者,说明miR-19、miR-34、survivin及PTEN在HPV18阳性在不同病理类型宫颈癌中的表达差异显著,有助于鉴别HPV18阳性宫颈癌患者的病理分型,同时对于HPV18感染导致的miRNA异常表达有一定的反应价值,其通过影响miR-19及miR-34的表达来进一步影响相关靶基因survivin及PTEN等有关[14-16],survivin及PTEN 作为miR-19及miR-34的作用靶基因,其主要为导致靶基因survivin的过度表达及PTEN的下降缺失,而这可导致细胞周期的阻滞,细胞凋亡抑制情况突出,进而引起癌前病变向宫颈癌的进展,因此在宫颈腺癌的发生发展中起着较大的影响作用[17-19]。另外,对HPV18阳性宫颈腺癌中不同年龄者研究显示,上述指标表达差异并不显著,而不同分期、分化程度及转移情况者的表达差异较为显著,因此提示miR-19、miR-34、survivin及PTEN表达差异有助于HPV18阳性宫颈腺癌的分期、分化程度及转移情况鉴别,因此对于HPV18感染的宫颈癌患者应重视上述指标的检测,同时也为宫颈癌尤其腺癌的基因诊断、靶向药物治疗以及预后评估都提供一定参考价值[20-21]。
综上所述,miR-19、miR-34、survivin及PTEN在HPV18阳性在不同病理类型宫颈癌中的表达差异显著,且不同分期、分化程度及转移情况者的表达情况差异明显,故临床检测与研究意义较高。
[1] 王家建,董婕,邓再兴,等.HPV E6、E7 mRNA联合HPV 16型和HPV 18/45型分型检测作为子宫颈癌机会性筛查方法的探讨[J].中华妇产科杂志,2019,54(5):301-306.
[2] 贾帅,王晓晶,张欣荣,等.宫颈原位腺癌的临床病理分析[J].诊断病理学杂志,2019,26(2):125-127.
[3] 段律芳,杜辉,肖爱民,等.Cobas 4800 HPV检测的Ct值反映的型别特异性HR-HPV亚型病毒载量与子宫颈病变关系的研究[J].中华妇产科杂志,2019,54(7):458-463.
[4] 张磊,毕庆庆,陈文,等.宫颈上皮内瘤变和宫颈癌患者人乳头瘤病毒基因型流行率和归因分析[J].中国全科医学,2019,22(17):2042-2046.
[5] 周庆云,石清芳,赵洁,等.甘肃地区宫颈鳞癌和腺癌患者人乳头瘤病毒感染基因亚型分布研究[J].卫生职业教育,2019,37(1):142-144.
[6] 王文鹏,安菊生,姚洪文,等.高危型HPV亚型在不同病理类型子宫颈癌中的感染状况及归因分析[J].中华妇产科杂志,2019,54(5):293-300.
[7] 孙春意,翟淑娟,曹青萍,等.宫颈柱状上皮异位与宫颈癌及CIN的关系[J].昆明医科大学学报,2017,38(7):76-79.
[8] 张晓兴,陈瑛瑛,王家建,等.宫颈上皮内瘤变Ⅱ/Ⅲ级与宫颈癌患者HPV感染基因型的分布差异分析[J].中国现代医生,2018,56(14):61-64.
[9] Mu oz-Bello JO,Olmedo-Nieva L,Castro-Mu
oz-Bello JO,Olmedo-Nieva L,Castro-Mu oz LJ,et al. HPV-18 E6 oncoprotein and its spliced isoform E6*I regulate the wnt/β-Catenin cell signaling pathway through the TCF-4 transcriptional factor[J]. Int J Mol Sci,2018,19(10):3153.
oz LJ,et al. HPV-18 E6 oncoprotein and its spliced isoform E6*I regulate the wnt/β-Catenin cell signaling pathway through the TCF-4 transcriptional factor[J]. Int J Mol Sci,2018,19(10):3153.
[10] Córdova-Rivas S,Fraire-Soto I,Mercado-Casas Torres A,et al. 5p and 3p Strands of miR-34 family members have differential effects in cell proliferation,migration,and invasion in cervical cancer cells[J]. Int J Mol Sci,2019,20(3):545.
[11] 张健欣,郑婷萍,刘军,等.单纯HPV16/18阳性行阴道镜检查有可疑病变患者的子宫颈组织病理检查结果分析[J].中华妇产科杂志,2017,52(7):467-472.
[12] 殷啸俊,马小玲,刘琴.昆山市HPV分型与宫颈癌患者年龄、病理分期及分型的相关性研究[J].中国血液流变学杂志,2017,27(3):308-310.
[13] 曹宁宁,张保萍.高危型人乳头状瘤病毒(HR-HPV)病毒载量与宫颈癌临床病理因素的关系分析[J].临床研究,2019,27(4):17-18.
[14] 姚雪芹,叶世敏,何书昱,等.贵州省毕节地区高危型HPV感染妇女不同TCT结果的病理结局分析[J].贵州医药,2019,43(8):1333-1335.
[15] 王海玮,柴丽丽,杨国青,等.宫颈活组织病理检查及免疫组化P16蛋白检测在高危型人乳头瘤病毒阳性病人中的意义[J].安徽医药,2019,23(3):495-498.
[16] Long NP,Jung KH,Yoon SJ,et al. Systematic assessment of cervical cancer initiation and progression uncovers genetic panels for deep learning-based early diagnosis and proposes novel diagnostic and prognostic biomarkers[J]. Oncotarget,2017,8(65):109436-109456.
[17] Snoek BC,Verlaat W,Babion I,et al. Genome-wide microRNA analysis of HPV-positive self-samples yields novel triage markers for early detection of cervical cancer[J]. Int J Cancer,2019,144(2):372-379.
[18] 阮雅君,潘登,祝杭燕.宁波地区高危型HPV E6/E7mRNA阳性患者的临床病理特点分析[J].现代实用医学,2018,30(12):1648-1650.
[19] 杨光润,罗福申,宋雪,等.TP化疗联合三维适形放疗对宫颈癌患者血清PTEN水平、免疫功能及生存率的影响[J].实用癌症杂志,2019,34(7):1128-1131.
[20] 毛毅影,钟继生,梁罕超,等.人乳头瘤病毒分型检测与宫颈疫苗在宫颈癌防治中的应用[J].中国实用医刊,2019,46(7):71-73.
[21] 李松,刘君丽,余超,等.宫颈癌患者人乳头瘤病毒感染分布情况及多重感染与临床病理特征的关系[J].现代生物医学进展,2018,18(16):3062-3065,3045.