支气管肺发育不良(bronchopulmonary dysplasia,BPD)是引起持续性呼吸窘迫的慢性肺部疾病,也是极低出生体重儿和超低出生体重儿呼吸系统常见的并发症之一,近年来其发生率呈上升趋势[1]。BPD具有较高的致死率和致残率,严重影响患儿健康与生活质量[2]。目前BPD尚无安全有效的治疗方法,因此需要寻找预防与治疗BPD的新的突破点。BPD病因尚未完全明确,是多种因素共同参与的结果。凋亡及自噬是参与维持机体正常生理平衡的重要机制,有研究发现[3],自噬及凋亡与BPD发生、发展关系密切,肺泡Ⅱ型上皮细胞(type Ⅱ alveolar epithelial cells,ATⅡ)过度凋亡是BPD大鼠肺发育障碍的主要原因之一。但自噬体及凋亡小体对新生小鼠BPD调控作用尚不清楚。因此本研究就自噬体及凋亡小体对新生小鼠BPD调控作用进行了相关探讨,以期为临床治疗BPD提供新的方向,现报告如下。
1 材 料 与 方 法
1.1 实验动物 新生1日龄雌性SPF级Sprague Dawley小鼠36只,购于广州春盛生物研究院有限公司,许可证号SYXK(粤)2017-0176。
1.2 方法 将36只小鼠分为对照组、模型组、干预组,每组12只。BPD造模方法如下:将小鼠置于自制的密闭式饲养箱中,持续输入氧气(2 L/min),应用氧浓度监测仪(北京杰瑞恒达科技有限公司,型号:HD-828)对氧浓度进行持续监测,使氧浓度维持在60%,连续21 d,BPD模型制备成功标准参照文献[1]。对照组小鼠置于通气的鼠笼中。干预组小鼠从造模开始给予自噬抑制剂(氯喹,新乡市华幸生物科技有限公司)20 mg/kg腹腔注射,1次/d,连续21 d。新生鼠由母鼠喂养,每24 h交换模型组和对照组母鼠,以避免喂养能力差异。
1.3 观察指标
1.3.1 各组小鼠一般情况 22 d时观察并记录小鼠精神状态、毛发生长、饮食、呼吸、体重、死亡等情况。
1.3.2 采用HE染色观察各组小鼠肺组织病理变化 22 d时取各组小鼠肺组织,10%甲醛溶液(上海哈灵生物科技有限公司)固定,梯度酒精(北京智云达科技股份有限公司)脱水,二甲苯(上海安谱实验科技股份有限公司)透明,石蜡包埋成块,采用组织切片机(上海艾测电子科技有限公司,型号:KD3368AM)切成5 μm连续切片,脱蜡水化,采用HE染色试剂盒(海威奥生物科技有限公司)染色,冲洗,烘片,脱水,透明,中性树胶固封剂(北京中生瑞泰科技有限公司)封片,采用光学显微镜(上海富莱光学科技公司,型号:SOPTOPEX31)观察各组小鼠肺组织病理变化。
1.3.3 透射电镜下观察各组小鼠肺泡Ⅱ型上皮细胞超微结构 22 d时取各组小鼠肺组织,10%甲醛溶液固定,磷酸缓冲盐溶液(phosphate buffer saline,PBS)(上海研拓生物科技有限公司)漂洗,1%锇酸(上海雅吉生物科技有限公司)固定,梯度酒精脱水,丙酮包埋液(上海博通化学科技有限公司)包埋,使用组织切片机切片,3%醋酸铀-枸橼酸铅双染色,采用透射电镜(日本JEOL公司,型号:JEM-1200EX)观察各组小鼠肺泡Ⅱ型上皮细胞超微结构。
1.3.4 采用Western Blot检测肺组织中LC3B、P62、Bax、caspase-3蛋白表达水平 取各组小鼠肺组织,剪碎,加入RIPA组织裂解液(北京艾德莱生物科技有限公司)裂解,4 ℃条件下采用超速低温离心机(上海丰恒生物科技有限公司,型号:HERMLE-Z383K)以12 000 g离心15 min,取上清,使用BCA试剂盒(上海阳光生物科技有限公司)对蛋白定量,取总蛋白上样,电泳,切胶,转膜,封闭,加入1∶200稀释的兔抗人 LC3B单克隆抗体(美国abcam公司)、1∶200稀释的兔抗人P62单克隆抗体(上海麦仓生物科技有限公司)、1∶200稀释的兔抗人Bax单克隆抗体(武汉艾美捷科技有限公司)、1∶200稀释的兔抗人caspase-3单克隆抗体(武汉伊莱瑞特生物科技股份有限公司)、1∶500稀释的兔抗人β-actin单克隆抗体(青岛捷世康生物科技有限公司),4 ℃孵育过夜,PBST缓冲液(上海双螺旋生物科技有限公司)洗膜,加入1∶2 000稀释的HRP标记山羊抗兔IgG二抗(北京百奥莱博科技有限公司),4 ℃孵育过夜,PBST缓冲液洗膜,采用ECL发光试剂盒(上海通蔚生物科技有限公司)对PVDF膜进行曝光显影,应用Image-pro Plus软件检测各条带灰度值。
1.4 统计学方法 应用SPSS 22.0统计软件分析数据。计量资料比较采用单因素方差分析和SNK-q检验。P<0.05为差异有统计学意义。
2 结 果
2.1 各组小鼠一般生长情况 对照组小鼠生长情况正常,精神状态、毛发生长、饮食情况、呼吸情况、体重等均良好,未出现死亡小鼠;模型组呈现病态特征,精神状态、毛发生长、饮食情况、呼吸情况、体重等明显异常,出现1只死亡小鼠;干预组精神状态、毛发生长、饮食情况、呼吸情况、体重等明显好转,未出现死亡小鼠,见表1。
表1 各组小鼠一般生长情况
Table 1 General growth of mice in each group (n=12)

组别精神状态毛发饮食呼吸体重死亡(只数)对照组良好整齐有光泽 正常 正常未降低 0模型组萎靡粗糙、蓬乱、光泽差不思饮食急促明显降低1干预组好转光泽度改善 好转 好转降低较少0
2.2 各组小鼠肺组织HE染色结果 对照组小鼠肺泡结构规整,大小均一,分布均匀,间隔适中,无炎性水肿。模型组小鼠肺泡嵴样结构减少,肺泡数量减少,肺泡间隔增厚,可见肺大疱、炎性不张及明显间质水肿。干预组病理改变较模型组明显减轻,肺泡嵴样结构逐渐增多,肺泡数量逐渐增多,肺泡间隔逐渐变薄,炎性水肿明显改善,见图1。
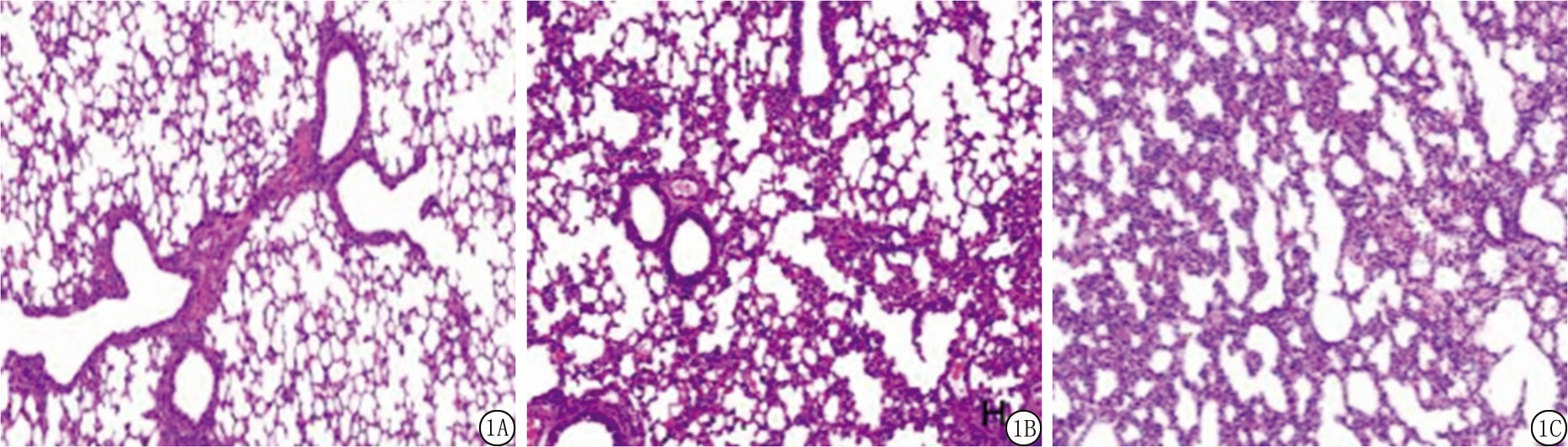
图1 各组小鼠肺组织HE染色结果(×100)
A.对照组;B.模型组;C.干预组
Figure 1 HE staining results of lung tissues of mice in each group (×100)
2.3 各组小鼠肺组织透射电镜观察结果 对照组小鼠ATⅡ细胞呈立方形,体积较小,细胞核大而圆,细胞质染色较浅淡,胞质中可见线粒体,胞浆中可见自噬体及凋亡小体,胞浆内可见清晰的板层小体结构。模型组小鼠ATⅡ细胞形态欠规整,细胞器模模糊不清,细胞核固缩且染色质凝集,凋亡细胞增多,胞浆中存在大量自噬体及凋亡小体,自噬体及凋亡小体数量较对照组明显增多。干预组小鼠ATⅡ细胞形态逐渐恢复正常,可见双层膜结构以及包裹的细胞器,自噬体及凋亡小体数量较模型组明显减少,见图2。
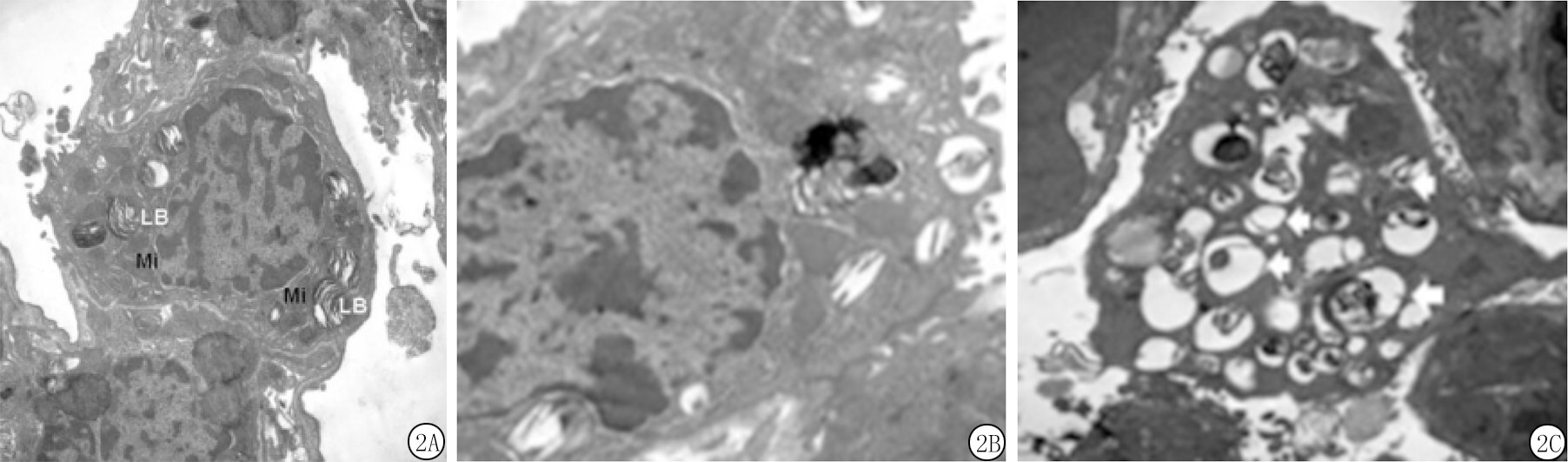
图2 各组小鼠肺组织透射电镜观察结果(×1 000)
A.对照组;B.模型组;C.干预组
Figure 2 The results of transmission electron microscopy in lung tissue of mice in each group (×1 000)
2.4 各组小鼠肺组织中自噬相关蛋白 LC3B、P62表达水平 模型组小鼠肺组织中LC3B、P62水平显著高于对照组(P<0.05),干预组小鼠肺组织中LC3B、P62水平显著低于模型组(P<0.05),干预组小鼠肺组织中LC3B、P62水平显著高于对照组(P<0.05),见表2、图3。
表2 各组小鼠肺组织中自噬相关蛋白 LC3B、P62表达水平
Table 2 Expressions of autophagy-related proteins LC3B and P62 in lung tissues of mice in each group![]()

*P值<0.05 与对照组比较 #P值<0.05与模型组比较(SNK-q检验)
组别 LC3BP62对照组1.34±0.521.48±0.49模型组2.78±1.33*3.56±1.71*干预组2.03±0.98*#2.60±1.02*#F值6.10020.870P值0.006<0.001

图3 各组小鼠肺组织中 LC3B、P62水平
Figure 3 The levels of LC3B and P62 in lung tissues of mice in each group
2.5 各组小鼠肺组织中凋亡相关蛋白Bax、caspase-3表达水平 模型组小鼠肺组织中Bax、caspase-3水平显著高于对照组(P<0.05),干预组小鼠肺组织中Bax、caspase-3水平显著低于模型组(P<0.05),干预组小鼠肺组织中Bax、caspase-3水平显著高于对照组(P<0.05),见表3,图4。
表3 各组小鼠肺组织中凋亡相关蛋白Bax、caspase-3表达水平
Table 3 Expression levels of apoptosis-related proteins Bax and caspase-3 in lung tissues of mice in each group![]()

*P值<0.05 与对照组比较 #P值<0.05与模型组比较(SNK-q检验)
组别Baxcaspase-3对照组0.87±0.190.99±0.21模型组2.25±1.73*2.31±1.66*干预组1.60±0.83*#1.65±0.92*#F值4.6304.290P值0.0170.022

图4 各组小鼠肺组织中Bax、caspase-3水平
Figure 4 Bax and caspase-3 levels in lung tissues of mice in each group
3 讨 论
BPD患儿肺部发育障碍,常伴一系列呼吸系统、心血管系统及神经系统并发症,导致认知障碍、行为学习障碍等,影响患儿生命健康与生活水平[4]。目前BPD治疗以药物为主,而药物治疗以减轻症状为主且仅限于适度活性物质[5]。因此从发病机制角度探寻新治疗方案对提升患儿预后有重要意义。
BPD病因尚不完全明确,有研究报道,出生体重<1 500 g的早产儿BPD发病率达40%[6]。此外高浓度氧、输液量过多、机械正压通气损伤等均可引发BPD[7]。此外有研究发现,自噬及凋亡在BPD发生、发展过程中扮演重要角色[8]。自噬是一种适应性的细胞反应,广泛存在于哺乳动物呼吸、神经、心血管等系统中,能够清除老化细胞器,更新细胞器,降解长周期蛋白和异常积聚蛋白,维持细胞内环境稳定,并在组织增殖分化、蛋白质代谢等生理过程中发挥重要作用[9-10]。自噬过度活化会对细胞产生损害,导致细胞凋亡[11]。有研究显示,自噬相关凋亡水平异常与脊髓损伤、血液系统恶性肿瘤、颅内出血等疾病有关[12]。AT-Ⅱ细胞是BPD肺上皮损伤的关键靶细胞,AT-Ⅱ细胞凋亡被认为是BPD肺泡发育不良的关键环节[13]。因此维持自噬及凋亡在一定生理范围内对于保障机体健康尤为重要。本研究结果显示,干预组小鼠肺组织病理改变较模型组明显改善,ATⅡ细胞胞浆中自噬体及凋亡小体数量较模型组明显减少,提示自噬可能参与了BPD发生发展过程。其因可能是自噬过度活化引起毒性异常蛋白聚集,诱发炎症反应,损伤线粒体,从而导致细胞大量凋亡,引发BPD。LC3B、P62为自噬相关蛋白[14],LC3B是自噬体膜上的标志蛋白,被广泛应用于检测哺乳动物中自噬活性和自噬体形成。P62是自噬降解的底物,也是连接LC3B与待降解泛素化底物的桥梁,p62表达增加往往提示自噬体与溶酶体结合或被溶酶体降解存在障碍。Bax、caspase-3为凋亡相关蛋白[15],Bax是极重要的促细胞凋亡基因之一,其编码产物可与凋亡抑制基因B淋巴细胞瘤2(B lymphocytoma-2,Bcl-2)表达产物结合而替换Bcl-2/Bax二聚体中的Bax,而达到促进细胞凋亡的目的。Caspase-3是细胞凋亡过程中的关键执行子,在细胞裂解及凋亡小体形成过程中发挥重要作用。本研究通过Western Blot分析发现,模型组小鼠肺组织中LC3B、P62、Bax、caspase-3水平显著低于对照组,干预组小鼠肺组织中LC3B、P62、Bax、caspase-3水平显著高于模型组,提示自噬体及凋亡小体增多可导致新生小鼠BPD,自噬抑制可减少ATⅡ细胞凋亡,这可为BPD新治疗手段奠定实验基础。
综上所述,新生小鼠ATⅡ细胞自噬过度活化后自噬体增多,促进ATⅡ细胞大量凋亡,凋亡小体增加,从而导致BPD不良发生,这可为BPD预防和治疗提供理论支持。但仍需大样本体内体外实验进一步证实。
[1] 岳冬梅,佟雅洁,薛辛东.高氧对支气管肺发育不良新生鼠肺泡上皮细胞的影响[J].国际儿科学杂志,2017,44(12):891-897.
[2] Isaacs D. Corticosteroids in bronchopulmonary dysplasia[J]. J Paediatrics Child Health,2019,55(5):607-608.
[3] 彭文宏,王冰.自噬在肺部疾病中的研究进展[J].国际呼吸杂志,2016,5(6):178-182.
[4] 张亚芥,潘家华.支气管肺发育不良的临床观察及肺功能随访[J].临床肺科杂志,2017,11(9):569-571.
[5] 姚丽平,韦秋芬,李燕,等.极/超低出生体重早产儿支气管肺发育不良临床随访[J].中华新生儿科杂志,2017,32(4):255-258.
[6] Ostori R,Goudarzi A,Oskoi B. GPR random noise reduction using BPD and EMD[J]. J Geophys Eng,2017,10(9):458-460.
[7] Williams E,Greenough A. Advances in treating bronchopulmonary dysplasia[J]. Expert Rev Respir Med,2019,13(8):123-125.
[8] 宋文沁,黄亚医,夏中元.线粒体自噬及其在肺脏疾病中的作用研究进展[J]. 陕西医学杂志,2018,47(10):145-147.
[9] Hurley JH,Young LN. Mechanisms of autophagy initiation[J]. Ann Rev Biophys,2017,86(1):225-228.
[10] Yin Z,Pascual C,Klionsky DJ. Autophagy: machinery and regulation[J]. Microbial Cell,2016,3(12):588-596.
[11] 谢利霞,赵飞宇,王冕,等.黄芩素通过抑制mTOR通路激活自噬促进神经细胞过量表达的alpha-突触核蛋白清除[J].河北医科大学学报,2017,38(5):585-589.
[12] 王培,付宇.线粒体自噬与疾病[J].河北医科大学学报,2018,39(7):853-857.
[13] 贺娟,陶莉,吕回,等.早产儿血清中性粒细胞明胶酶相关脂质运载蛋白和Ⅱ型肺泡细胞表面抗原水平与支气管肺发育不良的关系[J].中国新生儿科杂志,2018,33(2):104-108.
[14] Hambright HG,Kumar AP,Ghosh R. Abstract 3534: Inhibition of melanoma cell survival through p62/LC3B autophagic signaling[J]. Cancer Res,2016,76(14):3534-3534.
[15] Haddadi R,Nayebi AM,Eyvari SB. Silymarin prevents apoptosis through inhibiting the Bax/caspase-3 expression and suppresses toll like receptor-4 pathway in the SNc of 6-OHDA intoxicated rats[J]. Biomed Pharmacother,2018,104(19):127-136.