脓毒症为临床常见危重症,主要由感染引起,主要临床症状为发热、心跳过速、呼吸急促和外周血白细胞增加[1]。研究表明,脓毒症病死率较高,可达18%~25%,常可累及肾脏,引起肾功能障碍,影响预后[2]。故探究相关预测因子,提高脓毒症的预后尤为迫切。血清降钙素原(procalcitonin,PCT)可有效反映全身炎症程度,浓度升高对脓毒症患者的预后具有重要指示作用;白蛋白(albumin,ALB)主要存在于人体血浆中,其水平降低提示抗免疫能力差;另胰石蛋白(pancreatic stone protein,PSP)主要由胰腺细胞分泌而成,其在脓毒症中应用广泛[3-4]。PCT、ALB、PSP对成人脓毒症的预测价值已得到证实,是否对脓毒症患儿预后具有较高的评估价值需要进一步的研究。本研究探讨PCT、ALB、PSP对脓毒症患儿临床病理之间的关系,并分析其临床预测价值,以期为临床防治提供参考。现将结果报告如下。
1 资 料 与 方 法
1.1 一般资料 选择2016年8月—2019年8月我院ICU病房收治的脓毒症患儿322例为研究对象,根据患儿病情严重程度分为脓毒症组126例、严重脓毒症组105例、脓毒性休克组91例,另选取同期体检健康儿童80例为对照组。病例纳入标准:①符合《中国脓毒症/脓毒症休克急诊治疗指南(2016)》[5]诊断标准;②年龄1~14岁;③小儿危重病例评分(pediatric critical illness score,PCIS)<80分;④临床资料完整,能够配合完成研究者。排除标准:①严重心、肝、肾等功能障碍;②合并其他恶性肿瘤疾病患者;③严重营养不良者;④先天性心脏病者;⑤智力或精神障碍不能配合研究者。脓毒症组男性68例,女性58例;年龄1~12岁,平均(7.42±2.21)岁;体重指数(body mass index,BMI)15~24,平均19.43±3.19。严重脓毒症组男性61例,女性44例,年龄1~11岁,平均(7.26±2.12)岁;BMI 16~25,平均19.16±3.20。脓毒症休克组男性52例,女性39例;年龄1~12岁,平均(7.25±2.60)岁;BMI 15~24,平均19.36±3.18。对照组男性43例,女性37例,年龄2~14岁,平均(7.67±2.36)岁;BMI 16~25,平均19.84±3.39。4组性别、年龄、BMI差异无统计学意义(P>0.05),具有可比性。
本研究经医院医学伦理委员会批准通过,受试者患儿及家属均知情同意并签署知情同意书。
1.2 方法 所有受试者抽取空腹12 h以上的肘静脉血3 mL,3 000 r/min,离心10 min,分离血清,-80 ℃保存备测。酶联免疫吸附测定分析法测定血清PCT水平;使用BECK Man LX20 全自动生化分析仪,免疫比浊法测定(试剂供自上海恒远生物技术发展有限公司)PSP、ALB水平。所有操作均遵循试剂说明书严格执行。
1.3 随访及评判标准 所有患儿随访28 d观察预后,统计患儿病死率。主要终点事件定义为任何原因引起的死亡。PCIS评分共包含10项,总分100分,得分>80分为非危重;71~80分为危重;<70分为极危重。
1.4 统计学方法 应用SPSS 22.0统计软件处理数据。计数资料比较采用χ2检验;计量资料比较采用t检验、单因素方差分析和SNK-q检验;影响因素分析采用多因素二元Logistic回归分析;预测价值评估采用ROC曲线分析,曲线下面积(area under curve,AUC)0.7~0.9时预测准确性较好,>0.9时预测准确性高。P<0.05为差异有统计学意义。
2 结 果
2.1 4组血清PCT、ALB及PSP水平比较 4组血清PCT、ALB及PSP水平比较差异有统计学意义(P<0.05);脓毒症组PCT、PSP水平高于对照组,ALB水平低于对照组,严重脓毒症组PCT、PSP水平高于脓毒症组和对照组,ALB水平低于脓毒症组和对照组,脓毒性休克组PCT、PSP水平高于严重脓毒症组、脓毒症组和对照组,ALB水平低于严重脓毒症组、脓毒症组和对照组,差异有统计学意义(P<0.05)。见表1。
表1 4组血清PCT、ALB及PSP水平比较
Table 1 Comparison of serum PCT,ALB and PSP levels in four groups![]()

*P值<0.05与对照组比较 #P值<0.05与脓毒症组比较 △P值<0.05与严重脓毒症组比较(SNK-q检验)
组别 例数PCT(μg/L)ALB(g/L)PSP(μg/L)对照组 800.42±0.1148.35±6.27158.62±18.93脓毒症组 12650.41±11.20*37.12±6.37*269.34±16.45*严重脓毒症组10560.43±10.64*#28.23±5.14*#285.36±21.84*#脓毒性休克组9168.85±11.51*#△21.65±4.53*#△320.15±21.27*#△F值 799.811363.4121 067.188P值 <0.001<0.001<0.001
2.2 脓毒症患儿的预后情况 随访28 d,322例患儿中死亡48例(14.91%),存活274例(85.09%)。死亡患儿,脓毒症组2例(1.59%)、严重脓毒症组18例(17.14%)、脓毒性休克组28例(30.77%)。严重脓毒症组病死率高于脓毒症组,脓毒性休克组病死率高于脓毒症组和严重脓毒症组,差异有统计学意义(χ2=36.087,P<0.01)。
2.3 存活组、死亡组临床指标比较 死亡组PCT和PSP水平高于存活组,ALB水平和PCIS评分低于存活组,差异有统计学意义(P<0.05)。2组性别、年龄及BMI差异无统计学意义(P>0.05)。见表2。
表2 生存组和死亡组临床指标比较
Table 2 Comparison of clinical indexes between survival group and death group![]()
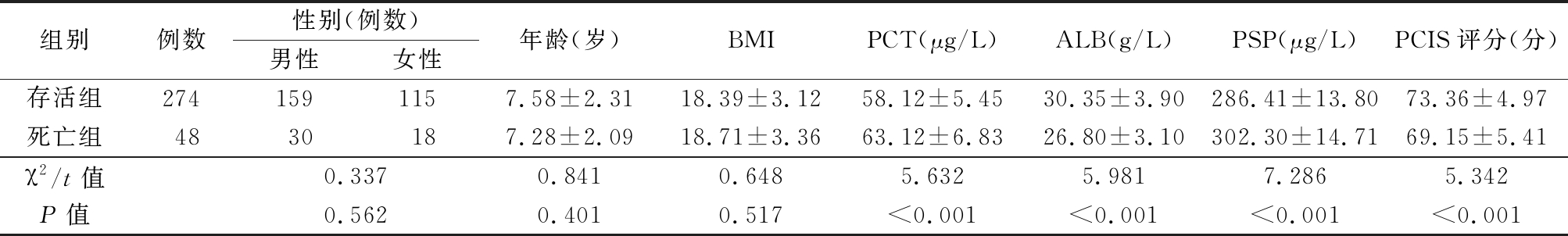
组别例数性别(例数)男性女性年龄(岁)BMIPCT(μg/L)ALB(g/L)PSP(μg/L)PCIS评分(分)存活组2741591157.58±2.3118.39±3.1258.12±5.4530.35±3.90286.41±13.8073.36±4.97死亡组4830187.28±2.0918.71±3.3663.12±6.8326.80±3.10302.30±14.7169.15±5.41χ2/t值0.3370.8410.6485.6325.9817.2865.342P值0.5620.4010.517<0.001<0.001<0.001<0.001
2.4 脓毒症患儿预后Logistic回归分析 以患儿是否死亡(否=0,是=1)为因变量,以血清PCT(连续变量)、ALB(连续变量)、PSP水平(连续变量)及PCIS评分(连续变量)为自变量,纳入多因素Logistic回归分析。结果显示,血清PCT、ALB、PSP及PCIS评分是脓毒症患儿死亡的危险因素(P<0.05)。见表3。
表3 脓毒症患儿预后Logistic回归分析
Table 3 Evaluation of prognostic factors of children with sepsis by multivariate Logistic regression analysis
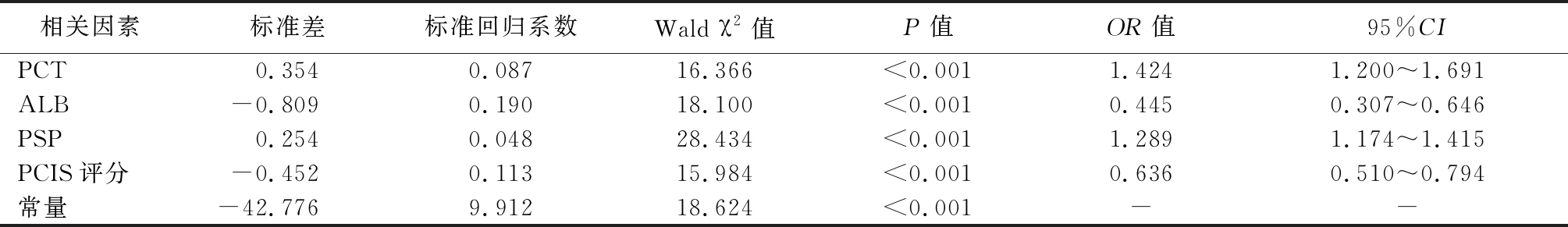
相关因素标准差标准回归系数Wald χ2值P值OR值95%CIPCT0.3540.08716.366<0.0011.4241.200~1.691ALB-0.8090.19018.100<0.0010.4450.307~0.646PSP0.2540.04828.434<0.0011.2891.174~1.415PCIS评分-0.4520.11315.984<0.0010.6360.510~0.794常量-42.7769.91218.624<0.001--
2.5 血清PCT、ALB及PSP水平对脓毒症患儿死亡终点的预测 绘制ROC曲线,结果显示,血清PCT、ALB、PSP预测脓毒症患儿死亡的AUC分别为0.741、0.783、0.784,均具有一定准确性;以ROC曲线靠左上方约登指数的最大切点作为最佳临界值(PCT为59.95 μg/L,ALB为30.05 g/L、PSP为287.55 μg/L),预测敏感度、特异度:PCT为77.1%、63.1%,ALB为95.8%、52.6%,PSP为93.8%、53.6%,预测价值较好。
将血清PCT、ALB、PSP纳入Logistic回归模型,通过回归系数得出三项联合的数值计算公式为:三项联合=PCT+(-0.809)/(0.354)×ALB+(0.254)/(0.354)×PSP,统计分析得出联合数据。进一步ROC曲线显示,三项联合预测AUC为0.953,敏感度、特异度为87.5%、91.6%,提示联合预测价值较高。见表4,图1。
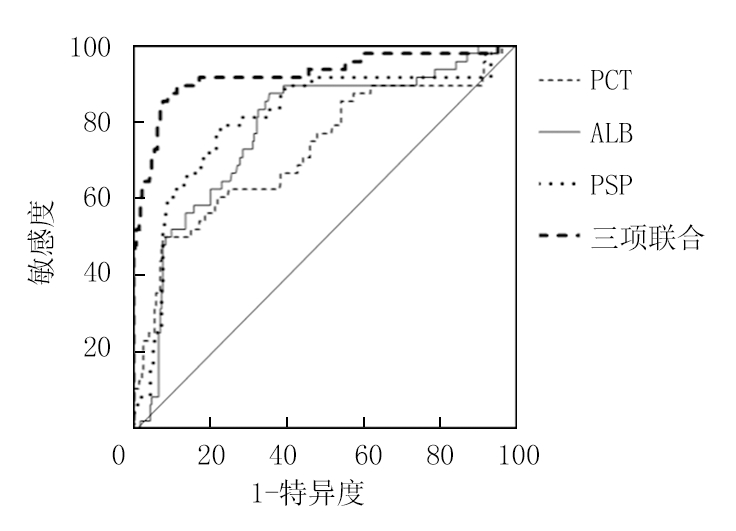
图1 血清PCT、ALB、PSP及三联联合预测脓毒症患儿死亡终点的ROC曲线
Figure 1 ROC curve of serum ALB,PCT,PSP and triple combination for predicting the end point of death in sepsis children
表4 血清PCT、ALB及PSP水平对脓毒症患儿死亡终点的预测价值
Table 4 Predictive value of serum PCT,ALB and PSP levels to the end point of death in sepsis children
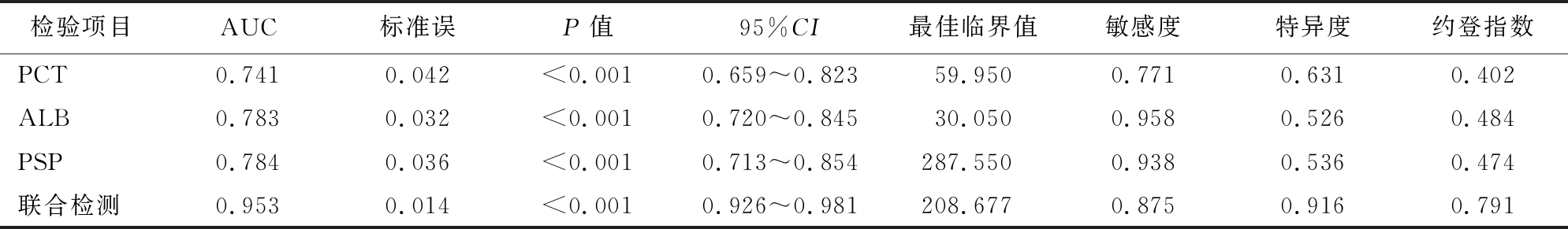
检验项目AUC标准误P值95%CI最佳临界值敏感度特异度约登指数PCT0.7410.042<0.0010.659~0.82359.9500.7710.6310.402ALB0.7830.032<0.0010.720~0.84530.0500.9580.5260.484PSP0.7840.036<0.0010.713~0.854287.5500.9380.5360.474联合检测0.9530.014<0.0010.926~0.981208.6770.8750.9160.791
3 讨 论
脓毒症在临床常属于危重症,具有起病急、系统性炎症反应重等特点[6]。资料显示,小儿脓毒症常伴有发热、心跳快速及代谢异常等症状,且其致病原因较为复杂,预后性较差,临床上诊断和治疗都较为困难,因此探究相关因子与脓毒症的关系,提高脓毒症患儿的预后尤为迫切[7]。近年来,临床上关于脓毒症的研究已经日渐进步,但脓毒症在发展过程中受细菌内毒素、炎症介质、免疫及凝血功能等多种因素影响,其是否对脓毒症患儿的预后具有诊断价值目前仍不清楚。因此,继续探究脓毒症相关因子与脓毒症之间的关系,为临床脓毒症患儿的防治提供参考仍是目前需要解决的问题。
现国内外较多文献表明,PCT、ABL、PSP对成人脓毒症的预测价值已得到证实,是否对脓毒症患儿预后具有较高的预测价值需要进一步研究。PCT是细胞分泌的一种糖蛋白,正常机体中含量极低,感染状态下,毒素、肿瘤坏死因子α及白细胞介素会诱导PCT发生,PCT水平明显升高[8-9]。同时资料显示,患儿机体PCT水平与细菌种类、炎症因子及免疫功能密切相关[10]。目前,PCT对脓毒症患儿预后的预测价值已得到有效证实,且霍俊明等[1] 分析106例脓毒症患儿的PCT水平,结果发现,PCT水平随脓毒症感染程度的加剧而升高,且PCT水平越高者预后越差,提示PCT可能是反映脓毒症患儿预后的较好指标。ALB主要为肝实质细胞合成,脓毒症患儿的代谢率可因机体发热、炎症及应激等原因增加,从而促使ALB分解代谢加快,血清ALB含量降低[11-12]。患儿受毒性感染后,全身毛血管通透性迅速提高,使得存在于血管内的ALB减少,造成低ALB血症。而张静等[13]研究显示,脓毒症休克组患儿ALB水平明显低于严重脓毒症组,病死率高于严重脓毒症组,提示ALB水平与疾病严重程度具有一定关系。PSP为基因编码序列,主要由胰腺腺泡分泌而成[14]。PSP在脓毒症与健康者之间差异有统计学意义,并与PCT呈显著正相关。提示,PSP水平升高可作为脓毒症患儿的诊断指标。彭红艳等[15]研究显示,脓毒症患儿的PSP水平随感染程度的加剧而升高,差异有统计学意义。说明PSP不仅可作为脓毒症患儿的诊断指标,而且对脓毒症患儿的病情及预后具有重要的作用。本研究结果显示,脓毒症患儿的PCT、PSP均随脓毒症患儿病情严重程度加剧而升高,ALB水平随病情严重程度加剧而降低,提示三者在脓毒症患儿评估中特异性显著。死亡组PCT和PSP高于存活组,死亡组ALB和PCIS评分低于存活组,差异有统计学意义(P<0.05)。Logistic回归分析结果显示,PCT、ABL、PSP主要终点事件的危险因素。
《脓毒症患者围术期管理的专家共识》[16]指出,治疗脓毒症最有效的方法是在了解其发病机制的基础上进行治疗,但目前临床上关于脓毒症的发病机制尚不明确,因此在治疗过程中,应尽量从脓毒症患儿的病因、病情严重程度、累及器官着手,以《脓毒症诊疗指南》[17]为指导,个体化治疗及综合治疗并行。脓毒症可造成多器官损伤,因此在治疗时需进行多种药物共同治疗,以提高疗效,且应尽早预防诊断,以改善预后,降低病死率。本研究结果显示,PCT、ABL、PSP对脓毒症患儿的预后评估具有一定的价值,预测价值更高。提示临床可将三者作为脓毒症患儿不良预后的辅助预测因子。而对于如何通过调节个体化PCT、ABL及PSP水平提高防治效果,还有待进一步研究证明。
综上所述,血清PCT、ABL、PSP水平对脓毒症患儿的预后均有一定的预测价值,且三者联合预测的特异度、敏感度较高,对预后的预测更加准确,临床可加强监测。
[1] Huo JM,Huo R,Hu L,et al. Value of procalcitonin,high sensitivity C-reactive protein and pancreatic stone protein in predicting prognosis of children with sepsis[J]. Sichuan Da Xue Xue Bao. Yi Xue Ban,2017,48(3):422-426.
[2] Reinhart K,Daniels R,Kissoon N,et al.Recognizing sepsis as a global health priority-a WHO resolution[J]. N Engl J Med,2017,377(5):414-417.
[3] 范晓娟,杨文莉,薛小卫.降钙素原与小儿危重病例评分对脓毒症患儿预后的影响[J].贵州医药,2019,43(7):1092-1093.
[4] 张启龙,高隆,杨俊.血清胰石蛋白水平对于呼吸机相关肺炎患者临床预后的预测研究[J].华南国防医学杂志,2017,31(2):20-24.
[5] 王来,杨秀芬,张书利,等.血清CRISPLD2水平对脓毒症患者的诊断及预后评估价值[J].中华危重病急救医学,2017,29(8):694-699.
[6] 吴朝,董晓琴,赵鸿,等.脓毒症及脓毒性休克诊断与治疗研究进展[J].中华实用诊断与治疗杂志,2018,32(11):1126-1128.
[7] Wu Q,Nie J,Wu FX,et al. Prognostic value of high-sensitivity C-reactive protein,procalcitonin and pancreatic stone protein in pediatric sepsis[J]. Med Sci Monit,2017,23:1533-1539.
[8] 贾建超,张文平,杨金坡,等.肺炎继发脓毒症患者血清降钙素原和C反应蛋白变化及预后因素分析[J].中华实用诊断与治疗杂志,2018,32(2):144-147.
[9] 尹良琼,余艾霞.降钙素原、胱抑素C联合检测对脓毒症患儿28天死亡率的预测价值研究[J].现代检验医学杂志,2017,32(2):153-156,159.
[10] 顾春生,金颖.血清PCT、hs-CRP、IL-6水平联合检测在烧伤早期伴发脓毒症患者病情评估中的应用价值[J].中国实验诊断学,2018,22(8):132-133.
[11] 吕志良.血清白蛋白、前白蛋白水平联合PCIS评分变化对脓毒症患儿预后评估的指导价值[J].泰山医学院学报,2017,38(2):163-164.
[12] 赵天平,陈华刚.中性粒细胞和白蛋白的比值对小儿严重脓毒症预后的预测价值[J].浙江医学,2019,41(13):1387-1390.
[13] 张静,杨湘峰,孟宪梅,等.血清降钙素原、白蛋白、可溶性髓样细胞触发受体-1对脓毒症患儿的临床诊断价值[J].中国医药导报,2018,15(24):107-110.
[14] 任志红.脓毒症患儿血清胰石蛋白、胆碱酯酶含量的变化及其与全身炎症反应、靶器官损伤的相关性[J].海南医学院学报,2017,23(20):2811-2814.
[15] 彭红艳,祝益民,张新萍,等.脓毒症胰腺损伤患儿胰石蛋白变化的意义[J].中华实用儿科临床杂志,2016,31(6):413-416.
[16] 中国医师协会麻醉学医师分会.脓毒症患者围术期管理的专家共识[J].中华麻醉学杂志,2015,35(10):1165-1177.
[17] 唐轶珣,祝益民.脓毒症/脓毒性休克的循环管理《拯救脓毒症运动:脓毒症与脓毒性休克治疗国际指南(2016版)》解读[J].实用休克杂志,2017,1(2):120-122.