侵袭性骨母细胞瘤(aggressive osteoblastoma,AO)是一种罕见的侵袭性骨肿瘤,国内外文献报道较少[1-7],且国外多以个案报道[2,8-16],故临床上对其影像学特点认识不足而易误诊[6-8]。AO的生物学行为具有很强的侵袭性,术后易复发,且具有恶性病变的倾向[1-2,7],可导致患者不可预料的死亡。因此术前明确诊断对于本病的治疗方式的选择尤为重要。笔者回顾性分析7例经病理确诊的AO的影像学表现,旨在探讨AO的影像学表现及其鉴别诊断要点。
1 资 料 与 方 法
1.1 临床资料 回顾性分析2007年1月—2018年12月河北医科大学第三医院经手术病理证实的AO 7例,男性4例,女性3例;年龄13~56岁,中位年龄32岁;主要临床症状以局部疼痛和/或肿块为症状,发生于脊柱的可伴有肢体麻木、无力或不全瘫痪等神经受损症状;病情发展快慢不一,本组病例病程为1个月~10年。
1.2 影像检查方法 所有患者均行X线平片、CT及MR扫描。
1.2.1 X线平片 采用800 mA Siemens AXIOM Aristos FX DR摄片。
1.2.2 CT检查 采用Siemens sensation64层及16层螺旋CT机骨窗扫描,管电压120 kV,管电流163~300 mA,层厚及层距5 mm,并对原始扫描数据进行层厚1 mm、间距0.7 mm行矢状面及冠状面重组。增强扫描采用高压注射器经肘前静脉以流率3.0 mL/s注入碘海醇80~100 mL,分别延迟22~24 s和40~50 s行动脉期及静脉期扫描。
1.2.3 MR检查 采用Siemens Avanto 1.5T MR扫描仪及及专用线圈,行冠状面、矢状面、轴面扫描,层厚5 mm。扫描序列采用快速自旋回波SE-T1WI(TR:412~715 ms,TE:10~16 ms),FOV:180×180 mm;TSE-T2WI序列(TR:3 000~4 200 ms,TE:84~102 ms),FOV:180×180 mm;MEDIC序列(TR:470 ms,TE:17 ms),FOV:180×180 mm;短时反转恢复(STIR)序列(TR:3 500 ms,TE:50 ms),FOV:180×180 mm。层厚、间距为5 mm。MR增强扫描:采用经肘正中静脉推入Gd-DTPA 15~20 mL,注射流率1.0 mL/s,即刻采用T1WI脂肪抑制序列(TR:600~700 ms,TE:9~10 ms)增强扫描。
1.3 图像分析 由两名放射科副主任医师以上级别的影像学诊断医师同时对7例AO的所有影像学图像进行分析,协商并确定影像学征象,并与手术病理进行对照分析。影像学检查方法包括:X线平片、CT、MRI;影像征象包括:发病部位、骨质破坏情况、病变内的骨质密度、病变区的MR信号特点及周围侵袭范围等。
1.4 病理检查方法 7例AO患者术后标本送病理,肿瘤标本制备病理切片(HE染色),部分行免疫组织化学染色。
2 结 果
2.1 临床资料 7例AO中男性4例,女性3例;发病年龄为13~56岁,中位年龄为32岁;发病部位椎体及附件5例,肩胛骨1例,肱骨1例,其中颈椎1例及胸椎2例侵及相邻上下椎体。本病发展快慢不一,本组病例病程为1个月~10年。临床症状:主要以局部疼痛和/或肿块为症状,3例呈持续性疼痛,2例为间歇性疼痛,发生于脊柱的3例有局部疼痛伴双下肢行走困难、肢体麻木、无力或不全瘫痪等神经受损症状。实验室检查:7例AO中2例碱性磷酸酶升高。7例患者均行手术及术后回访,见表1。
2.2 X线及CT表现 发生于椎体及附件的5例,表现为不规则骨质破坏,病灶范围4~9 cm,破坏区内密度不均匀,可见菜花状、云絮状的高密度影,边界模糊,皮质断裂,周围可见软组织肿块及肿块明显强化,病变侵及邻近椎体的3例;发生于肩胛骨的病变表现为膨胀性的骨质破坏(范围约4 cm×5 cm×8 cm),边界清晰,皮质破坏,其内可见不同程度的骨质硬化及团絮状高密度影;发生于肱骨上段的病变表现为膨胀性溶骨性骨质破坏(范围约3 cm×4 cm),其内密度不均匀,可见斑点状高密度影,边界较清,可见骨膜反应及硬化(图1A~B)。
2.3 MR表现 病变区T1WI呈不均匀的等或低信号,T2WI为不均匀低、等或高信号;病变区的钙化或骨化在T2WI上呈低信号区,低信号区与CT上的钙化或骨化相对应;病变周围的硬化边在T1WI及T2WI上均呈低信号环;本组7例AO中2例合并动脉瘤样骨囊肿(病变区可见多发液-液平面),MR更明确显示病变侵袭的范围及周围水肿带(图1C~F)。
2.4 肿瘤与周围结构的关系 7例AO均骨皮质不完整,5例突破皮质形成厚薄不均匀的肿块影,3例病变累及相邻椎骨,2例具有较少软组织水肿。
表1 7例侵袭性骨母细胞瘤患者病例资料
Table 1 Clinical characteristics of a series of 7 patients of aggressive osteoblastoma

病例性别年龄(岁)发病部位临床症状治疗方式随访1女56颈7椎体及附件侵及颈6椎体双上肢麻木、双下肢无力2年,加重半月颈椎行前后路联合颈椎肿瘤切除+椎弓根及钛网重建术+术后放疗术后3个月肺内转移;术后10个月复发;术后1年去世2女21胸5椎体及附件侵及胸4及胸6椎体胸背疼痛1年余胸5椎体次全切除减压术术后半年复查症状加重,术后1年失访3女43胸11、12右侧椎板及棘突偏右侧腰背部疼痛2年胸11、12椎板及棘突肿瘤切除术术后3个月及6个月复查症状明显减轻,术后1年失访4男16胸8附件双下肢无力、麻木1个月,二便功能障碍胸8附件肿瘤切除术术后3年复发,侵及胸7、9附件5女28腰4椎体及附件腰背部疼痛伴双下肢无力6个月前后路联合腰4肿瘤全切减压重建术术后3个月复查一般情况可,后失访6男47左侧肩胛骨左肩部疼痛10年,加重1年左肩胛骨扩大切除术+化疗术后10年患者健在7男13左肱骨上段左上臂间断疼痛半年搜刮植骨术后术后2年复发
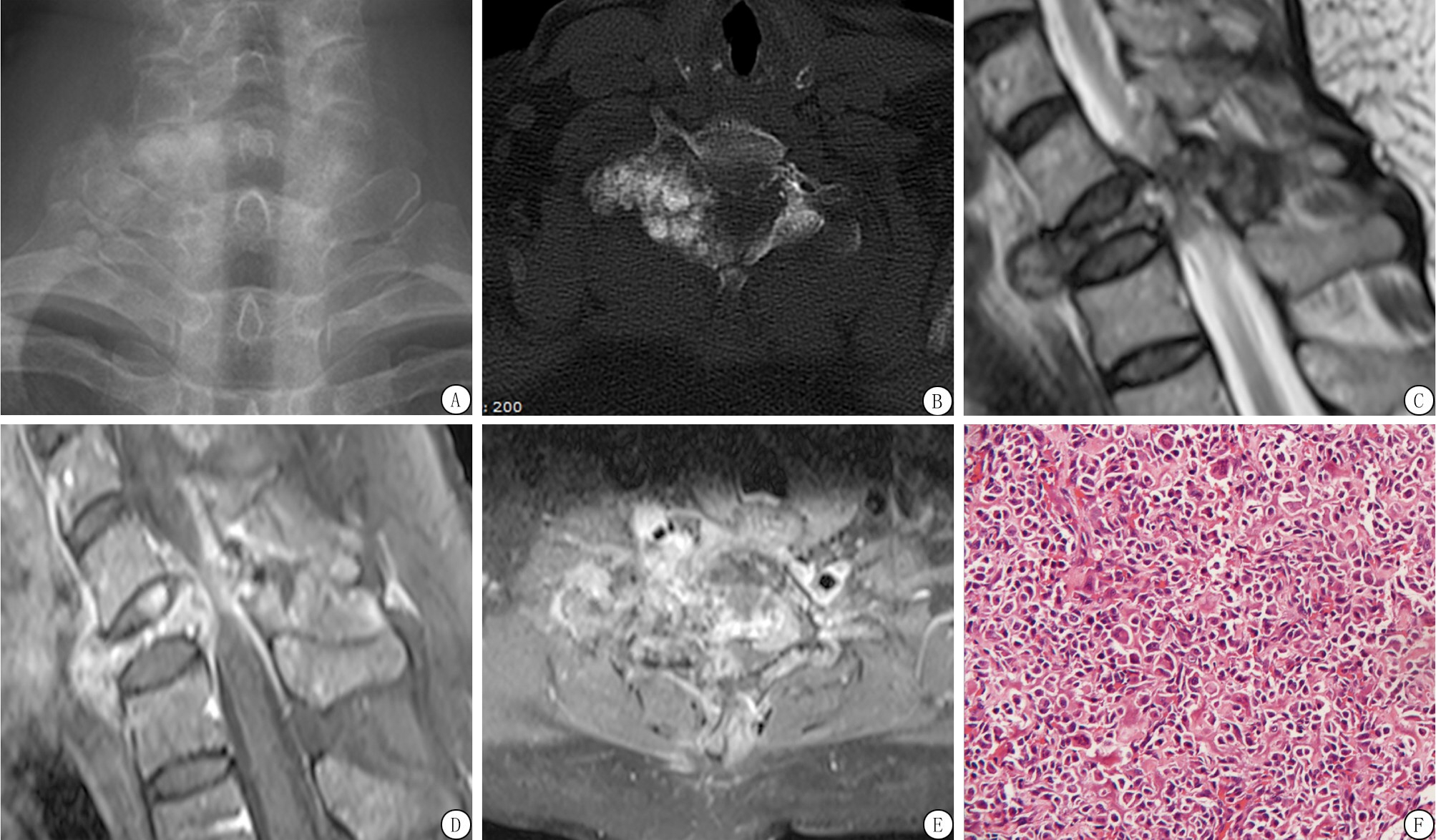
图1 颈7椎体及附件侵袭性骨母细胞瘤的影像与病理图片
A.正位X线片:颈7椎体及附件可见不规则的骨质破坏,密度增高,可见云絮状高密度影;B.CT轴位:颈7椎体及附件可见不规则的骨质破坏,其内可见不规则云絮状高密度影,边界模糊,皮质断裂,周围可见软组织肿块;C.MR表现:颈7椎体及附件T2WI呈不均匀低、等或高信号;D~E.T1WI脂肪抑制增强扫描病变呈不均匀高信号、其内可见散在低信号区,周围软组织受侵且具有强化;F.病理:肿瘤细胞呈上皮样,细胞间见骨样组织,胞质丰富,嗜酸性,核稍大,核仁明显,核分裂易见(HE ×200)
Figure 1 Imaging and pathology of aggressive osteoblastoma in cervical 7 vertebral body and accessory
3 讨 论
3.1 命名及属性 骨母细胞瘤又称成骨细胞瘤(osteoblastoma),起源于富含血管的结缔组织,以产生类骨质和编织骨为特征,周边可见大量的成骨细胞[1,3,5,9]。2013年版WHO骨肿瘤分类中将骨母细胞瘤归类为中间型(局部侵袭性),2020年版WHO骨肿瘤分类中将骨母细胞瘤归类为良性成骨性骨肿瘤。临床上由于良性骨母细胞瘤与AO的生物学行为、组织学特性及治疗方式不同,AO仍作为骨母细胞瘤的一个亚型[4-9],其在病理方面具有良性骨母细胞瘤的一般病理特点外,还可见异型的巨上皮样骨母细胞或印戒状骨母细胞,可见核分裂像[3,5,7],故亦称上皮样骨母细胞瘤[3,10]。其为介于良性骨母细胞瘤和骨肉瘤之间的一种中间恶性的肿瘤[1-3,5-8],它可由骨样骨瘤和良性骨母细胞瘤发展而来,也可以初始即表现为局部侵袭性生长,亦可是良性骨肿瘤多次手术复发而来[3,6,7]。
3.2 临床特点 骨母细胞瘤约占原发性骨肿瘤的1%[3-5,7-8,13],好发于10~30岁[3-4],偶见于10岁以下[14],男女发病比例无明显差别,可发生于任何部位的骨组织[1-16],以脊柱附件多见[4-9],占30%~46%[4-6,8],其次是长管骨[2,3,10],约占29%[2,9]。AO占原发性骨肿瘤的0.28%[7,8],好发于20~50岁[4,5],发病部位亦以脊柱为主,其次为长骨及不规则骨[3,10-16],本组7例患者5例发生于椎体及附件,亦与文献报道的相符[4-9]。本病多起病隐匿且发展缓慢,临床症状不明显且不典型,主要以局部疼痛和/或神经受压症状。本组7例患者中5例局部疼痛, 1例表现为夜间疼痛加重,发生于脊柱的3例有局部疼痛伴双下肢行走困难、肢体麻木、无力或不全瘫痪等神经受损症状[4-7]。
3.3 病理特点 良性骨母细胞瘤的病理特点是:富有血管的结缔组织间质,伴活跃产生的骨样组织和编织骨,骨小梁由丰满的骨母细胞镶边。AO的组织学特点:可见大片的骨母细胞,其大小是普通骨母细胞的2倍,细胞较饱满,呈圆形,包含大量的嗜伊红胞浆,具有明显的核仁,在核旁还可出现空亮带,称为上皮样骨母细胞[3,10,13]。
3.4 影像学表现 X线平片是诊断骨骼病变最常用的检查方法,但对中轴骨病变由于重叠较多显示欠佳。CT检查能清晰准确地显示病变的部位、范围、大小、边界,对显示病灶内部的微细结构、病灶的钙化或骨化、骨质破坏程度、有无软组织肿块以及病变与周围组织的关系,明显优于X线平片。骨母细胞瘤典型的X线及CT表现是膨胀性骨质破坏,呈三层密度改变:中心层为不规则菜花状或云絮状钙化或骨化(钙盐沉积形成钙化或骨样基质形成肿瘤骨);中间层为实性等密度(富于血管的结缔组织间质及成骨细胞成分),增强扫描后此区域可有明显强化;边缘层为高密度硬化边。AO具有良性骨母细胞瘤的表现,因其侵袭性强的特点,病灶常比良性骨母细胞瘤的病灶大(4~9 cm),病灶常突破骨皮质(皮质不连续)形成软组织肿块,边界常不清晰,硬化边常菲薄或不明显,当征象不典型时易误诊[1-4,6-8]。MRI显示肿瘤范围、软组织肿块、周围水肿及与周围组织的关系有其独特的优势[4-11],但对肿瘤内部散在的斑点状钙化、骨皮质的破坏程度及病灶周围硬化边的显示不如CT[3-4,7]。AO的MRI表现为膨胀性生长,其信号特点与良性骨母细胞瘤及其他骨肿瘤没有明显特异性[4,7],平扫在T1WI呈不均匀的等或低信号,T2WI根据组织成分不同可呈不均匀的混杂信号;病灶内的钙化或骨化在T2WI上呈低信号区,低信号区与CT上的钙化或骨化相对应;病变周围的硬化边在T1WI及T2WI上均呈低信号环;一般骨膜反应不明显,可见周围软组织水肿或肿块,增强扫描可见病灶呈不均匀强化。因AO具有丰富的血管,主要由明显扩张的毛细血管组成,偶而可见大的扩张血窦类似于动脉瘤样骨囊肿[4,15],T2WI上病变区可见多发“液-液”平面。
3.5 鉴别诊断 具有典型征象的AO诊断相对较易,但实际工作中不少AO缺乏典型征象,给诊断带来很大的困难,常常需要与骨巨细胞瘤、软骨母细胞瘤、骨肉瘤及转移瘤相鉴别。①骨巨细胞瘤:好发于青壮年(20~40岁),发病部位常位于骨端或骨突部,呈偏心性、膨胀性溶骨性破坏(皂泡状),肿瘤内没有钙化或骨化,边缘无硬化及骨膜反应。②软骨母细胞瘤:好发于青少年(10~20岁),病变多位于骨骺,呈圆形或卵圆形溶骨性破坏,边界较清晰,部分病例可见硬化边及病灶内钙化,一般无软组织肿块,常有软骨结节的环形强化。③骨肉瘤:好发于青少年(10~30岁),病变多位于干骺端,可见不规则、无定型的肿瘤骨及针状的骨膜反应,软组织肿块无钙化或骨化薄壳。④转移瘤:好发于中老年,常有原发肿瘤病史。
综上所述,AO的X线及CT表现更接近恶性成骨性肿瘤的特点,但其内的成骨形态及类型与良性骨母细胞瘤相似,MR能清晰的显示病变内软组织成分,尤其是显示继发动脉瘤样骨囊肿的征象更有意义。故确诊仍需临床、影像及病理三结合,免疫组织化学染色有助于鉴别诊断[13,16]。
[1] Dorfman HD,Weiss SW. Borderline osteoblastic tumors:problems in the differential diagnosis of aggressive osteoblastoma and low-grade osteosarcoma[J]. Semin Diagn Pathol,1984,1(3):215-234.
[2] Baker AC,Rezeanu L,Klein MJ,et al. Aggressive osteoblastoma: a case report involving a unique chromosomal aberration[J]. J Surg Pathol,2010,18(3):219-224.
[3] 徐万岐,刘振堂.原发性侵袭性骨母细胞瘤的影像学表现(附3例并文献回顾)[J].实用放射学杂志,2011,27(8):1233-1235.
[4] 袁源,邢晓颖,袁慧书.脊柱良性与侵袭性骨母细胞瘤临床与影像对比研究[J].中华放射学杂志,2018,52(5):385-389.
[5] Yin H,Zhou W,Yu H,et al. Clinical characteristics and treatment options for two types of osteoblastoma in the mobile spine:a retrospective study of 32 cases and outcomes[J]. Eur Spine J,2014,23(2):411-416.
[6] Jiang L,Liu XG,Wang C,et al. Surgical treatment options for aggressive osteoblastoma in the mobile spine[J]. Eur Spine J,2015,24(8):1778-1785.
[7] 吴昊,孙文超,闫飞飞,等.脊柱骨母细胞瘤的诊疗体会[J].中国骨与关节杂志,2018,7(3):211-218.
[8] Singh DK,Das KK,Mehrotra A,et al. Aggressive osteoblastoma involving the craniovertebral junction:a case report and review of literature[J]. J Craniovertebr Junction Spine,2013,4(2):69-72.
[9] Ando K,Imagama S,Kobayashi K,et al. Aggressive osteoblastoma of the cervical spine involving the canal and vertebral artery:a case report[J]. Eur Spine J,2017,26(Suppl 1):S111-S116.
[10] Sonnylal L,Peterson JR,Decilveo AP,et al. Giant periosteal aggressive epithelioid osteoblastoma:21-year-old male presents case in the midshaft of his femur[J]. Skeletal Radiol,2018,47(10):1443-1448.
[11] Jacques L,Mousseau I,Qasim AI,et al. Rare aggressive calvarial osteoblastoma with Dural invasion[J]. Cureus,2017,9(9):e1733.
[12] Morris CD,Hameed MR,Agaram NP,et al. Elevated β-hCG associated with aggressive osteoblastoma[J]. Skeletal Radiol,2017,46(9):1187-1192.
[13] Sharma A,Gogoi P,Arora R,et al. Aggressive osteoblastoma of the acetabulum:a diagnostic dilemma[J]. J Clin Orthop and Trauma,2018,9(Suppl 2):S21-S25.
[14] Chatterjee D,Mukhopadhyay KK,Kumar S,et al. The rare aggressive osteoblastoma in a two year old child in an unusual localization[J]. J Bone Oncol,2013,2(2):89-91.
[15] Toescu SM,Alalade AF,Steele S,et al. Frontal skull osteoblastoma with aneurysmal bone cyst-like changes associated with trauma during pregnancy:a case report[J]. Acta Neurochirurgica,2017,159(2):393-396.
[16] Salmen FS,Oliveira MR,Navarro CM,et al. Aggressive osteoblastoma in the maxilla:unusual lesion in the craniofacial skeleton[J]. J Craniofacial Surg,2017,28(3):794-797.