近年来,在人口老龄化及心脑血管疾病年轻化趋势的影响下,我国脑血管病发病人数逐年增高[1-2]。随着现代医疗卫生技术的发展,临床上对于脑血管病患者的诊断治疗方法逐步更新完善。不同类型脑血管病发病具有不同原因及危险因素,因此,对于不同患者,在基础治疗的基础上,基于个体情况特点的对因治疗方案往往随患者实际情况改变而发生变化。目前,流行病学研究表明,在脑血管病中致死率较高的一类疾病即脑出血患者[3-4],高血压是导致脑出血发病的最常见病因及危险因素,且在脑出血发病过程中及发病后也往往合并血压显著升高[5-7],与既往高血压病史、颅内压升高、应激反应、面对疾病的心理紧张状态等多种因素有关[8-9]。因此,严格控制脑出血患者的血压是治疗的关键措施之一。然而,目前在急性自发性脑出血患者发病后的早期安全降压范围及理想血压控制目标等方面仍存在争议[10-12]。因此,本研究对近年来国内外有关急性自发性脑出血降压治疗的随机对照试验进行了Meta分析,综合阐述了急性自发性脑出血后早期启动降压治疗的不同措施,对各研究数据进行了合并分析,并对不同干预措施所取得的临床效果进行了综合比较,为急性自发性脑出血患者的血压控制范围及预后评估提供指导和依据。
1 资 料 与 方 法
1.1 一般资料 计算机检索2000—2019年由PubMed、Cochrane、Embase、CNKI、WanFang和VIP等数据库收录的有关急性自发性脑出血早期启动降压治疗的研究及其参考文献,通过其他途径收集尚未发表的随机对照试验研究、会议文件等相关资料。
1.2 纳入标准与排除标准 纳入标准:①发病24 h以内;②出现卒中样临床表现及症状、体征(包括意识障碍、语言障碍、瘫痪、感觉障碍、剧烈头痛、呕吐、共济失调、视力视野障碍等);③CT扫描示颅内血肿。④收缩压(systolic blood pressure,SBP)≥150 mmHg(1 mmHg=0.133 kPa);⑤具有其他支持急性自发性脑出血诊断的因素;排除标准:①无早期降压治疗禁忌证;②排除颅内动脉瘤、创伤、肿瘤、凝血功能异常等其他原因导致的脑出血。
1.3 干预措施 试验组为早期强化降压治疗组[13-15],对照组为保守降压治疗组[16-17],除降压治疗措施不同外,两组在其他治疗及一般治疗方式上无差别。
1.4 结局指标 主要结局(死亡或严重残疾[18-19])、血肿扩大事件发生情况,见表1。
表1 各项研究所比较结局指标

研究 主要结局 血肿扩大事件Anderson 等[20]死亡或严重残疾24 h CT扫描证实血肿体积较基线增加33%以上或增加>12.5 mLAnderson 等[21]死亡或严重残疾24 h CT扫描证实血肿体积较基线增加33%以上或增加>12.5 mLButcher 等[22]死亡或严重残疾24 h血肿体积较基线增长6.0 mL以上ATACH1[23]死亡24 h CT扫描证实血肿体积较基线增加33%以上或增加>12.5 mLQureshi 等[24]死亡或严重残疾24 h CT扫描证实血肿体积较基线增加33%以上
1.5 检索策略 采用PICOS法在各中英文数据库进行检索。
1.6 文献筛选及数据提取 在严格遵循研究对象纳入与排除标准的前提下,由两名相互独立的评价者分别对初步收集到的全部相关文献进行筛选,具体步骤如下(前三步由两名评价者独立完成,第四步由两名评价者讨论协商完成):第一步,通过EndNote剔除重复文献,得到“结果Ⅰ”;第二步,对“结果Ⅰ”中所保留文献进行标题及摘要阅读,再次去除不符合纳入标准的文献,得到“结果Ⅱ”;第三步,进一步阅读“结果Ⅱ”中所有可能纳入文献的正文部分,继续排除非随机对照试验、无法获取原始数据或综述类文献等,得到“结果Ⅲ”;第四步,两名评价者对各自所得的不同“结果Ⅲ”进行交叉核对与讨论,若存在无法达成一致的异议,则通过与作者或通信作者联系,由作者或通信作者作出最终决定,得到“结果Ⅳ”。获得最终结果即“结果Ⅳ”后,采用Cochrance偏倚风险评估工具对各文献进行质量评价。
1.7 统计学方法 应用RevMan 5.3软件进行Meta分析。所提取数据均为计数资料,采用比值比(odds ratio,OR)及其95%可信区间(confidence interval,CI)作为统计量。首先进行χ2检验评估各项研究间的异质性,作为指导数据分析合并的依据。为减少犯第Ⅱ类错误的概率,取α= 0.1作为检验水准,若I2<50%,P>α,则认为各研究结果间不存在统计学异质性,可采用固定效应模型进行数据分析;若I2>50%,P<α,则认为各研究结果间存在统计学异质性,须对其异质性产生的来源进行分析,进一步对各个可能的影响因素进行亚组分析。P< 0.05为差异有统计学意义。
2 结 果
2.1 文献检索结果 采用PICOS法在PubMed、Cochrane、Embase、CNKI、WanFang和VIP等中英文数据库进行初步检索,通过其他途径获取尚未发表的随机对照试验、会议文件等相关资料,共收集到相关文献383篇。进行筛选,第一步,经EndNote剔除重复文献87篇;第二步,通过逐一阅读标题及摘要后排除主题不符的文献229篇;第三步,阅读全文后继续排除无法提取试验数据或未得出明确结论的文献47篇、综述7篇、Meta分析8篇;第四步,经交叉核对及讨论,最终纳入5篇[20-24]文献。采用Cochrance偏倚风险评估工具分别对每项随机对照试验进行质量评价。文献筛选及纳入流程见图1。所纳入研究的基本资料见表2。
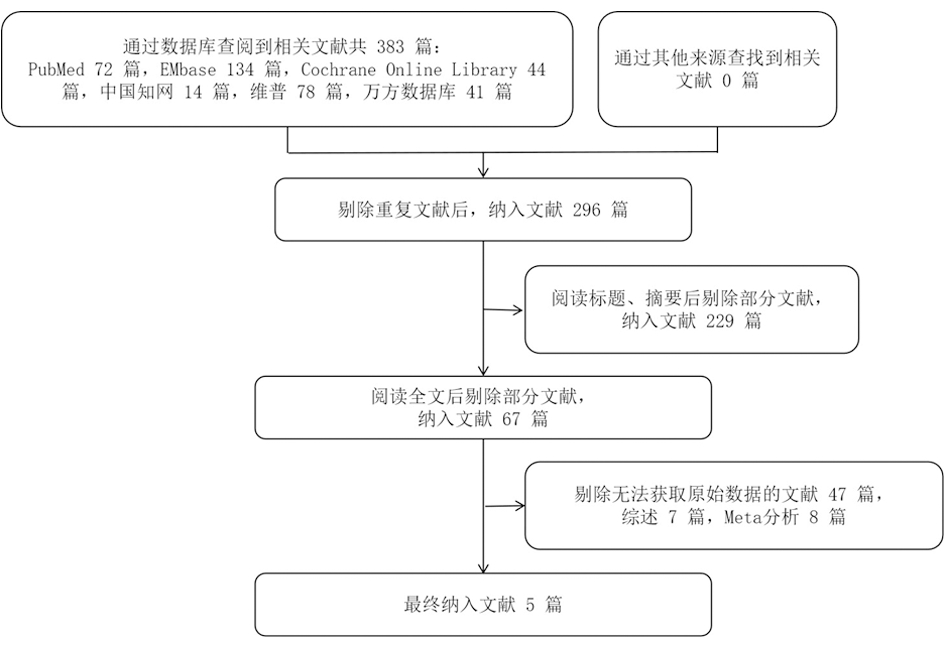
图1 文献筛选及纳入流程
表2 纳入文献的基本资料
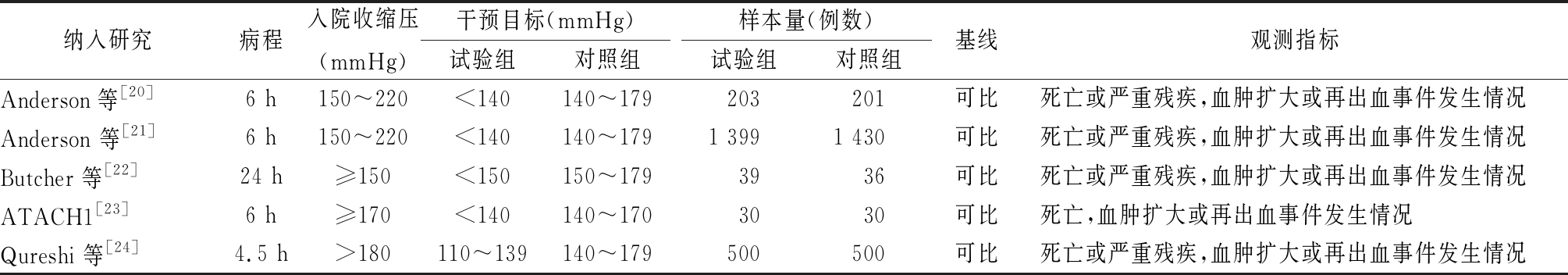
纳入研究病程入院收缩压(mmHg)干预目标(mmHg)试验组对照组样本量(例数)试验组对照组基线观测指标Anderson等[20]6 h150~220<140140~179203201可比死亡或严重残疾,血肿扩大或再出血事件发生情况Anderson 等[21]6 h150~220<140140~1791 3991 430可比死亡或严重残疾,血肿扩大或再出血事件发生情况Butcher 等[22]24 h≥150<150150~1793936可比死亡或严重残疾,血肿扩大或再出血事件发生情况ATACH1[23]6 h≥170<140140~1703030可比死亡,血肿扩大或再出血事件发生情况Qureshi 等[24]4.5 h>180110~139140~179500500可比死亡或严重残疾,血肿扩大或再出血事件发生情况
2.2 Meta分析结果
2.2.1 试验组与对照组主要结局比较 采用χ2检验方法对各研究结果进行齐性检验,发现尚不能认为各项研究之间存在异质性(I2=30%,P=0.22),可采用固定效应模型进行数据合并分析。OR=0.95,95%CI:0.79~1.15,Z=0.49,P=0.63,尚不能认为两组主要结局发生情况有差别(图2)。
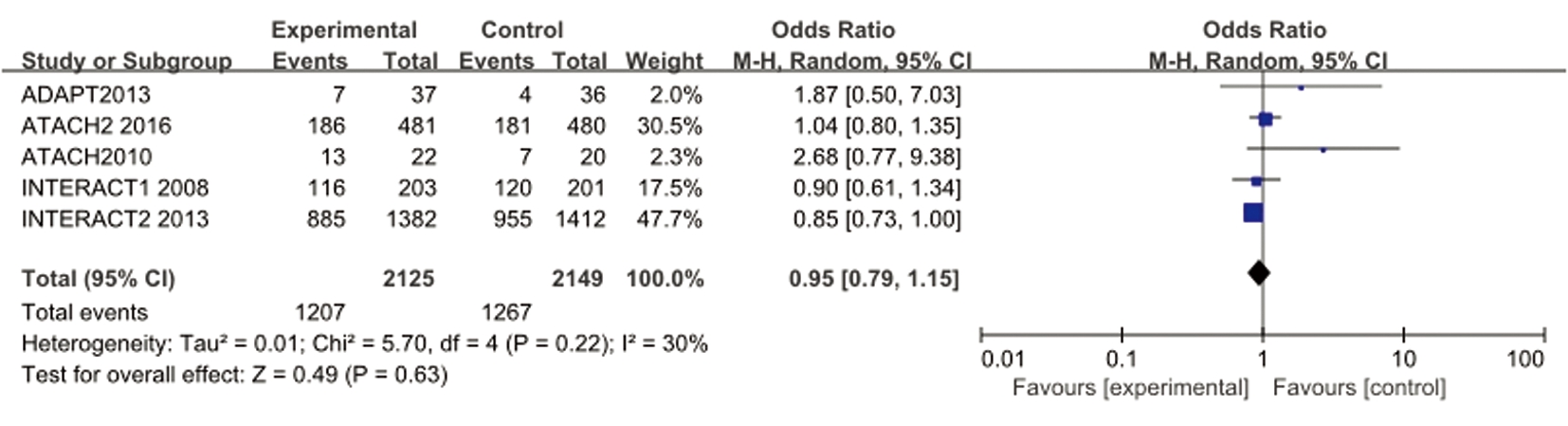
图2 试验组与对照组主要结局发生情况比较的森林图
2.2.2 试验组与对照组血肿扩大事件发生情况比较 经χ2检验显示各项研究之间不存在异质性(I2=5%,P=0.38),因此采用固定效应模型进行数据合并分析。OR=0.86,95%CI:0.74~1.00,Z=1.99,P=0.05,因P值处于临界状态,且OR的95%CI包涵1.00在内,故尚不能认为两组差异有统计学意义,可通过增大样本量等方法进一步研究,得出更精确结论(图3)。
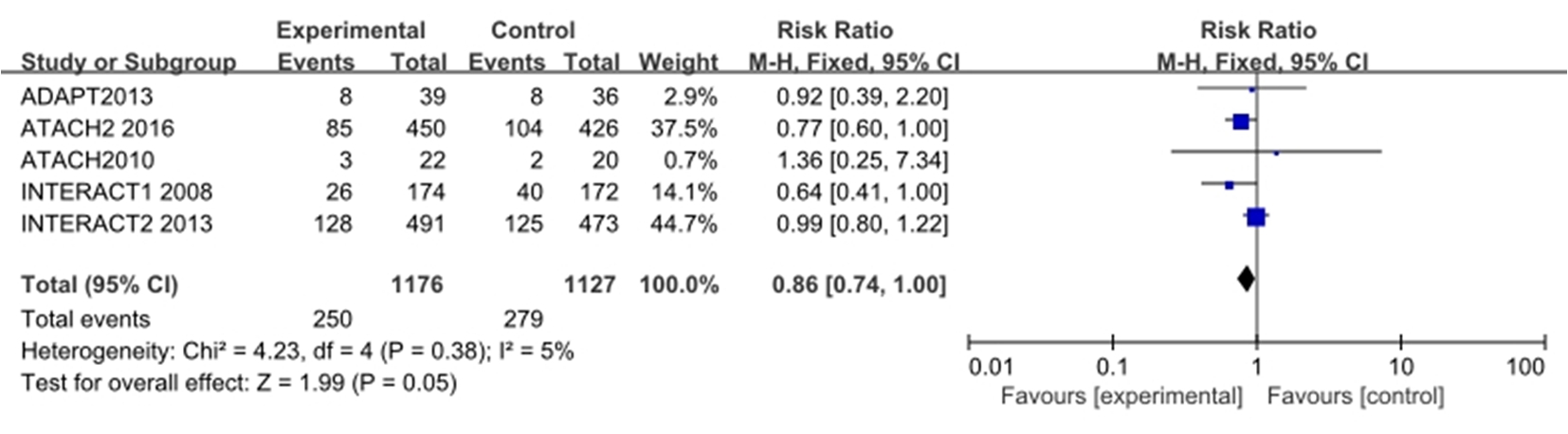
图3 试验组与对照组血肿扩大事件发生情况比较的森林图
2.3 敏感性分析 经转换效应模型及OR值与RR值变换后,各项比较P值均≥0.05,且血肿扩大事件发生情况OR(95%CI)、RR(95%CI)均包涵1.00,与固定效应模型研究所得结论一致。表明本研究结果总体上稳定可靠(表3)。
表3 经效应模型转换及统计量值变换后的敏感性分析
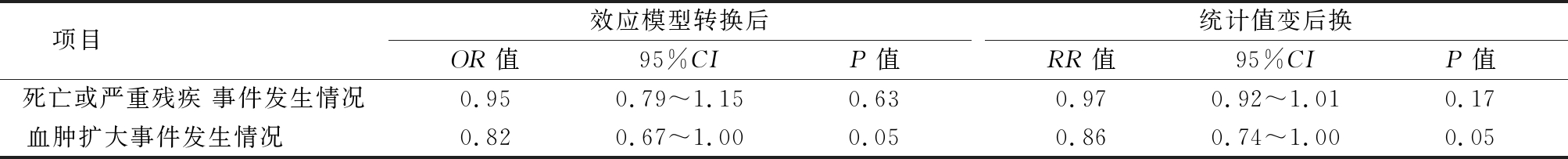
项目 效应模型转换后 OR值95%CIP值统计值变后换RR值95%CIP值死亡或严重残疾 事件发生情况0.950.79~1.150.630.970.92~1.010.17血肿扩大事件发生情况 0.820.67~1.000.050.860.74~1.000.05
2.4 发表偏倚 因所纳入的随机对照试验数量较少,故对该5项研究进行发表偏倚分析尚缺乏实际意义。但漏斗图所见各研究基本呈对称漏斗状分布,Egger′s检验基于主要结局发生情况P=0.180,基于血肿扩大事件发生情况P=0.262,均提示不存在显著发表偏倚。
3 讨 论
在脑血管病发病过程中,多种因素对患者神经功能恢复具有较大影响[25]。其中,血压变化既影响着起病过程,又对患者发病的严重程度及预后评估起到一定作用[26-28]。特别是在急性自发性脑出血患者,血压波动与病情变化及预后评估息息相关[29-30]。而国内外研究表明,高SBP与脑出血后血肿扩大及再出血、颅内压增高甚至脑疝、神经功能恶化、残疾和死亡等风险增加均相关[31],因此在急性自发性脑出血患者早期启动降压治疗对患者神经功能恢复及远期预后具有积极作用[32-33]。但另一方面,脑组织血流灌注依赖于一定的血压强度,若脑出血后迅速将血压降至过低,特别是对于既往有高血压病史的患者,有引起脑组织低灌注和继发性缺血性血管事件发生的风险[34]。
Meta分析通过系统评价对急性自发性脑出血患者不同降压治疗措施的临床随机对照试验研究,发现早期积极启动强化降压治疗对急性自发性脑出血患者总体上是安全的,不增加死亡或严重残疾事件发生率及血肿扩大风险。因此基于本研究所纳入试验综合分析,对于发病6 h内、SBP在150~220 mmHg,且无降压治疗禁忌证的急性自发性脑出血患者,可早期启动降压治疗,在1 h内使血压达到140 mmHg以下。但该干预措施是否能为患者带来实际意义上的获益尚不明确。关于更加确切的理想血压控制范围,Arima 等[35]将患者依据1~24 h、2~7 d降压治疗所达到的血压值范围高低分为五组,经统计分析发现,在急性自发性脑出血超急性期即发病1~24 h内将血压降低并维持在130 mmHg左右、在急性期即发病2~7 d内将血压维持在130~139 mmHg之间可降低患者生理功能障碍发生的风险;而在急性期内,当将血压降到120 mmHg左右时,与维持在130 mmHg左右相比较,导致患者死亡或严重残疾的风险略有增加(OR=1.52,95%CI:1.14~2.02,P=0.005)。但该研究所纳入样本含量较少,因此尚不能得出明确结论。关于强化降压治疗维持时间,在Qureshi等[36]研究中,根据研究对象2 h内SBP是否降至110~139 mmHg以及是否维持24 h将其分为三组,即对照组(2 h未降至140 mmHg以下)、试验组Ⅰ(2 h降至140 mmHg以下且维持24 h)、试验组Ⅱ(2 h降至140 mmHg以下但未能维持24 h),研究发现,尽管两试验组患者与对照组相比,主要结局即3个月死亡或严重残疾事件发生率差异无统计学意义,但试验组Ⅱ与试验组Ⅰ相比,3个月死亡或严重残疾事件发生率增高。因此,对于接受早期强化降压治疗的患者,应全面权衡利弊,尽可能避免在治疗过程中因多方面因素影响以致血压控制不能维持至少24 h而导致不良后果事件的发生。
当前研究结果仍存在一定局限性,在分析时应综合考虑多种因素。临床上,急性自发性脑出血的发生、演变及结局、预后与多种因素有关[37]。本研究所纳入的试验虽然存在一定同质性,但不同研究所制定的纳入标准并不完全相同,不同研究所采取的干预措施也存在一定差异,这些异质性因素均可能在一定程度上影响Meta分析的结果。如不同发病时间、不同基础血压水平、不同降压药物、不同给药方式、不同维持时间等可能对试验结果造成一定影响。不同研究之间所纳入样本量存在较大差异,不同地区人口流行病学特点及不同个体之间也存在不可避免的差异,研究所纳入的样本可能并非全部来源于多中心,因此,所纳入样本是否具有充分的代表性尚不明确,基于不同样本所进行的分析可能得出不同结论。本研究中所纳入患者均为入院时SBP较高的患者,不同患者发病后SBP波动特点存在差异,可能由不同的机制所引起,但对于不同血压波动特点的患者,采取何种降压方式具有更佳效果,及根据血压波动特点制定个体化血压控制方案的相关临床试验研究较少。对于入院时SBP≥220 mmHg,或既往高血压病3级且长期血压控制不良导致血压一直处于较高水平患者,早期强化降压治疗是否会引起重要脏器如肾脏灌注不足,甚至增加肾功能衰竭的风险[38],以及是否会在出血的基础上继发缺血性卒中事件等,仍需要基于不同基础状况患者的大样本临床试验研究,以探索对于特殊患者急性自发性脑出血急性期内强化降压治疗的理想血压控制范围。
目前,对于急性自发性脑出血的疾病演变及预后评估尚存在一些未明确的影响因素。国内外研究表明,急性自发性脑出血患者预后除与SBP有关之外,可能还与出血部位、出血量、血肿形状、患者年龄及基础健康状况等多种因素有关。尽管关于急性自发性脑出血降压治疗措施的临床研究存在不同观点及结论,但目前对于不同部位、不同体积急性自发性脑出血患者降压治疗理想目标的研究较少,对于影响血肿形状的因素及有效干预或预防措施研究亦较少。此外,急性自发性脑出血所引发的应激反应对于急性期血压波动也存在一定影响,应激反应所导致的体液中激素水平变化密切影响着血压水平的变化,因此对于应激反应较强烈的患者或病程时期是否需要采取更严格的手段强化降压治疗,以及随着应激反应逐渐撤退是否需要以及何时将降压药物逐渐减量等亦需要进一步临床试验研究。
综上所述,本研究为指导急性自发性脑出血患者早期降压治疗提供了更多可靠依据。但由于其中存在的不可避免的局限性因素,在应用该研究结果时,应根据患者的不同临床特点进行个体化分析、治疗。尽管就目前研究结果来看,早期强化降压治疗对急性自发性脑出血患者是安全的,但其是否会为患者带来实际意义上的获益,以及是否存在其他潜在风险,尚需要开展更多大样本、多中心、基于不同病理生理学特点人群的随机对照试验临床研究以全面探索,从多角度综合阐述早期强化降压治疗对于不同患者的临床疗效及安全性。
[1] 崔诗悦.河北省心脑血管事件现况研究[D].唐山:华北理工大学,2017.
[2] 吴亚哲,陈伟伟.中国脑卒中流行概况[J].心脑血管病防治,2016,16(6):410-414.
[3] 李伟,刘鸣,冯社军,等.脑梗死和脑出血患者的临床特点及长期预后观察[J].中华医学杂志,2008,88(13):892-897.
[4] Flaherty ML,Haverbusch M,Sekar P,et al. Long-term mortality after intracerebral hemorrhage[J]. Neurology,2006,66(8):1182-1186.
[5] Aiyagari V. The clinical management of acute intracerebral hemorrhage[J]. Expert Rev Neurother,2015,15(12):1421-1432.
[6] Celikbilek A,Goksel BK,Zararsiz G,et al. Spontaneous intracerebral hemorrhage:a retrospective study of risk factors and outcome in a Turkish population[J]. J Neurosci Rural Pract,2013,4(3):271-277.
[7] 闫燕.脑出血与脑梗死急性期的血压观察与护理分析[J].中国医药指南,2015,13(20):251-252.
[8] 杨东琴.自发性高血压大鼠脑出血模型脑出血急性期血肿旁水肿和血压的相关性研究[D].福州:福建医科大学,2012.
[9] Qureshi AI,Tuhrim S,Broderick JP,et al. Spontaneous intracerebral hemorrhage[J]. N Engl J Med,2001,344(19):1450-1460.
[10] Bath P,Chalmers J,Powers W,et al. International society of Hypertension (ISH):statement on the management of blood pressure in acute stroke[J]. J Hypertens,2003,21(4):665-672.
[11] Broderick J,Connolly S,Feldmann E,et al. Guidelines for the management of spontaneous intracerebral hemorrhage in adults:2007 update:a guideline from the american heart association/american stroke association stroke council,high blood pressure research council,and the quality of care and outcomes in research inter disciplinary working group[J]. Stroke,2007,38(6):2001-2023.
[12] 胡智伟.中国脑血管病防治指南[A].浙江省中西医结合学会.浙江省中西医结合学会急救医学专业委员会第三次学术年会暨省级继续教育学习班论文汇编[C].浙江省中西医结合学会:浙江省科学技术协会,2007:17.
[13] 冯亚忠,聂志余.高血压性脑出血急性期血压管理[J].中华实用诊断与治疗杂志,2011,25(6):521-523.
[14] Ye Z,Ai X,Zheng J,et al. Antihypertensive treatments for spontaneous intracerebral hemorrhage in patients with cerebrovascular stenosis:a randomized clinical trial (ATICHST)[J]. Medicine (Baltimore),2017,96(26):e7289.
[15] Lattanzi S,Cagnetti C,Provinciali L,et al. How should we lower blood pressure after cerebral hemorrhage?A systematic review and meta-analysis[J]. Cerebrovasc Dis,2017,43(5/6):207-213.
[16] Huttner HB,Kuramatsu JB. Aktuelle Therapieziele bei intrazerebralen Blutungen Current treatment concepts in intracerebral hemorrhage[J]. Med Klin Intensivmed Notfmed,2017,112(8):695-702.
[17] Schaafsma JD,Klijn CJ,van Kooten F,et al. Acute treatment of hypertension in intracerebral haemorrhage[J]. Ned Tijdschr Geneeskd,2014,158:A7788.
[18] Qureshi AI,Palesch YY,Martin R,et al. Antihypertensive treatment of acute cerebral hemorrhage study investigators. Effect of systolic blood pressure reduction on hematoma expansion,perihematomal edema,and 3-month outcome among patients with intracerebral hemorrhage:results from the antihypertensive treatment of acute cerebral hemorrhage study[J]. Arch Neurol,2010,67(5):570-576.
[19] Chen G,Arima H,Wu G,et al. Subarachnoid extension of intracerebral hemorrhage and 90-day outcomes in INTERACT2[J]. Stroke,2014,45(1):258-260.
[20] Anderson CS,Huang Y,Wang JG,et al. Intensive blood pressure reduction in acute cerebral haemorrhage trial (INTERACT):a randomised pilot trial[J]. Lancet Neurol,2008,7(5):391-399.
[21] Anderson CS,Heeley E,Huang Y,et al. Rapid blood-pressure lowering in patients with acute intracerebral hemorrhage[J]. N Engl J Med,2013,368(25):2355-2365.
[22] Butcher KS,Jeerakathil T,Hill M,et al. The intracerebral hemorrhage acutely decreasing arterial pressure trial[J]. Stroke,2013,44(3):620-626.
[23] Antihypertensive Treatment of Acute Cerebral Hemorrhage (ATACH) investigators. Antihypertensive treatment of acute cerebral hemorrhage[J]. Crit Care Med,2010,38(2):637-648.
[24] Qureshi AI,Palesch YY,Barsan WG,et al. ATACH-2 trial investigators and the neurological emergency treatment trials network. Intensive blood-pressure lowering in patients with acute cerebral hemorrhage[J]. N Engl J Med,2016,375(11):1033-1043.
[25] Morotti A,Goldstein JN. Diagnosis and management of acute intracerebral hemorrhage[J]. Emerg Med Clin North Am,2016,34(4):883-899.
[26] Ma J,Li H,Liu Y,et al. Effects of intensive blood pressure lowering on intracerebral hemorrhage outcomes:a meta-analysis of randomized controlled trials[J]. Turk Neurosurg,2015,25(4):544-551.
[27] Manning L,Hirakawa Y,Arima H,et al. INTERACT2 investigators. Blood pressure variability and outcome after acute intracerebral haemorrhage:a post-hoc analysis of INTERACT2,a randomised controlled trial[J]. Lancet Neurol,2014,13(4):364-373.
[28] Chan E,Anderson CS,Wang X,et al. Significance of intraventricular hemorrhage in acute intracerebral hemorrhage:intensive blood pressure reduction in acute cerebral hemorrhage trial results[J]. Stroke,2015,46(3):653-658.
[29] 陈邓,陈涛,朱丽娜,等.强化控制血压治疗脑出血有效性和安全性的Meta分析[J].中国现代神经疾病杂志,2016,16(1):16-22.
[30] 陈新,周中和,曲方.高血压性脑出血早期强化降血压是否有益[J].中国实用内科杂志,2008,28(10):902-904.
[31] Shi L,Xu S,Zheng J,et al. Blood pressure management for acute intracerebral hemorrhage:a meta-analysis[J]. Sci Rep,2017,7(1):14345.
[32] Gong S,Lin C,Zhang D,et al. Effects of intensive blood pressure reduction on acute intracerebral hemorrhage:a systematic review and meta-analysis[J]. Sci Rep,2017,7(1):10694.
[33] Delcourt C,Stapf C,Tzourio C,et al. The second (main) phase of an open,randomised,multicentre study to investigate the effectiveness of an INTEnsive blood pressure Reduction in Acute Cerebral hemorrhage Trial (INTERACT2):protocol and baseline characteristics of patients included in France[J]. Rev Neurol (Paris),2012,168(4):321-327.
[34] McCourt R,Gould B,Gioia L,et al. Cerebral perfusion and blood pressure do not affect perihematoma edema growth in acute intracerebral hemorrhage[J]. Stroke,2014,45(5):1292-1298.
[35] Arima H,Heeley E,Delcourt C,et al. Optimal achieved blood pressure in acute intracerebral hemorrhage:INTERACT2[J]. Neurology,2015,84(5):464-471.
[36] Qureshi AI,Palesch YY,Foster LD,et al. Blood pressure-attained analysis of ATACH 2 trial[J]. Stroke,2018,49(6):1412-1418.
[37] Kitamura M,Tateishi Y,Sato S,et al. Association between serum calcium levels and prognosis,hematoma volume,and onset of cerebral hemorrhage in patients undergoing hemodialysis[J]. BMC Nephrol,2019,20(1):210.
[38] Delcourt C,Huang Y,Wang J,et al. The second(main) phase of an open,randomised,multicentre study to investigate the effectiveness of an intensive blood pressure reduction in acute cerebral haemorrhage trial(INTERACT2)[J]. Int J Stroke,2010,5(2):110-116.