大隐静脉内皮细胞(endothelial cells,ECs)作为选择性通透屏障可以在血液和组织间交换物质,其功能障碍与血管系统的结构和功能变化密切相关[1],ECs结构受损和功能紊乱是动脉粥样硬化、冠心病以及高血压[2-4]等多种心血管疾病发病的始动环节,因此血管内皮功能的保护成为治疗心血管疾病的新方向之一[5]。ECs的体外培养是研究ECs功能和特性的重要手段,现有的ECs获取方法所获取的细胞数太少或存活率低,难于获得满意效果。本实验参考并改进意大利学者Tisato等[6]获取静脉ECs的方法,建立一种可靠的犬大隐静脉ECs分离和培养的新方法,为研究ECs相关心血管疾病提供实验基础。
1 材料与方法
1.1 材料来源 比格犬(n=10)由上海交通大学医学院附属第九人民医院动物房提供;0.1%胶原酶(SERVA公司);血清(Biowest公司);低糖DMEM 培养基(HyClone公司);鼠抗人Ⅷ因子单克隆抗体(Santa Cruz 公司) ;FITC标记的二抗(EarthOx公司)。
1.2 大隐静脉ECs的分离、培养 比格犬全身麻醉后,剃毛、消毒、铺巾。快速分离出大隐静脉,在结扎所有分支后再离断血管主干,标记出远心端。血管取出后置于无菌氯霉素溶液中清洗约30 min,后于无菌布单上用细镊子从远心端轻轻插到近心端夹住一个角将血管的内面翻到外面,氯霉素溶液清洗后置于0.1%胶原酶放于温箱中振荡6~7 min后取出,消化液离心,重悬,种于培养瓶内。取出的血管放于盛有适量完培(普通低糖DMEM中含10%FBS及1%双抗)的培养皿内,用刀片稍用力刮血管表面并涮洗,将涮洗液离心后,继续用0.1%胶原酶消化3 min左右,加三倍消化液体积的完培终止消化,1 500 r/min离心5 min,弃上清后用5 mL培养基重悬,混匀后取100 μL在计数板上计数,调整细胞浓度至1×105个/mL,并加入20 μL内皮细胞生长因子,放入37 ℃、5%CO2培养箱24 h后更换培养液,以去除未贴壁的细胞,后面每隔2 d更换1次培养液。分离血管期间,注意保持血管的水分,并且可以用罂粟碱保护ECs活性。对照组采用Veronica Tisato分离法,没有胶原酶再消化这个过程,其他步骤一样。
1.3 大隐静脉ECs传代培养 原代ECs融合后用无菌PBS洗两次,加入2.5 mL预热的0.25%胰蛋白酶溶液,再放入37 ℃ 培养箱内3~4 min,取出并拍打培养瓶周围,显微镜下见细胞绝大多数变圆上浮后加入3倍胰蛋白酶溶液体积的完培,吹打制成细胞悬液,再将细胞溶液转移至15 mL离心管,1 500 r/min离心5 min,弃上清,再用完培重悬,计数后调整细胞浓度为1×105个/mL继续培养。
1.4 大隐静脉ECs存活率的测定 用台盼蓝的方法进行测定。取24孔培养板每孔加入1 mL上述细胞悬液,去弃培养液,每孔加入0.5 mL 0.01%的台盼蓝,2~3 min后在倒置显微镜400倍下随机选择6个视野,对死亡细胞进行计数,存活细胞不染色,细胞存活率(%)=(100-着色细胞数)/100×100%,n=10,取平均数。
1.5 大隐静脉ECs的鉴定
1.5.1 倒置显微镜观察ECs形态和生长情况 取适量细胞悬液滴于干净的载玻片上,加上盖玻片后利用倒置显微镜进行观察。
1.5.2 免疫荧光技术 将细胞悬液接种于预先加有盖玻片的培养孔内孵育72 h后用PBS洗2次,置玻片于预冷的丙酮中,-20 ℃固定10 min,PBS洗2次,再用5%山羊血清室温封闭30 min,加入一抗(兔抗人Ve-Cadherin 抗体)于4 ℃下孵育过夜,PBS洗涤3次后,继续加入二抗(羊抗兔IgG)在室温下孵育2 h,然后暗室用PBS洗涤 5 min共3次。阴性对照组用不含抗体的等量PBS代替。
1.5.3 免疫组织化学技术 将犬大隐静脉内皮细胞悬液滴入96孔培养板,100 μL/孔(约105个/孔),待细胞长满培养孔时,采用免疫组织化学方法鉴定Ve-Cadherin抗原,一抗为兔抗人内皮细胞Ve-Cadherin抗原多克隆抗体 (稀释比例为1∶50),阴性对照组用不含抗体的等量PBS代替。
1.5.4 扫描电镜样本制作和观察 将细胞悬液接种于预先加有盖玻片的6孔培养板内孵育48 h、1周后,3%戊二醛4 ℃固定1 h,PBS液洗涤 10 min共3次,1%锇酸固定1 h,PBS洗涤3次后用乙醇梯度脱水,CO2临界点干燥,真空下喷金后置于扫描电镜下拍照。
1.6 统计学方法 应用SPSS 22.0软件处理数据。计量资料比较采用t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 形态学观察 利用倒置显微镜观察,刚分离下来数小时ECs呈透亮的小圆形,有的聚集成团,24 h后细胞团的外围可见细胞逐渐伸展移行;其余游离细胞多在培养2~12 h不同程度贴壁,随着时间延长,内皮细胞有的呈梭形,有的呈多角形,伸展生长。细胞在第5~8天生长最快,可逐渐生长成梭形,然而有些细胞排列呈鱼贯状相连,间有排列呈漩涡状。细胞胞浆丰富,细胞核较清晰,呈椭圆形或圆形,核分裂相多见,一般为1~2个核仁。于生长至第14天左右开始融合,胞体呈多角形,呈“铺路石”状单层排列,互相嵌合。传代培养的细胞大小较均匀呈典型的“鹅卵石”样。见图1。
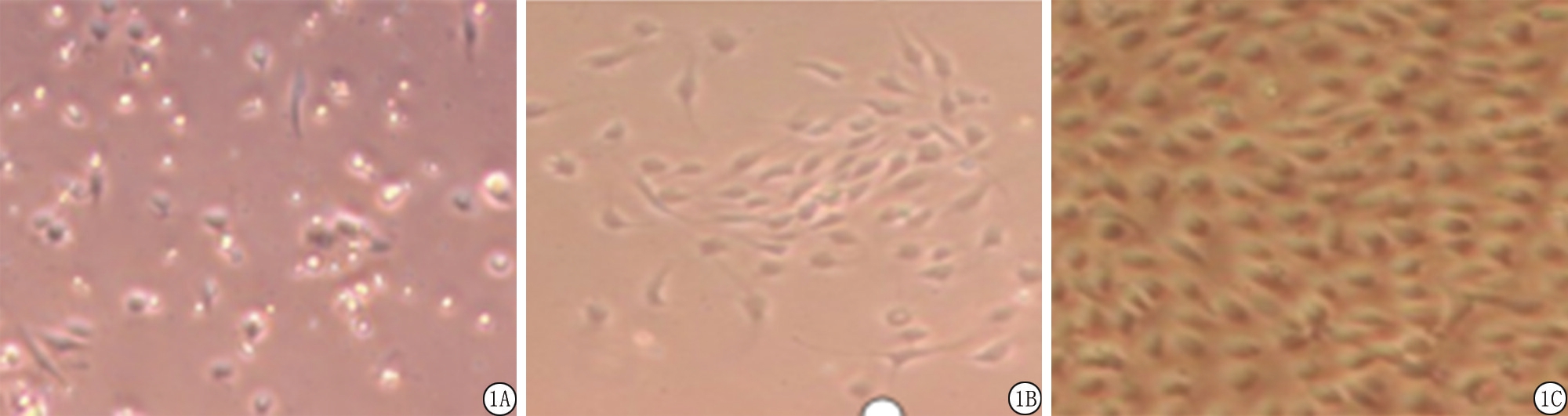
图1 大隐静脉ECs培养观察( ×100)
A.第3天;B.第8天;C.第15天
Figure 1 Observation of saphenous vein ECS culturing( ×100)
2.2 内皮特异性抗原免疫荧光 Ve-Cadherin抗原为ECs的特异性标志物,免疫荧光染色法可见被Ve-Cadherin 抗体标记染色的细胞胞浆内充满绿色荧光颗粒,证明细胞内有Ve-Cadherin抗原的存在,即为阳性反应,对照组细胞为阴性结果。见图2。
2.3 内皮特异性抗原免疫组织化学 显微镜下可见多数细胞呈圆形、梭形或多角形,胞浆较丰富,应用Ve-Cadherin抗体的细胞内可见棕黄色的染色颗粒,证明细胞内有Ve-Cadherin抗原的存在,判定为阳性反应,对照组细胞为阴性结果。 见图3。
2.4 扫描电镜观察 细胞呈多角形、长梭形、短梭形或者不规则形,游离面可见有微绒毛从胞浆中伸出,附着于邻近细胞表面,基底面以许多条丝状结构连接于基底。细胞表面可见一些分布不均,大小不一的小凹窝,略微隆起处为细胞核所在部位。见图4。
2.5 两种ECs分离方法细胞存活率比较 本方法分离的大隐静脉ECs存活率为(75.39±12.61)%,同期使用Veronica Tisato分离方法的ECs存活率为(47.28±9.59)%,差异有统计学意义(t=6.742,P<0.01)。
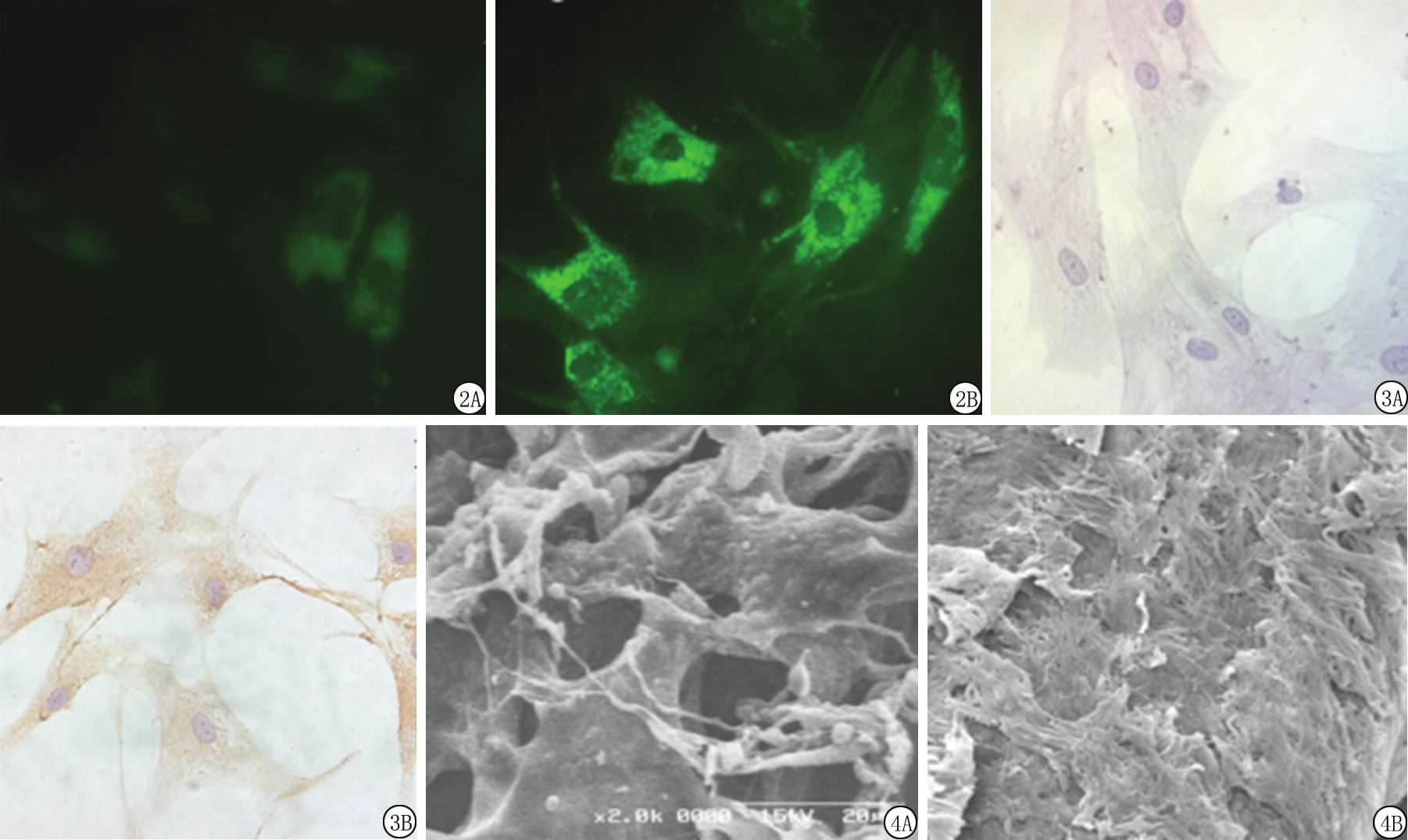
图2 免疫荧光染色结果( ×400)
A.对照组;B.实验组
Figure 2 Results of immunofluorescent staining ( ×400)
图3 免疫组织化学染色结果( ×400)
A.对照组;B.实验组
Figure 3 Results of immunohistochemical staining ( ×400)
图4 扫描电镜结果
A.培养48 h( ×10 000);B.培养1周( ×5 500)
Figure 4 Observation of scanning electron microscopy
3 讨 论
心血管疾病已成为世界范围内的第二大致死因素。ECs功能障碍被认为是发生心血管疾病的始动因素,因为功能障碍的血管ECs易成为心血管疾病危险因子作用的靶器官[7-8],它可以导致血管收缩、血栓形成、血压增高、动脉粥样硬化以及管腔狭窄、闭塞等。由此可知,血管ECs的功能状态与人类的健康和寿命密切相关,研究心血管疾病的发病机制和诊疗效果离不开有效分离和培养血管ECs的细胞学基础。
本研究选择犬大隐静脉来获取血管ECs,该方法操作简单、取材方便、可获得细胞数较多,更为重要的是在去除大隐静脉后不影响犬的继续存活,从而为组织工程血管回植奠定了基础,也为心血管疾病发病的病理生理相关机制研究提供了方便。有学者曾通过将受体ECs种植在移植物上的组织工程学方法,使移植物可生长、修复、重塑,不需抗凝及免疫抑制剂,从而改善移植物组织结构和功能,并延长其使用寿命[9]。体外培养血管ECs是研究血管ECs功能特性的一种重要手段,1973年ECs体外培养的方法被Jaffe[10]首次报道,随后大批学者将一系列的改进和创新应用在ECs的培养方法上[11-12],笔者也参考过很多文献的方法,有组织块移植、酶消化和机械刮取法,组织块移植法成功率低且极易混入血管壁的其它血管壁细胞,近几年来已逐渐被酶消化法取代,然而我们通过多次的实验发现单独用酶消化法不是获取的细胞数太少,就是获取的细胞存活率较低(约为30%),都不能满足实验的需求。
综合相关文献报道,目前主要有胶原酶和胰蛋白酶两种消化酶,胰蛋白酶在实验室里更为常用,所以前期首先尝试应用胰蛋白酶消化法。由于不同的组织或细胞对胰酶的作用反应不一样,此外胰酶消化分散细胞的活性还与其浓度、温度和作用时间有关,在pH为8.0、温度为37 ℃胰酶溶液的作用能力最强,然而这种条件下消化后获得的细胞活性不高,很难摸索到适合的胰酶浓度和消化时间。相比较而言,胶原酶则表现出很大的优越性[13]。血管内皮功能的完整性主要依赖于细胞骨架蛋白的正常功能和细胞间连接[14],细胞间连接主要是通过特异的细胞骨架蛋白、钙黏蛋白等黏附蛋白来介导[15],而细胞骨架蛋白主要由胶原蛋白组成,胶原酶能消化溶解胶原蛋白,在一定程度上消除了细胞间的黏附连接。另外,消化液中可以与钙离子结合的乙二胺四乙酸是离子螯合剂,它可以通过与钙离子结合来影响钙黏蛋白形成,从而影响黏附连接的形成。然而在胶原酶消化后,由于层叠覆盖的原因导致一部分细胞未被胶原酶作用到,或者由于机械物理因素等导致消化后的细胞没有进入消化液中导致消化液中细胞数量偏少。所以,在消化后用刀片刮内膜面,刮时稍微用力,用力大了会混杂更多的非ECs,太轻了容易将表面的ECs碾死。将刮下来的ECs组织再次用胶原酶消化可以使第一次未被酶作用到的细胞间骨架蛋白更好地被酶溶解,从而能够分离出更多的ECs。
通过多次实验,在取了数十条犬大隐静脉后摸索了一个获取犬大隐静脉ECs的可靠方法:将无菌的大隐静脉浸泡于适量0.1%胶原酶的离心管中,将离心管置于37 ℃温箱中振荡6~7 min取出,放于盛有完培的10 cm培养皿内用刀片稍用力刮并涮洗,将涮洗液离心后,继续用0.1%胶原酶消化3 min,离心后弃上清,重悬。相比较Veronica Tisato的分离方法而言,改良方法重点在采取了刮取再消化的方法。笔者的体会:①在分离获取大隐静脉时尽量减少分离时间,结扎完所有分支后最后离断血管主干,以减少内皮缺血时间;②据文献报道大隐静脉ECs需要用专门的培养基培养,笔者则用普通完培(低糖DMEM,FBS占10%)另加入0.4%的VEGF成功将其养活并传代,降低了成本;③严格控制消化时间,减少细胞损伤;④在分离期间可以用内皮活性药物(罂粟碱)保护ECs活性。在尝试了多个学者的方法失败后,通过参考并改进Veronica Tisato的分离方法后成功地进行了犬大隐静脉ECs的原代和传代培养。此外,通过传代培养发现,犬大隐静脉ECs的增殖融合能力非常强,在传代7~8代后,仍能保持原代细胞的形态特征和增殖能力。
[1] Mathew John C,Khaddaj Mallat R,Mishra RC,et al. SKA-31,an activator of Ca2+-activated K+ channels,improves cardiovascular function in aging[J]. Pharmacol Res,2020,151:104539.
[2] Dmitrieva NI,Burg MB. Elevated sodium and dehydration stimulate inflammatory signaling in endothelial cells and promote atherosclerosis[J]. PLoS One,2015,10(6):e0128870.
[3] Balta S,Mikhailidis DP,Demirkol S,et al. Endocan:a novel inflammatory indicator in cardiovascular disease[J]. Atherosclerosis,2015,243(1):339-343.
[4] Su JB. Vascular endothlial dysfunction and pharmacological treatment[J]. World J Cardiol,2015,7(11):719-741.
[5] Chistiakov DA,Orekhov AN,Bobryshev YV. Endothelial barrier and its abnormalities in cardiovascular disease[J/OL]. Front Physiol,2015,6:365.
[6] Tisato V,Zauli G,Voltan R,et al. Endothelial cells obtained from patients affected by chronic venous disease exhibit a pro-inflammatory phenotype[J]. PLoS One,2012,7(6): e39543.
[7] Masseau I,Bowles DK. Carotid endothelial VCAM-1 is an early marker of carotid atherosclerosis and predicts coronary artery disease in swine[J]. J Biomed Sci Eng,2015,8 (11):789-796.
[8] Leiva A,Fuenzalida B,Westermeier F,et al. Role for tetrahydrobiopterin in the fetoplacental endothelial dysfunction in maternal supraphysiological hypercholesterolemia[J]. Oxid Med Cell Longev,2015,2015:5346327.
[9] Serghei C,Heike M,Klans K,et al. Construction of autologous human valve based on an acellular allograft matrix[J]. Circulation ,2002,106(12):163-168.
[10] Jaffe EA. Culture of human endothelial cells derived from umbilical veins[J]. Clin Invest,1973,(52):2754.
[11] Crampton SP,Davis J,Hughes CC.Isolation of human umbilical vein endothelial cells(HUVEC)[J]. J Vis Exp,2007,(3):183.
[12] 赵志敏,王国坤,王杨,等.胶原酶消化法、组织块贴壁法培养的大鼠RASMCs生长、增殖及分化对比观察[J].山东医药,2017,57(28):33-36.
[13] 郭吉安,余丕军,王露萍,等.比较两种酶消化法对真皮成纤维细胞的影响[J].中国组织工程研究,2018,22(8):1205-1210.
[14] 赵晓燕,张金盈,王小芳,等.高糖对体外培养人脐静脉内皮细胞通透性及肌球蛋白轻链磷酸化的影响[J].郑州大学学报(医学版),2015,50(2):198-201.
[15] Lobo MV,Alonso FJ,Redondo C,et al. Cellular characterization of epidermal growth factor-expanded free-floating neurospheres[J]. Histochem Cytochem,2003,51(1): 89-103.