妊娠期糖尿病(gestational diabetes mellitus,GDM)表现为妊娠前糖代谢或糖耐量正常,妊娠期出现糖耐量降低。近年来GDM发病率不断升高,超过15%的孕妇被诊断为GDM[1]。GDM可引起血管病变、影响母婴结局,如导致早产、胎儿宫内窘迫、流产、高血压相关疾病等。目前,GDM具体发病机制尚未完全阐明,可能与胰岛素抵抗(insulin resistance,IR)及胰岛β细胞功能受损有关[2]。早期筛查并定期随访、监测对提高GDM患者妊娠期安全,改善妊娠结局有重要意义。目前常用的糖化血红蛋白(hemoglobin A1c,HbA1c)、口服葡萄糖耐量试验(oral glucose tolerance test,OGTT)、空腹血糖(fasting plasma glucose,FPG)、餐后2 h血糖(2 h postprandial plasma glucose,2 hPG)等虽然可检测GDM患者血糖变化及糖耐量受损情况,但需多次抽血,为有创检测,不易被孕妇接受。另外,上述检测需要患者服用葡萄糖,部分患者不愿配合,阻碍其广泛应用。Visfatin是由内脏脂肪细胞分泌的肽类激素,具有促进脂肪分化及脂肪细胞成熟的作用。最新研究认为[3],Visfatin具有胰岛素样作用,可改善IR,发挥降血糖的功能。研究显示[4],GDM患者血浆Visfatin显著高于正常孕妇,且血浆Visfatin与胎儿宫内发育有关。国外研究显示[5],不同孕周的GDM患者血浆Visfatin含量存在差异。目前,不同孕周血浆Visfatin含量与GDM患者IR的关系研究的较少。本研究通过检测GDM患者不同孕周血浆Visfatin水平变化,分析其临床意义。现报告如下。
1 资料与方法
1.1 一般资料 选取2017年5月—2019年5月我院诊治孕24~26周的GDM患者40例,同期OGTT试验正常的孕24~26周孕妇40例为正常糖耐量(normal glucose tolerance,NGT)组。纳入标准:①GDM的诊断符合2015年制订的标准[6]:FPG≥5.1 mmol/L,1 hPG≥10.0 mmol/L,2 hPG≥8.5 mmol/L,任一项满足者均可诊断为GDM;②年龄20~35岁;③孕妇均为单胎自然妊娠,且既往身体健康;④GDM患者血糖的控制水平符合指南[7];餐前及餐后2 h血糖值分别≤5.3、6.7 mmol/L,特殊情况下可测餐后1 h血糖 (≤7.8 mmol/L);夜间血糖不低于3.3 mmol/L;妊娠期HbA1c宜<5.5%。⑥均知情同意,愿意配合该研究者。排除标准:①合并肿瘤者;②合并妊娠期高血压、多囊卵巢综合征等;③合并溃疡性肠炎或全身感染者;④肝肾功能不全者;⑤近期使用糖皮质激素治疗者;⑥肥胖、中心性肥胖患者。GDM组和NGT组年龄、孕前体重指数、产次等比较差异无统计学意义(P>0.05),具有可比性,见表1。
本研究经医院伦理委员会批准通过,研究对象均签署知情同意书。
表1 2组一般资料比较
Table 1 Comparison of general data between two groups![]()
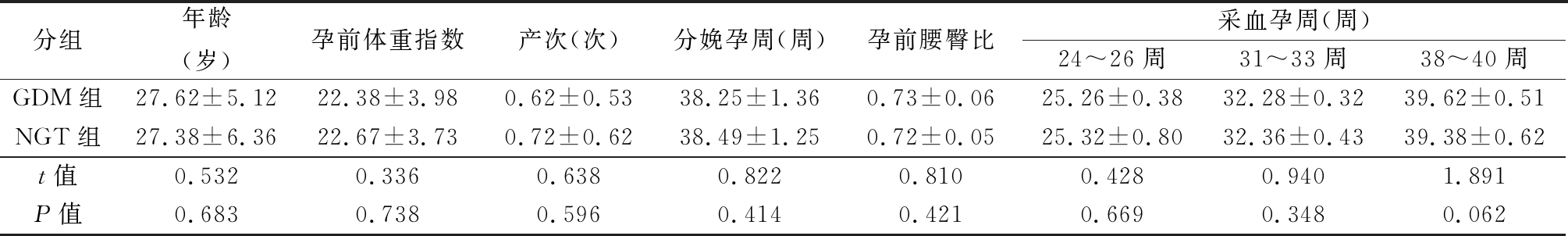
分组年龄(岁)孕前体重指数产次(次)分娩孕周(周)孕前腰臀比采血孕周(周)24~26周31~33周38~40周GDM组27.62±5.1222.38±3.980.62±0.5338.25±1.360.73±0.0625.26±0.3832.28±0.3239.62±0.51NGT组27.38±6.3622.67±3.730.72±0.6238.49±1.250.72±0.0525.32±0.8032.36±0.4339.38±0.62t值0.5320.3360.6380.8220.8100.4280.9401.891P值0.6830.7380.5960.4140.4210.6690.3480.062
1.2 方法
1.2.1 血液采集 分别于孕24~26周、31~33周、38~40周采集2组孕妇晨起空腹静脉血5 mL,加入抗凝剂抗凝后3 500 r/min离心12 min分离血浆,-20 ℃保存。
1.2.2 血浆Visfatin含量检测 采用酶联免疫吸附测定法检测2组血浆Visfatin含量,试剂盒购自美国Sigma公司,具体步骤按试剂盒说明书进行操作。根据孕24~26周血浆Visfatin含量中位数,将GDM组分为高Visfatin亚组和低Visfatin亚组各20例。
1.2.3 2组血浆FPG、HbA1c、空腹胰岛素(fasting insulin,FINS)及血脂检测 采用SE2001全自动生化分析仪(美国BD公司)检测2组血浆FPG、HbA1c、FINS、三酰甘油(triglyceride,TG)、总胆固醇(total cholesterol,TC)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)水平,并计算胰岛素抵抗指数(homeostasis model assessment insulin resistance,HOMA-IR)=FPG×FINS/22.5[7]。
1.2.4 新生儿发育状况评估 记录新生儿体质量、身长,计算新生儿ponderal指数(ponderal index,PI)=体重(g)/身长(cm)3×100[8]。
1.3 统计学方法 应用SPSS 18.0软件进行统计分析。计量资料采用独立样本t检验、单因素方差分析、SNK-q检验;Pearson相关法分析血浆Visfatin与HOMA-IR的相关性。P<0.05为差异有统计学意义。
2 结 果
2.1 GDM组与NGT组不同孕周血浆Visfatin水平比较 GDM组高Visfatin亚组、低Visfatin亚组及NGT组血浆Visfatin水平随孕周增加而升高,两两比较差异均有统计学意义(P<0.05)。GDM组高Visfatin亚组孕24~26周血浆Visfatin高于低Visfatin亚组,且低Visfatin亚组高于NGT组(P<0.05),高Visfatin亚组、低Visfatin亚组孕31~33周、38~40周血浆Visfatin与NGT组比较差异无统计学意义(P>0.05),见表2。
表2 GDM组与NGT组不同孕周血浆Visfatin水平比较
Table 2 Comparison of plasma Visfatin levels in GDM group and NGT group at different gestational weeks![]()
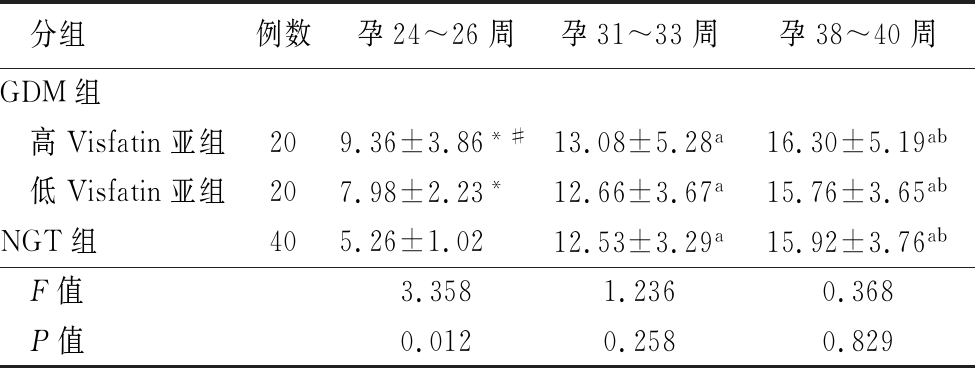
分组例数孕24~26周孕31~33周孕38~40周GDM组 高Visfatin亚组209.36±3.86*#13.08±5.28a16.30±5.19ab 低Visfatin亚组207.98±2.23*12.66±3.67a15.76±3.65abNGT组405.26±1.0212.53±3.29a15.92±3.76ab F值3.3581.2360.368 P值0.0120.2580.829
*P值<0.05与NGT组比较 #P值<0.05与低Visfatin亚组比较 aP值<0.05与孕24~26周比较 bP值<0.05与孕31~33周比较(SNK-q检验)
2.2 GDM组与NGT组孕24~26周糖代谢和脂类代谢比较 GDM组高Visfatin亚组孕24~26周FPG、HbA1c、FINS、HOMA-IR及TG、TC、LDL-C均高于低Visfatin亚组,且低Visfatin亚组高于NGT组(P<0.05),GDM组高Visfatin亚组孕24~26周血浆HDL-C低于低Visfatin亚组,且低Visfatin亚组低于NGT组,差异均有统计学意义(P<0.05)。3组孕31~33周与38~40周FPG、 HbA1c比较差异均无统计学意义(P>0.05),见表3~5。
表3 GDM组与NGT组孕24~26周糖代谢指标比较
Table 3 Comparison of gestational glucose metabolism indicators between GDM group and NGT group at 24-26 weeks of gestation![]()
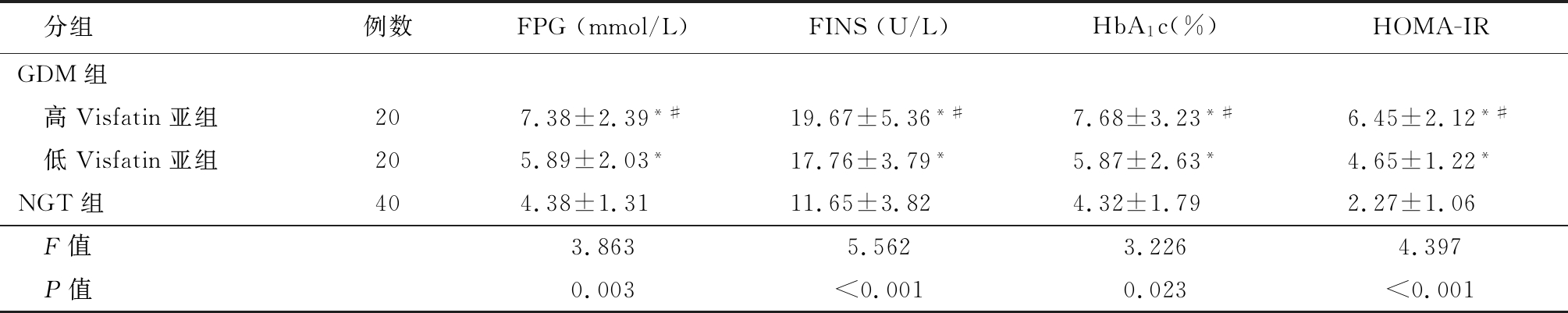
分组例数FPG(mmol/L)FINS(U/L)HbA1c(%)HOMA-IRGDM组 高Visfatin亚组207.38±2.39*#19.67±5.36*#7.68±3.23*#6.45±2.12*# 低Visfatin亚组205.89±2.03*17.76±3.79*5.87±2.63*4.65±1.22*NGT组404.38±1.3111.65±3.824.32±1.792.27±1.06 F值3.8635.5623.2264.397 P值0.003<0.0010.023<0.001
*P值<0.05与NGT组比较 #P值<0.05与低Visfatin亚组比较(SNK-q检验)
表4 GDM组与NGT组孕31~33周与38~40周FPG、 HbA1c比较
Table 4 Comparison of FPG,HbA1c between GDM group and NGT group at 24-26 weeks and 38-40 weeks of gestation ![]()
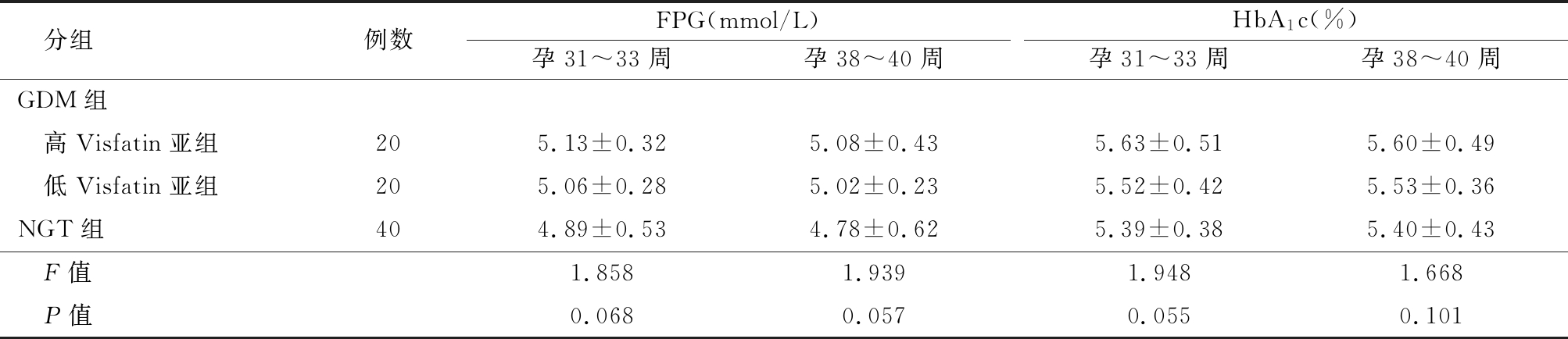
分组例数FPG(mmol/L)孕31~33周孕38~40周HbA1c(%)孕31~33周孕38~40周GDM组 高Visfatin亚组205.13±0.325.08±0.435.63±0.515.60±0.49 低Visfatin亚组205.06±0.285.02±0.235.52±0.425.53±0.36NGT组404.89±0.534.78±0.625.39±0.385.40±0.43 F值1.8581.9391.9481.668 P值0.0680.0570.0550.101
表5 GDM组与NGT组孕24~26周脂类代谢指标检测
Table 5 Detection of lipid metabolism indicators in the GDM group and the NGT group at 24-26 weeks of gestation![]()

分组例数TGTCHDL-CLDL-CGDM组 高Visfatin亚组204.56±1.22*#7.32±2.02*#1.17±0.50*#5.63±1.89*# 低Visfatin亚组203.39±1.02*5.97±2.13*1.53±0.73*3.95±1.16*NGT组402.05±0.824.18±1.231.86±0.882.30±0.87F值3.9974.5803.2523.867P值0.001<0.0010.0200.002
*P值<0.05与NGT组比较 #P值<0.05与低Visfatin亚组比较(SNK-q检验)
2.3 GDM组孕24~26周血浆Visfatin水平与HOMA-IR的相关性分析 GDM组孕24~26周血浆Visfatin与孕24~26周HOMA-IR(r=0.429,P=0.036)、31~33周HOMA-IR(r=0.568,P=0.025)、孕38~40周HOMA-IR(r=0.672,P=0.003)均呈明显正相关,见表6,图1~3。
2.4 GDM组与NGT组胎儿宫内发育状况比较 GDM组高Visfatin亚组新生儿体重、PI均高于低Visfatin亚组,且低Visfatin亚组高于NGT组,两两比较差异均有统计学意义(P<0.05),见表7。
表6 GDM组孕24~26周血浆Visfatin水平与HOMA-IR的Pearson相关性分析
Table 6 Pearson Correlation analysis between plasma Visfatin at 24-26 weeks of gestation and HOMA-IR in GDM group

变量 孕24~26周HOMA-IRr值P值孕31~33周HOMA-IRr值P值孕38~40周HOMA-IRr值P值孕24~26周Visfatin0.4290.0360.5680.0250.6720.003
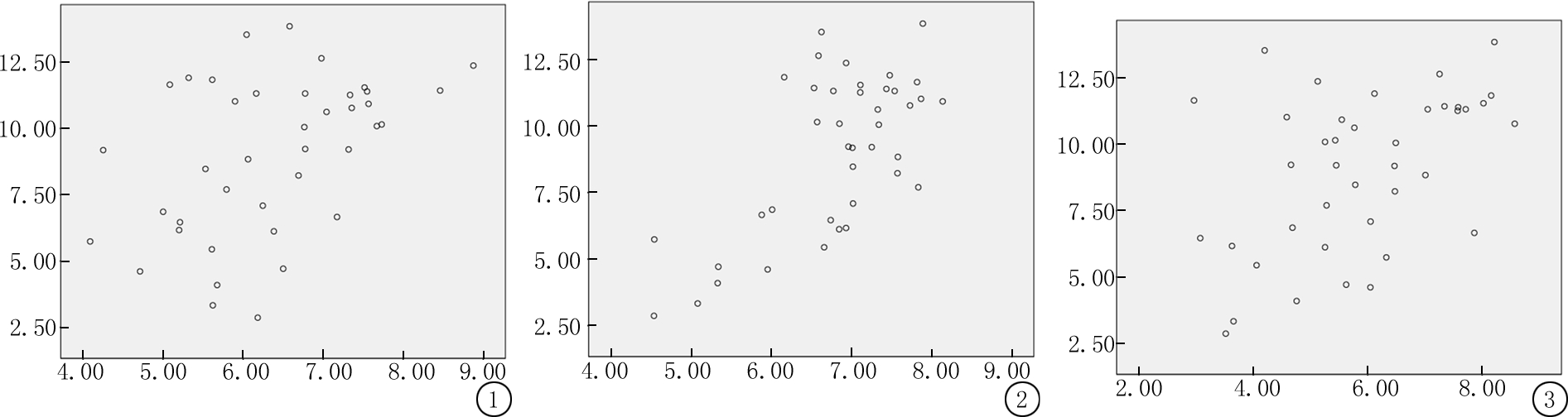
图1 孕24~26周血浆Visfatin与孕24~26周HOMA-IR相关的散点图
Figure 1 Scatter plot of plasma Visfatin at 24-26 weeks of gestation and HOMA-IR at 24-26 weeks of gestation
图2 孕24~26周血浆Visfatin与孕31~33周HOMA-IR相关的散点图
Figure 2 Scatter plot of plasma Visfatin at 24-26 weeks of gestation and HOMA-IR at 31-33 weeks of gestation
图3 孕24~26周血浆Visfatin与孕38~40周HOMA-IR相关的散点图
Figure 3 Scatter plot of plasma Visfatin at 24-26 weeks of gestation and HOMA-IR at 38-40 weeks of gestation
表7 GDM组与NGT组胎儿宫内发育状况比较
Table 7 Comparison of fetal intrauterine development status between GDM group and NGT group![]()
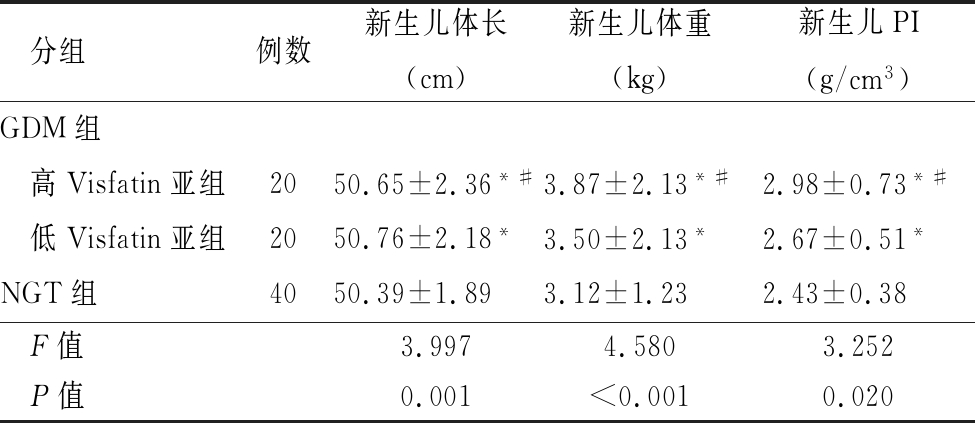
分组例数新生儿体长(cm)新生儿体重(kg)新生儿PI(g/cm3)GDM组 高Visfatin亚组2050.65±2.36*#3.87±2.13*#2.98±0.73*# 低Visfatin亚组2050.76±2.18*3.50±2.13*2.67±0.51*NGT组4050.39±1.893.12±1.232.43±0.38F值3.9974.5803.252P值0.001<0.0010.020
*P值<0.05与NGT组比较 #P值<0.05与低Visfatin亚组比较(SNK-q检验)
3 讨 论
GDM可影响母婴妊娠结局,因此早期有针对性干预对改善母体及新生儿远期预后有重要意义。目前,IR及胰岛β细胞功能低下在GDM发生中的作用已得到公认。肥胖尤其腹型肥胖是引起IR的重要因素。GDM与肥胖均存在脂类代谢紊乱、糖耐量受损等病理基础,而此过程与脂肪细胞因子的分泌密切相关。Visfatin属于脂肪细胞因子家族,可促进脂肪聚集、通过自分泌和旁分泌促进脂肪细胞成熟,促进葡萄糖转运和脂质聚积,是调节机体物质转运和能量代谢的重要因子,因此血浆一定量的Visfatin对人体生长发育和营养的维持有重要作用。康瑛等[9]对妊娠期女性血浆Visfatin进行监测发现,血浆Visfatin水平在不同孕期中出现波动,随着孕周增加,其含量呈增加趋势。可能的原因是随着妊娠程度的增加,机体各种组织对胰岛素的敏感性降低,Visfatin具有胰岛素样作用,为了保证孕期母体及胎儿的营养供应,通过升高Visfatin水平来增强胰岛素的作用[10]。本研究NGT组随着孕周增加血浆Visfatin水平而升高,与文献[9]报道相符。
血浆Visfatin与GDM发病的相关性尚未阐明。李丽等[4]对100例GDM患者和100例正常妊娠孕妇血浆Visfatin检测可知,GDM患者血浆Visfatin明显高于正常妊娠孕妇。付颖等[11]研究表明,GDM患者血浆、脐血及胎盘组织Visfatin水平均高于糖耐量正常孕妇,且其含量可影响胎儿宫内发育。国外文献报道[5],随GDM患者孕周增加,血浆Visfatin含量逐渐增高,且在孕晚期达到最高。本研究发现,GDM组高Visfatin亚组、低Visfatin亚组及NGT组血浆Visfatin水平均随孕周增加而升高,但仅孕24~26周血浆Visfatin水平在各组间存在差异,3组孕31~33周、38~40周血浆Visfatin比较差异无统计学意义,与文献报道相符[12]。原因如下:①虽然正常孕妇也可出现IR,但在GDM患者中IR程度更严重,导致血糖明显升高,在此应激环境下,机体为了保证正常的物质代谢,代偿性上调血浆Visfatin,这可能是GDM患者孕24~26周血浆Visfatin高于NGT组的原因,且增高的浆Visfatin并不足以完全抵消IR,因此出现高血浆Visfatin与IR并存;②随着妊娠进展,胎儿附属物也可分泌Visfatin,导致其血浆含量升高,且妊娠晚期不规则宫缩可刺激羊膜分泌Visfatin,综合原因造成NGT孕妇与GDM孕妇无明显差异。
GDM患者呈现明显的糖耐量减低以及脂肪代谢紊乱,糖代谢异常主要表现为FPG升高以及FINS代偿性增高;脂类代谢紊乱体现为TG升高、HDL-C降低。本研究GDM组高Visfatin亚组孕24~26周FPG、HbA1c、FINS、HOMA-IR及TG、TC、LDL-C均高于低Visfatin亚组,且低Visfatin亚组高于NGT组,GDM组高Visfatin亚组孕24~26周血浆HDL-C低于低Visfatin亚组,且低Visfatin亚组低于NGT组,符合GDM患者糖类和脂类代谢紊乱的表现,且Visfatin含量越高脂类代谢紊乱越明显,与文献报道相符[13]。动物实验证实,Visfatin可通过诱导肝脏胰岛素受体的酪氨酸磷酸化,导致大量TG在大鼠脂肪细胞聚积,引起大鼠肥胖[14];而肥胖可降低蛋白酪氨酸磷酸酶活性,导致胰岛素受体去磷酸化,以致激活胰岛素的信号通路受抑制,引起IR。烟酰胺腺嘌呤二核苷酸可促进脂联素活性,增强组织器官对胰岛素的敏感性,而Visfatin是烟酰胺腺嘌呤二核苷酸合成的限速酶,可通过烟酰胺腺嘌呤二核苷酸影响IR。目前,在小鼠细胞模型[15]及肥胖[16]患者中,观察到血浆Visfatin与胰岛素敏感性有关。文献报道,血浆Visfatin升高可影响糖类脂类代谢,且与IR呈正相关[12,17]。本研究结果显示,GDM组孕24~26周血浆Visfatin与孕24~26周、31~33周、38~40周HOMA-IR均呈明显正相关。可能是由于在高血糖的影响下,母体各种靶组织逐渐出现生物合成失调、功能受损,孕24~26周可反映组织损伤程度。
葡萄糖不仅是母体各种代谢的营养来源,且葡萄糖可通过胎盘屏障,为胎儿生长发育提供营养。GDM影响糖类代谢,因此可影响胎儿在宫内的发育。文献报道,GDM可增加早产儿、巨大儿、胎儿先天性畸形发生率[18]。血浆Visfatin水平升高能引起胎盘组织和脐血Visfatin水平增加,且其含量与血浆中相当,呈明显正相关。谭琴等[12]研究发现,GDM患者血浆和脐血Visfatin含量均升高,且可引起胎儿肥胖。本研究发现,GDM组高Visfatin亚组新生儿体质量、PI均高于低Visfatin亚组,且低Visfatin亚组高于NGT组,可能是由于GDM患者血浆高Visfatin引起胎盘组织Visfatin升高,Visfatin可通过脂联素等多种途径促进糖类转运和脂质代谢,导致胎儿体质量增加及PI升高,进一步导致巨大儿、及难产发生[9,19]。
血浆Visfatin含量随孕周增加而升高,GDM患者孕24~26周血浆Visfatin含量高于NGT孕妇;孕24~26周Visfatin与GDM患者糖类和脂质代谢紊乱有关,并促进胎儿宫内发育。检测孕24~26周血浆Visfatin有助于GDM患者糖类及脂质代谢紊乱及病情严重程度的评估。本研究不足:样本量较小,且为单中心研究;未进行多因素分析。因此,孕24~26周血浆Visfatin对GDM患者妊娠结局的影响,确切结论需大样本量、多中心研究证实。
[1] 郭广丽,李晓慧,周钦,等.2015-2017年河北省妊娠期糖尿病患病率及危险因素分析[J].实用医学杂志,2019,35(18):2844-2847.
[2] 彭敏,张娜.对妊娠期糖尿病的影响因素与妊娠结局分析[J].公共卫生与预防医学,2017,28(1):138-140.
[3] Zhang W,Zhao D,Meng Z,et al. Association between circulating visfatin and gestational diabetes mellitus:a systematic review and meta-analysis[J]. Acta Diabetol,2018,55(11):1113-1120.
[4] 李丽,张艳赏,霍琰,等.妊娠期糖尿病患者内脂素、脂联素、AFABP的变化及与胰岛素抵抗的关系[J].四川医学,2019,40(5):471-474.
[5] Souvannavong-Vilivong X,Sitticharoon C,Klinjampa R,et al. Placental expressions and serum levels of adiponectin,visfatin,and omentin in GDM[J]. Acta Diabetologica,2019,56(10):1121-1131.
[6] 魏小辉,王育璠.2015年国际妇产科联盟(FIGO)妊娠期糖尿病诊疗指南解读[J].中华内分泌代谢杂志,2016,32(11):895-899.
[7] 中华医学会妇产科学分会产科学组,中华医学会围产医学分会妊娠合并糖尿病协作组.妊娠合并糖尿病诊治指南(2014) [J] .中华围产医学杂志,2014,17(8):537-545.
[8] 朱荔,丘红梅,周晓芳,等.血清CA19-9水平与2型糖尿病患者糖脂代谢的相关性[J].昆明医科大学学报,2018,39(11):83-86.
[9] 康瑛,续靖宁.妊娠期糖尿病孕妇血内脂素的变化及其对新生儿体重的影响[J].陕西医学杂志,2017,46(10):1402-1404.
[10] Abdelwahed OM,Tork OM,Gamal E Din MM,et al. Effect of glucagon-like peptide-1 analogue; Exendin-4,on cognitive functions in type 2 diabetes mellitus; possible modulation of brain derived neurotrophic factor and brain Visfatin[J]. Brain Res Bull,2018,139:67-80.
[11] 付颖,吴南楠,马唯.内脏脂肪素在妊娠期糖尿病患者血清、胎盘组织及脐血中的表达及其临床意义[J].中国糖尿病杂志,2016,24(5):431-434.
[12] 谭琴,曾丽萍.妊娠期糖尿病患者血清及脐血内脏脂肪素含量检测与母体糖脂代谢和胎儿宫内发育的相关性[J].中国妇幼保健,2017,32(7):1435-1438.
[13] 刘真真,刘金波,刘传谦,等.2型糖尿病微血管病变患者血浆内脂素水平变化及意义[J].山东医药,2018,32(14):16-19.
[14] Oncul M,Tuten A,Erman H,et al. Maternal and cord blood apelin,resistin and visfatin levels in gestational diabetes mellitus[J]. Minerva Med,2013,104(5):527-535.
[15] 廖鑫,邓凡曲,杨丹,等.内脂素对大鼠成肌细胞PI3K/Akt信号通路及胰岛素敏感性影响的研究[J].中国糖尿病杂志,2019,27(9):677-681.
[16] 王小凤,王瑞英,杨建国,等.血清脂联素、内脂素水平与高血压伴肥胖患者胰岛素抵抗的关系[J].河北医科大学学报,2013,34(12):1588-1591.
[17] 唐文婷,喻谦.2型糖尿病视网膜病变患者内脂素水平与代谢综合征的关系探讨[J].实用医院临床杂志,2018,15(3):149-151.
[18] Mitanchez D,Burguet A,Simeoni U. Infants born to mothers with gestational diabetes mellitus:mild neonatal effects,a long-term threat to global health[J]. J Pediatr,2014,164(3):445-450.
[19] Yalinbas E,Binay C,Simsek E,et al. the role of umbilical cord blood concentration of igf-i,igf-ii,leptin,adiponectin,ghrelin,resistin,and visfatin in fetal growth[J]. Am J Perinatol,2019,36(6):600-608.