肺炎是儿科常见呼吸系统疾病,具有高发病率、病情易反复发作等特点,临床主要表现为咳嗽、发热,肺部可闻及细湿性啰音[1]。在儿童肺炎的治疗上,常规静脉给予抗生素与外用雾化药物治疗效果确切,但部分患儿由于免疫力差或细菌耐药等导致常规治疗效果并不理想,进而引起病情迁延,并可能发展为慢性肺炎[2]。儿童慢性肺炎病程长,其特点主要为周期性反复与恶化,并易引起其他并发症,累及循环、消化等重要系统,乃至发展为肺源性心脏病,严重影响患儿预后。近年来,随着纤维支气管镜技术的不断发展,纤维支气管镜检查(fiberoptic bronchoscopy,BFS)与支气管肺泡灌洗术(bronchoalveolar lavage,BAL)被广泛应用于临床,在小儿难治性肺炎、迁延性肺炎的治疗中取得了满意效果[3-4]。为进一步探讨其在儿童慢性肺炎中的应用价值,本研究对慢性肺炎患儿在常规治疗基础上应用BFS行BAL治疗,并与单纯常规治疗的患儿进行比较。现报告如下。
1 资料与方法
1.1 一般资料 选取2016年5月—2019年2月我院收治的慢性肺炎患儿136例,将采用常规治疗的68例患儿设为对照组,常规治疗基础上运用BFS行BAL治疗的68例患儿设为观察组。观察组男性42例,女性26例;年龄6~14岁,平均(9.82±2.25)岁;合并胸腔积液19例,肺不张11例。对照组男性38例,女性30例;年龄6~14岁,平均(9.53±2.38)岁;合并胸腔积液16例,肺不张10例。2组性别、年龄、合并症差异无统计学意义(P>0.05),具有可比性。
本研究经医院医学伦理委员会批准通过。
1.2 诊断标准 所有患儿符合诸福棠实用儿科学第8版肺炎诊断标准[5]。实用儿科学将慢性肺炎定义为病程超过3个月。包含以下表现形式:①发热、咳嗽、咳痰和肺部实变超过3个月,也称慢性化脓性肺疾病;②发热、咳嗽、咳痰反复,同时肺部实变此起彼伏,一个部位的肺部实变尚未完全消失时,另一部位又出现新的病变,视为连续慢性过程;③发热、咳嗽、咳痰控制(呼吸道症状不明显)但肺部阴影持续不能吸收。
1.3 纳入标准与排除标准 纳入标准:①符合儿童慢性肺炎的诊断标准;②患儿家长知情同意,并签署知情同意书。排除标准:①合并严重心、肝、肾等重要脏器功能障碍;②合并其他肺部疾病,如肺结核、肺含铁血黄素等;③合并凝血功能障碍,或有出血倾向;④生命体征不稳定,伴多脏器功能衰竭;⑤一般状况差,无法进行BFS;⑥急性上呼吸道感染或合并其他部位感染;⑦近1周内出现大咯血;⑧合并自身免疫性疾病或免疫缺陷。
1.4 方法 2组患儿Ⅱ型呼吸衰竭诊断动脉血氧分压(partial pressure of oxygen,PaO2)<60 mmHg(1 mmHg=0.133 kPa)、二氧化碳分压(partial pressure of carbon dioxide,PaCO2)>50 mmHg予以无创呼吸机辅助治疗,并采取常规治疗方案:包括静脉应用抗生素,止咳化痰药物等。观察组在此基础上应用BFS行BAL治疗,术前6 h禁食水,术前30 min肌肉注射阿托品0.02 mg/kg。咪达唑仑静脉麻醉与利多卡因气管内局部麻醉,常规心电监护,监测经皮血氧饱和度(Percutaneous oxygen saturation,SpO2),鼻导管吸氧,氧流量为1~3 L/min,观察患儿面色、循环、心率、呼吸等情况。根据患儿年龄及体重选择日本Olympus公司产的BF-3C40或BF-XP60型号纤维支气管镜。纤维支气管镜经鼻、会厌部进入气管及支气管各段,观察病变情况,37 ℃温生理盐水分段灌洗,时间控制在10 min以内,对炎症较重、分泌物较多的部分重点进行灌洗,灌洗液总量控制在3~5 mL/kg。将灌洗所得支气管肺泡灌洗液送病原学检查,对于明确病原学诊断的患儿,灌洗结束后于感染段支气管内注入经稀释的敏感抗生素5~10 mL。灌洗时若发生黏膜出血,局部注入1∶10 000肾上腺素;若呼吸道存在大量脓性分泌物,局部应用乙酰半胱氨酸、抗生素等;肺不张者给予温生理盐水反复灌洗至灌洗液清亮,再以生理盐水加敏感抗生素冲洗病变肺叶,冲洗3~5次。退镜,吸尽口咽部分泌物,雾化吸入布地奈德1.0 mg+生理盐水2.0 mL。术后禁食水2 h。2组均在治疗7 d后评定疗效。
1.5 观察指标
1.5.1 症状体征消失时间 比较2组患儿发热、咳嗽及肺部湿啰音、哮鸣音消失时间。
1.5.2 血气分析 于治疗前、治疗7 d后采集动脉血2 mL,采用血气分析仪测定动脉血气指标,包括PaO2、PaCO2和酸碱度(power of hydrogen,pH)值。
1.5.3 血清炎症因子测定 采集空腹静脉血3 mL,3 000 r/min离心10 min,留取血清标本后-80 ℃保存待测。采用酶联免疫法分析血清中白细胞介素6(interleukin-6,IL-6)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)水平。
1.5.4 观察组并发症监测 详细记录由BFS、BAL引起的并发症发生情况。
1.6 疗效判定标准[6] 显效:咳嗽、咳痰、肺部啰音等症状体征消失,体温正常,外周血白细胞计数(white blood cell count,WBC)正常,肺部CT显示炎症基本吸收或大部分吸收,肺不张复张;有效:咳嗽、咳痰、肺部啰音等症状体征较治疗前好转,体温正常,外周血WBC降低,肺部CT显示炎症部分吸收,肺不张部分复张;无效:症状及体征、体温、外周血WBC、胸部CT等无改善,或病情加重。总有效率=(显效+有效)例数/总例数×100%。
1.7 统计学方法 应用SPSS 20.0统计软件处理数据。计数资料比较采用χ2检验,计量资料比较采用独立样本的t检验和配对t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 观察组BFS结果 观察组68例患儿镜下均有不同程度的支气管内膜炎症,表现为黏膜充血水肿,伴黏稠分泌物。其中52例患儿存在气道黏膜损伤,包括滤泡形成、气道黏膜皱褶、坏死脱落等。68例患儿中气道发育异常11例,其中气管软化10例,异常分支1例。
2.2 肺泡灌洗液病原检测结果 观察组68例患儿均进行了痰培养与灌洗液细菌培养。其中痰培养结果显示,痰培养阳性15例,阳性率为22.06%,其中肺炎克雷伯菌5例,铜绿假单胞菌4例,肺炎链球菌3例,金黄色葡萄球菌2例,大肠杆菌1例。肺泡灌洗液细菌培养结果示,肺泡灌洗液培养结果阳性46例,阳性率为67.65%,其中肺炎克雷伯菌7例,铜绿假单胞菌10例,肺炎链球菌10例,大肠杆菌3例,金黄色葡萄球菌9例,表皮葡萄球菌4例,白色念珠菌3例。肺泡灌洗液细菌培养阳性率显著高于痰培养(χ2=28.567,P<0.001)。
2.3 2组临床疗效比较 观察组68例患儿累计支气管肺泡灌洗治疗77次,其中9例支气管肺泡灌洗2次,59例灌洗1次。11例合并肺不张患儿,完全复张10例;19例合并胸腔积液的患儿,胸腔积液均吸收。对照组10例合并肺不张的患儿,完全复张4例;16例合并胸腔积液的患儿,11例完全吸收。观察组总有效率高于对照组,差异有统计学意义(P<0.05)。见表1。
表1 2组临床疗效比较
Table 1 Comparison of clinical efficacy between two groups (n=68,例数)
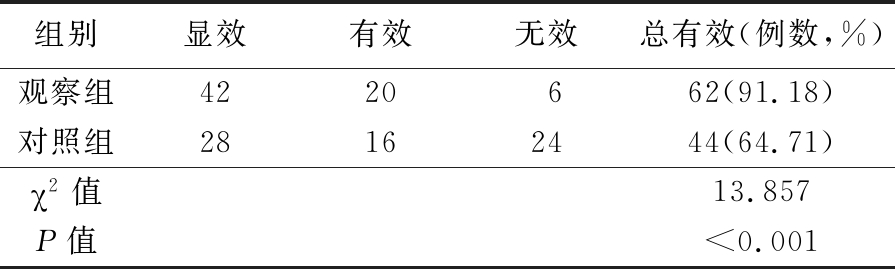
组别显效有效无效总有效(例数,%)观察组4220662(91.18)对照组28162444(64.71)χ2值13.857P值<0.001
2.4 2组主要症状体征消失时间比较 观察组发热、咳嗽、肺部湿啰音、哮鸣音消失时间均显著短于对照组,差异有统计学意义(P<0.05)。见表2。
2.5 2组治疗前后血气指标比较 治疗前,2组PaO2、PaCO2、pH值差异无统计学意义(P>0.05);治疗后,观察组PaO2、pH值明显高于治疗前,PaCO2明显低于治疗前,观察组PaO2、pH值明显高于对照组,PaCO2明显低于对照组,差异有统计学意义(P<0.05);对照组治疗前后PaO2、PaCO2、pH值差异无统计学意义(P>0.05)。见表3。
2.6 2组治疗前后血清炎症因子水平比较 治疗前,2组血清IL-6、TNF-α水平差异无统计学意义(P>0.05);治疗后,2组血清IL-6、TNF-α水平均低于治疗前,观察组血清IL-6、TNF-α水平低于对照组,差异有统计学意义(P<0.05)。见表4。
表2 2组主要症状体征消失时间比较
Table 2 Comparison of disappearance time of main symptoms and signs between two groups![]()

组别发热咳嗽肺部湿啰音肺部哮鸣音观察组3.04±0.473.92±0.583.63±0.723.38±0.55对照组5.52±1.237.12±1.176.82±1.347.04±1.07t值15.53120.20717.29325.087P值<0.001<0.001<0.001<0.001
表3 2组血气指标比较
Table 3 Comparison of blood gas indicators between two groups![]()
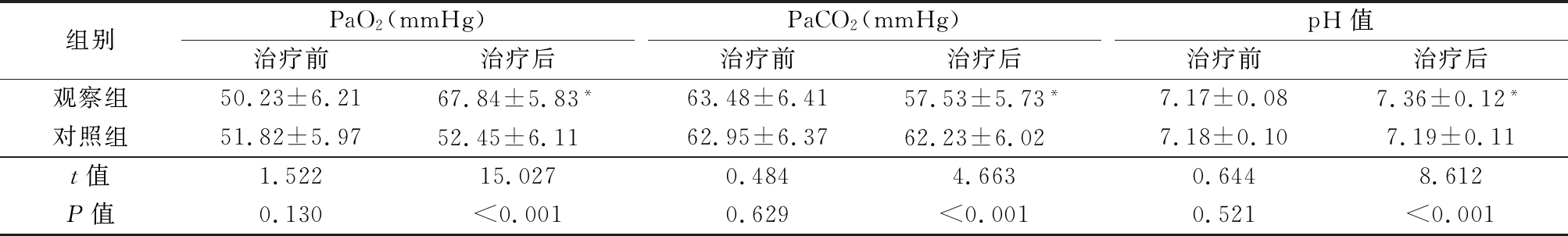
组别PaO2(mmHg)治疗前治疗后PaCO2(mmHg)治疗前治疗后pH值治疗前治疗后观察组50.23±6.2167.84±5.83*63.48±6.4157.53±5.73*7.17±0.087.36±0.12*对照组51.82±5.9752.45±6.11 62.95±6.3762.23±6.02 7.18±0.107.19±0.11t值1.52215.0270.4844.6630.6448.612P值0.130<0.0010.629<0.0010.521<0.001
*P值<0.05与治疗前比较(配对t检验)
表4 2组血清炎症因子水平比较
Table 4 Comparison of serum inflammatory factor levels between two groups![]()
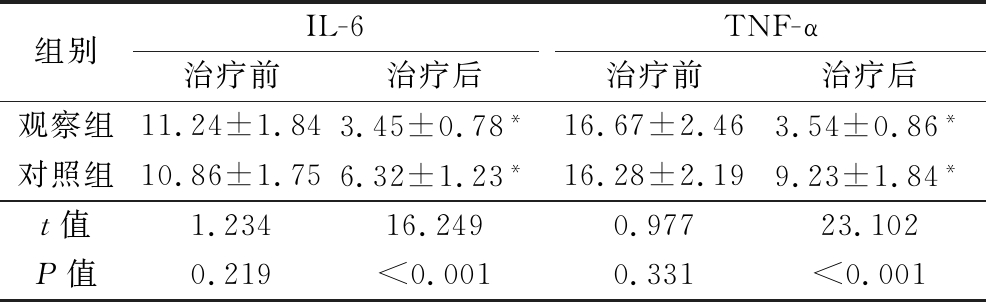
组别IL-6治疗前治疗后TNF-α治疗前治疗后观察组11.24±1.843.45±0.78*16.67±2.463.54±0.86*对照组10.86±1.756.32±1.23*16.28±2.199.23±1.84*t值1.23416.2490.97723.102P值0.219<0.0010.331<0.001
*P值<0.05与治疗前比较(配对t检验)
2.7 观察组术后并发症情况 观察组68例患儿治疗过程中出现SpO2降低4例,表现为口唇及面部发绀,撤出支气管镜并给予面罩吸氧后恢复正常。6例支气管黏膜出血,但出血量均较小,局部注入1∶10 000肾上腺素后出血停止。术后出现低热12例,咳嗽加重9例,次日缓解,未见其他严重并发症。
3 讨 论
随着医疗技术的不断发展,支气管镜视野更广,管径越来越细,儿童在使用纤维支气管镜诊治时,可根据其体格选择合适直径的纤维支气管镜。纤维支气管镜在儿童呼吸道疾病的诊治中能清楚的观察黏膜病变、管腔形态、管壁运动、分泌物、赘生物、出血、异物等情况[7]。本研究观察组患儿经BFS发现,所有患儿均有不同程度的支气管内膜炎症,且其中气道发育异常11例,气道发育异常不利于痰液排出,可使病情迁延,发展为慢性肺炎。气道发育异常的原因主要是气管软化,气管软化无法经胸部CT检查出,支气管镜直视来观察气道结构以及动态变化情况,一直以来被认为是诊断气管软化的“金标准”[8]。部分抗生素治疗效果欠佳的慢性肺炎患儿,可能是因气管异物所致,而纤维支气管镜是诊断小儿气道异物的金标准,对于无法靠胸部X线片与透视排除的异物,往往经BFS检查出。
导致儿童肺炎迁延不愈的常见原因是病原菌不明,因此无法针对性地给予敏感性抗生素治疗,长期大量使用广谱抗生素易引起耐药,导致病情迁延不愈[9],而在明确病原菌基础上,治疗效果显著。王志坤等[10]在阿奇霉素序贯治疗基础上,加用特布他林辅助治疗儿童肺炎支原体肺炎,取得了较好的临床疗效。随着分子生物学的发展,血清学结合分子生物学更有助于儿童肺炎病原菌的检测。本研究观察组患儿经肺泡灌洗液病原检测结果显示,肺泡灌洗液培养结果阳性46例,阳性率为67.65%,与痰培养阳性率22.06%相比显著升高。其原因主要是肺泡灌洗能获取大量肺泡表面衬液,且由于采集范围广,能达到远端肺实质,因此相对于痰培养能更为有效地获取肺部病原菌[11]。从灌洗液病原菌培养中可以发现,阳性菌株中以肺炎克雷伯菌、肺炎链球菌、铜绿假单胞菌等条件致病菌居多,且检测出了真菌,考虑其原因主要是儿童慢性肺炎病程长,抗生素使用时间长,更换的种类也较多,因此可引起条件致病菌、真菌、耐药菌群等混合感染。通过对纤维支气管镜肺泡灌洗术中获取的灌洗液进行病原菌培养,根据培养结果选择敏感的抗生素进行治疗,有助于提高临床治疗效果。痰培养不仅病原菌检出率低,且易受到口咽部正常寄生菌污染,导致病原菌诊断不明,而支气管镜灌洗术中获取的分泌物可在相对无菌的条件下获取,因此培养结果准确性相对更高。
在儿童慢性肺炎的治疗上,由于患儿病程长,脓性分泌物较多,排出不畅,使得药物无法在病灶处达到有效的杀菌浓度,从而导致常规治疗方法疗效欠佳。本研究对照组患儿在接受常规治疗后,总有效率为64.71%。BAL则开辟了一条新的治疗途径,本研究观察组患儿治疗总有效率为91.18%,显著高于对照组。纤维支气管镜不仅能对病变部位进行观察,明确病变性质与炎症程度,且能于纤维支气管镜直视下通过吸引、灌洗等方法彻底清除病灶处炎性分泌物与痰栓,使支气管与肺泡通气得以恢复,短时间内即可改善炎症及痰栓阻塞导致的肺不张[12]。灌洗时采用37 ℃温生理盐水对局部气道黏膜刺激小,能有效增强咳嗽反射,改善肺通气功能,且不会造成剧烈咳嗽与肺气肿。本研究结果显示,治疗后,观察组PaO2、PaCO2、pH值均较治疗前有显著改善,对照组治疗前后则无明显改善。其原因可能为BAL能有效清除病灶部位炎性分泌物与痰栓,进而促进肺通气及换气功能的改善,改善血气分析。
BAL中灌流液的冲洗可将支气管肺泡内潴留的炎性物质、致病菌、脓性分泌物引流出来,加快肺部感染的控制,缓解感染引起的毒性反应[13]。此外,BAL还能局部用药,直接于病灶处注入稀释痰液的药物与敏感抗生素,能增加病灶部位药物浓度,因而能取得较好的临床疗效,且局部用药还能避免由于全身大量给药引起的药物不良反应[14]。目前,吸痰、全身应用抗菌药物仍是重症肺部炎症的常规内科治疗措施,但小儿气道内分泌物不容易完全清除,且全身给药使局部病灶无法获得有效的血药浓度,感染难以有效控制,患儿疗效欠佳,且长期、大量应用抗菌药物治疗易产生耐药菌株、出现不良反应,这是临床中存在的常见问题,指南或者药品说明书较少表明可局部应用,但在临床实践中常会根据实际情况用药,特别是针对呼吸系统疾病根据儿童社区获得性肺炎诊疗规范[15],在保证临床治疗安全、有效的情况下,进行抗生素治疗需要依据抗生素药代动力学、药效学及不良反应等综合考量后予以应用[16]。本研究结果显示,观察组患儿发热、咳嗽、肺部湿啰音、哮鸣音消失时间均显著短于对照组;治疗后,2组患儿血清IL-6、TNF-α水平均较治疗前有明显降低,但均以观察组降低程度更明显。提示,BAL相对于常规治疗能更有效地促进慢性肺炎患儿机体炎症反应的缓解,其原因主要是BAL能通过局部给药提高病灶部位药物浓度,进而促进缓解病灶部位炎症反应,加快炎症吸收[17]。周立等[18]的研究证实,支气管镜下肺泡灌洗能显著降低难治性肺炎患者血清炎症介质水平,并能有效改善肺功能。
综上所述,应用BFS行BAL治疗能有效明确儿童慢性肺炎病因及病原体,与常规治疗比较,BAL的疗效更为确切,血气分析、机体炎症反应的改善效果更显著,炎症吸收快,症状缓解快,且安全性较高,值得临床推广应用。
[1] 赵军凤,钱林学,贵玉,等.小儿肺炎诊断及随访超声图像分析[J].中国医学装备,2018,15(11):21-24.
[2] Dean P,Florin TA. Factors associated with pneumonia severity in children:a systematic review [J]. J Pediatric Infect Dis Soc,2018,7(4):323-334.
[3] Elbahlawan LM,Avent Y,Montoya L,et al. Safety and benefits of bronchoalveolar lavage and lung biopsy in the management of pulmonary infiltrates in children with leukemia [J]. J Pediatr Hematol Oncol,2016,38(8):597-601.
[4] Rizik S,Hakim F,Bentur L,et al. Bronchoscopy and bronchoalveolar lavage in the diagnosis and management of pulmonary infections in immunocompromised children [J]. J Pediat Hematol Onc,2018,40(7):532-535.
[5] 胡亚美,江载芳.诸福棠实用儿科学[M].7版.北京:人民卫生出版社,2008:1171.
[6] 陈灏洙.实用内科学[M].11版.北京:人民卫生出版社,2001:310.
[7] Castillo CG,Kauffman CA,Zhai J,et al. Testing the performance of a prototype lateral flow device using bronchoalveolar lavage fluid for the diagnosis of invasive pulmonary aspergillosis in high-risk patients [J]. Mycoses,2018,61(1):4-10.
[8] 张渊博,苏苗赏,李昌崇.儿童气管支气管软化症的临床研究进展[J].国际呼吸杂志,2016,36(20):1596-1598.
[9] 李银,谢晓虹,任洛,等.儿童迁延性细菌性支气管炎30例临床特征及随访分析[J].中华实用儿科临床杂志,2017,32(16):1231-1234.
[10] 王志坤,王建忠,李彤,等.特布他林联合阿奇霉素序贯治疗儿童肺炎支原体肺炎的临床研究[J].河北医科大学学报,2019,40(7):820-824.
[11] 中华医学会呼吸病学分会.肺部感染性疾病支气管肺泡灌洗病原体检测中国专家共识(2017年版)[J].中华结核和呼吸杂志,2017,40(8):578-583.
[12] Escribano AM,García JDL,Villa JA,et al. Bacteria from bronchoalveolar lavage fluid from children with suspected chronic lower respiratory tract infection:results from a multi-center,cross-sectional study in Spain[J]. Eur J Pediatr,2018,177(2):181-192.
[13] Tsai CM,Wong KS,Lee WJ,et al. Diagnostic value of bronchoalveolar lavage in children with nonresponding community-acquired pneumonia[J]. Pediatr Neonatol,2017,58(5):430-436.
[14] 刘波,陈栏心.纤维支气管镜下支气管肺泡灌洗联合局部注药治疗重症肺炎的Meta分析[J].广西医学,2018,40(3):314-318.
[15] 中华人民共和国国家健康委员会,国家中医药局.儿童社区获得性肺炎诊疗规范(2019年版)[J].中华临床感染病杂志,2019,12(1):6-13.
[16] 周刚,谢红波,许锦姬,等.纤支镜肺泡灌洗联合抗生素治疗儿童重症肺炎的临床效果观察[J].临床医学工程,2019,26(3):295-296.
[17] 陈勇,谭经福,廖振辉,等.纤维支气管镜肺泡灌洗联合依替米星局部给药治疗支气管扩张并感染的临床疗效[J].疑难病杂志,2018,17(2):133-136.
[18] 周立,程旭东,严蕊娜,等.支气管镜下肺泡灌洗对难治性肺炎患者炎症介质和肺功能的影响[J].现代生物医学进展,2017,17(23):4549-4551.