胎肺不成熟目前仍然是早产儿发病和死亡的最常见原因[1-2]。孕周虽然是肺部成熟的最佳预测指标,但呼吸窘迫综合征(neonatal respiratory distress syndrome,NRDS)的发生不仅限于早产儿[3]。早产(妊娠30~36周)和早期足月产(妊娠37~38+6周)新生儿的呼吸系统疾病发生率比妊娠39周或以后的新生儿高得多[4]。识别胎儿肺部不成熟或发育不全对引起出生后呼吸系统疾病的风险非常重要。目前临床上对于<35周在7 d内有早产风险的孕妇常规使用糖皮质激素促进胎发育肺成熟治疗[5]。继续妊娠或延迟分娩取决于能否正确评估胎儿肺成熟度和胎儿是否存在肺部发育不全。目前最常用的方法是通过羊膜腔穿刺术检测羊水成分,评估板状细胞计数卵磷脂-鞘磷脂的比例及是否存在磷脂酰甘油,间接评估胎肺成熟度。尽管与妊娠中期羊膜腔穿刺术相比风险较低,但已报道了胎儿损伤、早产、胎盘早剥、产后败血症、胎儿心率异常和胎儿-母体出血等并发症[6],阳性预测性能有限,加上侵入性手术的风险,限制了使用[7]。非侵入性超声方法预测胎肺成熟度具有重要的临床应用价值,目前可以使用计算机软件分析胎儿肺部超声图像,有灰阶测量[8]、肺组织运动[9]、胎儿肺与胎盘或肝组织图像特征之间的关系[10],还有些研究依赖于与胎儿肺成熟度的间接关联,包括胎盘分级、骨化中心的测量和超声测量胎儿主肺动脉血流搏动指数和阻力指数[11-13]。有学者提出了对胎儿肺进行定量超声纹理分析作为预测胎儿肺成熟度、胎儿肺发育不全和新生儿呼吸系统疾病的一种有研究前景的无创方法[14]。此技术使用标准的胎儿肺图像,由超声医师在常规超声检查中进行,应用肺部组织特征的定量处理方法从这些图像中提取临床所需信息。QuantusFLM是一种定制开发的软件,可以从医学图像中提取信息并量化人眼不可见的组织变化,预测临床事件。该方法可以在随机场所用来估计纹理特征,结合图像纹理和计算机算法预测临床信息,但截止目前,此种新的分析法预测新生儿呼吸系统疾病风险的可行性仍在探讨中。纹理分析可应用于胎儿肺部超声图像,并与胎龄[14]和羊水的胎儿肺成熟度测试的结果相关联。本研究旨在探讨QuantusFLM预测新生儿呼吸系统疾病发生的临床可行性。报告如下。
1 资料与方法
1.1 一般资料 选择2018年12月—2019年5月于我院常规产检的孕周30~38+6周的单胎孕妇321例。纳入标准:①孕周根据末次月经以及孕3个月内的超声测量的头臀径核实孕周30~38+6周;②在分娩前48 h内进行胎儿肺部图像采集。排除标准:①多胎妊娠;②胎儿有结构或染色体异常;③新生儿败血症。18例(4%)因测量肺图不合格而排除,177例(41%)因未在48 h内分娩而排除。留下144例孕妇的肺图用于分析。
本研究经医院伦理审查委员会(ID202024)批准通过,所有受试者在参加试验前签署知情同意书。
1.2 胎儿肺部图像采集 使用超声完成胎儿经胸标准四腔心横切面图像采集,频率范围3~7.5 MHz。设备设置的调整由超声科医生决定,根据临床标准以获得最佳图像质量。图像以原始的医学数字成像和通信格式进行数字收集,在每个胎儿肺部图像中,从出现最能代表整体肺组织且阴影最少的区域4个心室水平中选择一个感兴趣的区域。对所有肺部图像确定基于动态范围计算的超声组织异质性(异质性指数)。在进行纹理分析之前,从所有提取的超声图像中删除受保护的健康信息。使用QuantusFLM软件从手动描绘的肺部提取纹理特征。
1.3 观察指标
1.3.1 孕妇及新生儿一般情况 孕妇情况:年龄(32.7±5.7)岁;初产妇59例;早产孕妇20例;未足月胎膜早破6例;子痫前期4例;胎儿生长受限1例;糖尿病27例;产前出血3例;促肺成熟治疗17例。新生儿情况:分娩时孕周(35.7±3.1)周;阴道分娩37例;阴道助产2例,择期剖宫产97例,急症剖宫产8例;出生体重(2 513±748) g;女婴61例;NRDS 5例;进入新生儿重症监护室(neonatal intensive care unit,NICU)18例。144例在48 h内分娩的新生儿发生NRDS 5例。
1.3.2 评估QuantusFLM 预测NRDS的性能 追踪孕妇分娩时间,对48 h内分娩的144例追踪新生儿结局,分析QuantusFLM预测NRDS的阳性预测率、阴性预测率、准确率。基于已有研究,制定NRDS风险基线值(<33周为46.2%,33~33+6周为22.0%,34~34+6周为17.7%,35~35+6周为11.4%,36~36+6周为6.1%,37~37+6周为4.0%,38~38+6周为2.4%)[1],并与通过QuantusFLM评估的风险值比较,将后者高于前者定义为高风险。比较检验不同孕周与QuantusFLM评估风险值的相关性。
1.4 统计学方法 应用SPSS 25.0统计学软件分析数据。阴性预测率=真阴性/(真阴性+假阴性)×100%;阳性预测率=真阳性/(真阳性+假阳性)×100%;敏感度=真阳性/(真阳性+假阴性)×100%;特异度=真阴性/(真阴性+假阳性)×100%;正似然比=敏感度/1-特异度,此值越大表明诊断方法越好;负似然比=1-敏感度/特异度,此值越小诊断方法越好;精度=(真阳性+真阴性)/(真阴性+假阴性+真阳性+假阳性)×100%。
2 结 果
2.1 QuantusFLM软件预测新生儿NRDS 为了验证QuantusFLM软件的预测效果,列出了使用QuantusFLM软件预测后48 h内分娩的临床上诊断为NRDS新生儿数和QuantusFLM 预测的NRDS高风险新生儿数。QuantusFLM 预测NRDS高风险7例,提示阳性预测率为50.00%(7/14),阴性预测率为96.48%(137/142),精度为92.31%(144/156)。其中提示低风险者发生NRDS5例。其中<37周预测为低风险的3例孕妇应用了促肺成熟药物。>37周的2例孕妇没有使用促肺成熟药物,其中1例为妊娠期糖尿病,见表1。
表1 QuantusFLM软件预测新生儿NRDS (例数)
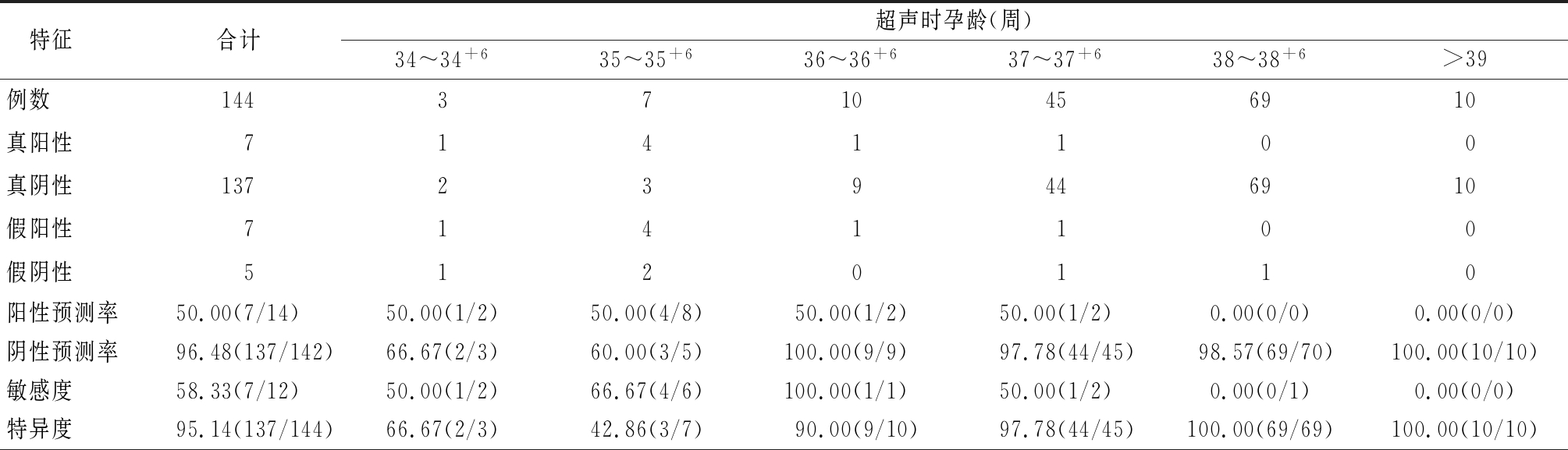
特征合计超声时孕龄(周)34~34+635~35+636~36+637~37+638~38+6>39例数1443710456910真阳性7141100真阴性137239446910假阳性7141100假阴性5120110阳性预测率50.00(7/14)50.00(1/2)50.00(4/8)50.00(1/2)50.00(1/2)0.00(0/0)0.00(0/0)阴性预测率96.48(137/142)66.67(2/3)60.00(3/5)100.00(9/9)97.78(44/45)98.57(69/70)100.00(10/10)敏感度58.33(7/12)50.00(1/2)66.67(4/6)100.00(1/1)50.00(1/2)0.00(0/1)0.00(0/0)特异度95.14(137/144)66.67(2/3)42.86(3/7)90.00(9/10)97.78(44/45)100.00(69/69)100.00(10/10)
表1 (续)

精度92.31(144/156)60.00(3/5)53.85(7/13)90.91(10/11)95.74(45/47)98.57(69/70)100.00(10/10)正似然比12.0001.5001.16610.00022.5020.0000.000负似然比0.4380.7500.7780.0000.5111.0001.000
2.2 QuantusFLM风险值区段分布 为了比较QuantusFLM测量值与已有研究的基线值,列出了321例孕妇不同孕周QuantusFLM测量的数值和已有研究的基线值,表明风险QuantusFLM测量值区段划分与基线值基本符合。n1为低于基线值例数,n2为高于基线值例数,见表2。
表2 QuantusFLM风险值区段分布
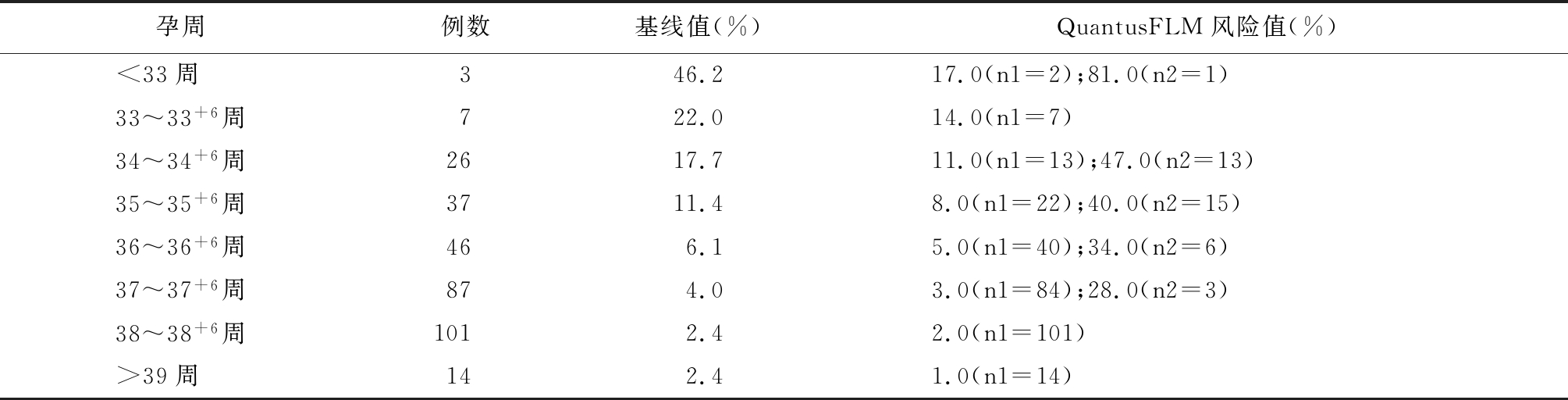
孕周例数基线值(%)QuantusFLM风险值(%)<33周 346.217.0(n1=2);81.0(n2=1)33~33+6周722.014.0(n1=7)34~34+6周2617.711.0(n1=13);47.0(n2=13)35~35+6周3711.48.0(n1=22);40.0(n2=15)36~36+6周466.15.0(n1=40);34.0(n2=6)37~37+6周874.03.0(n1=84);28.0(n2=3)38~38+6周1012.42.0(n1=101)>39周 142.41.0(n1=14)
3 讨 论
新生儿呼吸系统疾病(neonatal respiratory morbidity,NRM)包括NRDS是早产儿甚至早期足月儿(<39周)最常见的并发症。患儿多在生后4~12 h内出现呼吸功能障碍,表现为进行性呼吸困难、发绀及吸气三凹征等,严重者可进一步发生呼吸功能衰竭,如不能及时纠正机体缺氧状况,导致部分脑组织坏死,造成不可逆的神经系统损伤甚至引发死亡[15],综上所述,有效预防NRDS的发生至关重要。
美国妇产科医师协会明确指出在早产发生前应用糖皮质激素是最重要的治疗方法,可预防新生儿NRDS,减少新生儿出现严重颅内出血、不可逆性神经系统后遗症、严重视网膜病变甚至死亡的概率[16]。但多疗程、大剂量使用糖皮质激素会导致新生儿出生体重、身长和头围减小,增加成年后患心血管系统疾病和代谢性疾病的风险,对母体来说会升高血糖,增加感染概率,所以目前对使用糖皮质激素的孕龄、剂量、疗程等方面仍旧存有争议[17]。需要一种能有效预测胎肺的成熟度,针对性使用糖皮质激素,减少滥用。肺部囊性发展阶段始于24周,肺泡上皮逐渐变薄,最终形成囊肿并开始生产表面活性剂。肺发育到肺泡期的过渡没有明确定义。早在妊娠29周时就可以看到肺泡,并且在这段时间和足月之间,肺体积增加了4倍。这个过程通常在妊娠36~38周时加速并持续到婴儿期[18]。发生肺泡形成和分隔,允许扩大气隙。据推测,这个过程就是正在检测的胎儿肺部结构变化[19]。本研究评估了用于新生儿呼吸系统疾病预测的现有商业软件的改进版本,该软件现在包括胎儿肺的自动描绘和深度学习超声图像处理技术。结果表明,胎儿肺的自动描绘与手动描绘一样可靠,其优点是可重复性更高。该软件的预测性能改善了先前报道的相同技术的结果。最后,结果表明,仅基于胎龄,计算机辅助方法可显著改善NRDS的预测,从而预测新生儿呼吸道疾病的发病率[20-22]。
本研究具有优势和局限性。优势是使用标准的胎儿肺部影像来获得其他临床相关信息,并且不需要专门的非标准超声检查程序。局限性是因研究受样本量限制,对于QuantusFLM 预测新生儿NRDS的可行性的评估未能得出预期结论。另外,本研究出现了5例假阴性和7例假阳性病例,考虑可能原因如下:①因为预测高风险,临床上应用了糖皮质激素治疗,高风险的新生儿均未发生NRDS;②本研究基线值来源于西方统计结果,因此其可适用性存疑;③可能因超声医师培训不足,致使超声图像的采集存在一定问题;④不除外此技术本身存在不足。本研究是使用间接方法来评估肺成熟度。新生儿呼吸系统疾病并非唯一由胎儿肺成熟状态决定,在新生儿败血症,畸形可能影响肺功能或产时宫内缺氧缺血的情况下,子宫内肺成熟正常的新生儿可能会出现呼吸功能障碍。没有单独分析诸如胎儿生长受限,多胎妊娠,糖尿病或胎膜早破等特殊情况。QuantusFLM 性能的差异无法排除,需要进一步研究。QuantusFLM改善了新生儿呼吸系统疾病的预测,简化了临床使用。将这种技术应用于临床实践,可选择具有患新生儿呼吸系统疾病高风险的患者,针对性使用产前皮质类固醇和产后表面活性剂等干预措施,强烈支持在临床中使用此项非侵入性技术预测新生儿呼吸系统疾病,但仍需要进一步以多中心方式对该技术进行评估。
最后,研究该软件在类固醇给药后是否可用于检测胎儿肺部变化情况。如果可以假定类固醇给药后胎儿肺部成熟度的变化是逐渐发生的,那么有可能认为肺纹理参数的变化可能要等到特定阈值才能检测到,而且目前还需要继续研究类固醇给药合适的时间间隔。
[1] Sengupta S,Carrion V,Shelton J,et al. Adverse neonatal outcomes associated with early-term birth[J]. J AMA Pediatr,2013,167(11):1053-1059.
[2] 高虹,郭俊梅,樊伟等.超声在高原地区新生儿肺炎诊断中的应用价值[J].昆明医科大学学报,2018,39(4):109-112.
[3] Ghorayeb SR,Bracero LA,Blitz MT,et al. Quantitative ultrasound texture analysis for differentiating preterm from term fetal lungs[J]. J Ultrasound Med,2017,36(7):1437-1443.
[4] Perez-Moreno A,Dominguez M,Migliorelli F,et al. Clinical feasibility of quantitative ultrasound texture analysis:a robustness study using fetal lung ultrasound images(Article)[J]. J Ultrasound Med,2019,38(6):1459-1476.
[5] 中国医师协会新生儿科医师分会.早产儿呼吸窘迫综合征早期防治专家共识[J].中华实用儿科临床杂志,2018,33(6):438-440.
[6] 钟广春.胎肺成熟度的评估方法研究进展[J].吉林医学,2013,34(31):6558-6559.
[7] Bonet-Carne E,Palacio M,Cobo T,et al. Quantitative ultrasound texture analysis of fetal lungs to predict neonatal respiratory morbidity[J]. Ultrasound Obstet Gynecol,2015,45(4):427-433.
[8] Serizawa M,Maeda K. Noninvasive fetal lung maturity prediction based on ultrasonic gray level histogram width[J]. Ultrasound Med Biol,2010,36(12):1998-2003.
[9] Cosmi EV,Anceschi MM,Cosmi E,et al. Ultrasonographic patterns of fetal breathing movements in normal pregnancy[J]. Int J Gynecol Obstet,2003,80(3):285-290.
[10] Bhanu Prakash KN,Ramakrishnan AG,Suresh S,et al. Fatal lung maturity analysis using ultrasound image features[J]. IEEE Trans Inf Technol Biomed,2002,6(1):38-45.
[11] Porto AMF,Coutinho IC,Correia JB,et al. Effectiveness of antenatal corticosteroids in reducing respiratory disorders in late preterm infants:randomised clinical trial[J]. BMJ,2011,342:d1696.
[12] Gyamfi-Bannerman C,Thom EA,Blackwell SC,et al. Antenatal betamethasone for women at risk for late preterm delivery[J].N Engl J Med,2016,374:1311-1320.
[13] 官勇.叶海腾.超声多普勒评估子痫前期胎儿肺成熟度[J].临床肺科杂志,2017,22(11):1959-1960.
[14] Palacio M,Cobo T,Martínez-Terrón M,et al. Performance of an automatic quantitative ultrasound analysis of the fetal lung to predict fetal lung maturity[J]. Am J Obstet Gynecol,2012,207(6):504.e1-5.
[15] 林勇,孙晓玄.肺表面活性物质联合CPAP治疗对新生儿呼吸窘迫综合征血气指标影响的研究[J].世界最新医学信息文摘,2018,18(25):5-6.
[17] Sweet DG,Carnielli V,Greisen G,et al. European consensus guidelines on the management of respiratory distress syndrome-2016 Update[J]. Neonatology,2017,111(2):107-125.
[18] Besnard AE,Wirjosoekarto SAM,Broeze KA,et al. Lecithin/sphingomyelin ratio and lamellar body count for fetal lung maturity:a meta-analysis[J]. Eur J Obstet Gynecol Reprod Biol,2013,169(2):177-183.
[19] Society for Maternal-Fetal Medicine Publications Committee. Implementation of the use of antenatal corticosteroids in the late preterm birth period in women at risk for preterm delivery[J]. Am J Obstet Gynecol,2016,215(2):B13-15.
[20] Cobo T,Bonet-Carne E,Martnez-Terrn M,et al. Feasibility and reproducibility of fetal lung texture analysis by automatic quantitative ultrasound analysis and correlation with gestational age[J]. Fetal Diagn Ther,2012,31(4):230-236.
[21] Palacio M,Bonet-Carne E,Cobo T,et al. Prediction of neonatal respiratory morbidity by quantitative ultrasound lung texture analysis:a multicenter study[J]. A J Obstet Gynecol,2017,217(2):196.e1-e14.
[22] Gyamfi-Bannerman C,Fuchs KM,Young OM,et al. Nonspontaneous late preterm birth:etiology and outcomes[J]. Am J Obstet Gynecol,2011,205(5):456.e1-e6.