糖尿病肾病(diabetic nephropathy, DN)作为一种内分泌疾病,是糖尿病中最常见且严重的并发症之一。当前全球大约有2/5的糖尿病患者会发生严重的DN并发症[1]。在疾病末期,DN患者出现肾衰竭,最终导致死亡[2]。DN病理损伤过程中,肾小球及肾小管发生增生、肥大,炎性细胞浸润以及肾小球系膜细胞损伤等病理性改变,导致尿液中出现蛋白、尿液减少等临床症状。近年来研究者提出“微炎症”学说,认为DN是由炎症引起的代谢紊乱性疾病,高炎症被认为是DN的显著特点[3]。在高糖微环境中,核因子κB(nuclear factor κB,NF-κB)信号通话的激活被认为在促炎环境中起到至关重要的作用。MicroRNAs(miRNAs)作为一种非编码短链微小RNA,对靶基因表达具有调控作用。MicroRNAs在肾脏疾病中起到何种作用,是一个备受关注的研究热点。在DN发展过程中,MicroRNAs调节炎症的作用机制尚不清楚。姜黄素具有抗炎[4]、抗氧化[5]和降血糖[6]等作用。本研究课题通过构建大鼠DN动物模型,观察姜黄素对miR-146a mRNA表达的影响,探讨姜黄素在DN中缓解肾脏损伤的机制研究,为临床治疗DN提供新思路。
1 材料与方法
1.1 材料来源 体重220 g左右的雄性SD大鼠(河北省实验动物中心购买,合格证编号:1808247);链脲佐菌素、姜黄素(美国 Sigma公司);尿蛋白测定试剂盒(上海生工生物有限公司);Nephrin兔抗鼠单抗、NF-κB p65兔抗鼠单抗(美国Abcam公司);Trizol RNA抽提试剂、Real-time ScriptTM逆转录试剂盒、SYBR Premix ExTaTM荧光实时定量聚合酶链反应聚合酶链反应(polymerase chain reaction,PCR)试剂盒(广州锐博技术有限公司);Western blot制胶试剂盒(碧云天生物公司);全自动生化分析仪(美国贝克曼公司); Nanodrop ND-2000(美国Thermo公司);7500 Fast型荧光实时定量PCR仪(美国ABI公司);莱卡正置荧光显微镜(德国莱卡公司);蛋白印迹试验装置(美国Bio-Rad公司)。本实验所用引物均由广州锐博技术有限公司合成。将SD大鼠分为:空白对照组(N组):无需任何处理;糖尿病肾病模型组(DN组):仅建立DN动物模型;姜黄素干预治疗组(CT组):在建立DN动物模型基础上,每天姜黄素悬液灌胃(500 mg/kg),干预治疗持续4周。N组和DN组每天用PBS进行灌胃干预治疗,持续4周。
1.2 方法
1.2.1 大鼠DN模型的制备[7] 给予SD大鼠高脂、高糖饲料喂养。连续高脂、高糖喂养6周后,每只SD大鼠按照30 mg/kg 腹腔注射1% 链脲佐菌素(streptozocin,STZ),腹腔连续注射1周。继续给予高脂、高糖饲料喂养4周,利用代谢笼收集24 h大鼠尿液。满足以下条件:①24 h尿蛋白≥0.4 mg;②随机血糖≥16.7 mmol/L,才能确认DN大鼠动物模型建模成功。
1.2.2 大鼠生化指标检测 利用代谢笼收集各组大鼠24 h尿液,室温条件下静置10 min,以3 000 r/min离心10 min,吸取上清液,随后按照试剂盒说明书进行上机操作,检测尿蛋白。用2%戊巴比妥钠麻醉大鼠,开腹后从腹主动脉获取血清,利用全自动生化分析仪测定血糖(blood glucose,BG)、血尿素氮(blood urea nitrogen,BUN)、血肌酐(serum creatinine,SCr)和尿白蛋白肌酐比值(urine albumin creatine ratio,UACR)等生化指标。
1.2.3 肾组织病理学观察 处死大鼠,将肾脏组织放置10% 甲醛溶液中固定,然后经石蜡包埋、切片、脱蜡、水化、抗原修复、苏木素染色、脱水干燥等一系列过程,最后中性树脂封片,镜下观察。
1.2.4 肾组织Nephrin蛋白变化情况 将各组大鼠肾脏组织去除筋膜后液氮冷冻研磨,将预冷的蛋白裂解液加入到研钵中提取蛋白并进行蛋白浓度测定。随后将蛋白样品进行十二烷基硫酸钠-聚丙烯酰胺凝胶(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)电泳分离,再以恒流电转印到聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上,室温条件下封闭1 h,再加入相应抗体,4 ℃孵育过夜,次日用1×TBS-T液洗涤3次,10 min/次,加入辣根酶标记的二抗,37 ℃孵育1 h,1×TBS-T液洗涤3次,10 min/次,ECL化学发光剂检测蛋白表达情况。
1.2.5 miR-146a、促炎因子[肿瘤坏死因子α(tumor necrosis factor- α,TNF-α)和白细胞介素1β(interleukin-1β,IL-1β)]及纤维化因子β(transforming growth factor-β,TGF-β)、Ⅰ型胶原蛋白(collagenⅠ)基因表达情况 干预治疗4周后,处死大鼠,将肾脏组织去除筋膜后液氮冷冻研磨,随后加入1 mL TRIzol试剂,小心吹吸后移入去酶EP管中,按照TRIzol试剂盒使用说明提取组织总RNA。Nanodrop ND-2000检测RNA质量和浓度。随后将提取的RNA反转录为cDNA,取cDNA进行荧光实时定量PCR检测,PCR反应条件按照广州锐博试剂说明书进行操作。实验数据通过相对定量△△Ct法进行分析。
1.3 细胞水平研究
1.3.1 大鼠肾小球系膜细胞(mesangial cells,HBZY-1)培养 分别在含有4.5 mmol/L 和25 mmol/L葡萄糖的含10%牛清的细胞培养液条件下培养HBZY-1细胞,用于模拟正常生理环境和糖尿病高糖环境。
1.3.2 不同培养条件下检测miR-146a基因表达情况 在正常培养条件下,分别用0、5 μmol/L、15 μmol/L和25 μmol/L浓度姜黄素刺激HBZY-1细胞24 h后,收集细胞检测miR-146a基因表达;分别在含有4.5 mmol/L(L-HC组)、15 mmol/L(M-HC组)和25 mmol/L葡萄糖(H-HC组)的含10%牛清的 DMEM 培养液条件下,收集细胞检测miR-146a基因表达。
1.3.3 转染miR-146a minics后各项指标检测 在含有25 mmol/L葡萄糖培养条件下,待HBZY-1细胞达到 50%~70%的汇合率后,按照说明书要求将miR-146a minics进行转染。转染成功后,荧光实时定量PCR检测miR-146a基因、靶基因Traf6和促炎因子、纤维化因子的表达情况;Western blot检测p65蛋白变化。
1.4 统计学方法 应用SPSS 21.0统计软件分析数据。计量资料比较采用单因素方差分析和SNK-q检验,以上实验均重复3次。P<0.05为差异有统计学意义。
2 结 果
2.1 生化指标和蛋白尿检测情况 留取各组大鼠血清标本和24 h尿液,利用试剂盒检测BG、BUN、SCr和UACR含量。与N组比较,DN组BG、BUN、SCr和UACR均明显升高,差异有统计学意义;CT组BG、BUN、SCr和UACR含量下降,差异有统计学意义(P<0.05)。见表1。
表1 各组大鼠血清BG、BUN、SCR水平及UACR水平比较
Table 1 Comparison of BG,BUN,SCR and UACR among different groups ![]()
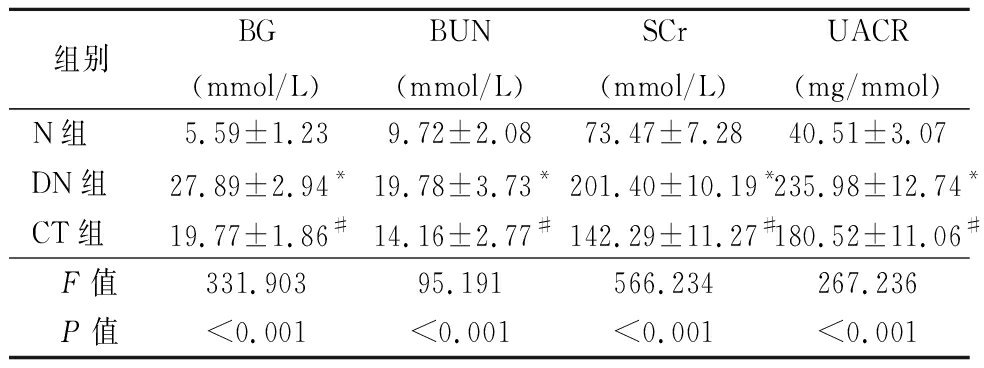
组别BG(mmol/L)BUN(mmol/L)SCr(mmol/L)UACR(mg/mmol)N组5.59±1.239.72±2.0873.47±7.2840.51±3.07DN组27.89±2.94*19.78±3.73*201.40±10.19*235.98±12.74*CT组19.77±1.86#14.16±2.77#142.29±11.27#180.52±11.06# F值331.90395.191566.234267.236 P值<0.001<0.001<0.001<0.001
*P值<0.05与N组比较 #P值<0.05 与DN组比较(SNK-q检验)
2.2 各组大鼠病理切片情况 N组大鼠肾脏组织形态规则、结构清晰;DN组大鼠肾脏组织可见大量炎细胞浸润,肾小管胞质呈空泡状;CT组肾脏结构清晰,水肿消退,肾脏组织损伤缓解。见图1。
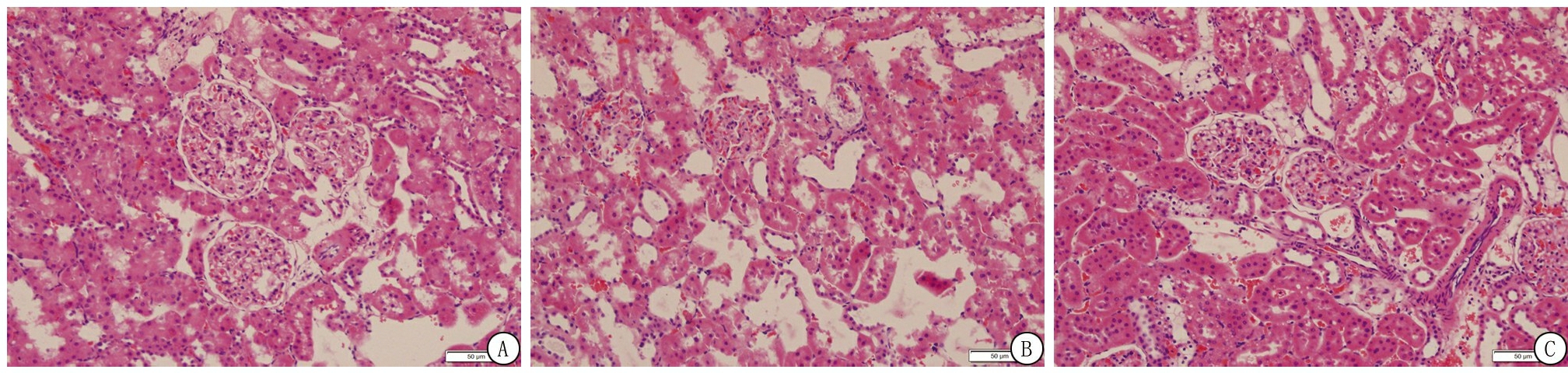
图1 各组大鼠肾脏组织HE染色( ×200)
A.D组;B.DN组;C.CT组
Figure 1 HE staining of rat kidney tissue in each group( ×200)
2.3 各组大鼠组织Nephrin蛋白和炎症因子、纤维化因子表达情况 Western blot结果显示,与N组比较,DN组Nephrin蛋白表达降低;而与DN组相比,CT组Nephrin蛋白表达则升高,差异有统计学意义(P<0.05)。实时定量PCR结果显示,与N组比较,DN组miR-146a表达降低,促炎因子TNF-α、IL-1β和纤维化因子TGF-β、collagen Ⅰ表达升高;而与DN组比较,CT组miR-146a表达则升高,细胞因子表达则降低,差异有统计学意义(P<0.05)。见图2,表2。
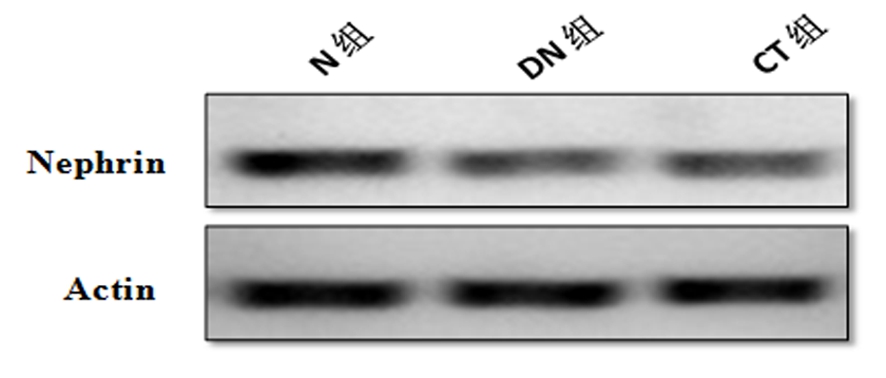
图2 各组大鼠组织Nephrin表达情况
Figure 2 Nephrin protein expression in rat tissues of each group
2.4 不同培养条件下miR-146a基因表达情况 在含有4.5 mmol/L葡糖糖培养条件下,随着姜黄素浓度增加,miR-146a基因表达增加,呈剂量依赖性;在含有不同糖浓度培养条件下,随着糖含量增加,miR-146a mRNA表达降低,呈剂量依赖性。见表3,4。
2.5 转染miR-146a minics对miR146a和细胞因子表达的影响 将miR-146a minics和 negative control(NC)转染到高糖培养条件下HBZY-1细胞中,转染miR-146a minics的H-HC miR-146a组中, miR-146a的表达明显高于H-HC miR-NC组,而H-HC组与H-HC miR-NC组之间差异无统计学意义;与H-HC miR-NC组比较,H-HC miR-146a组中靶基因Traf6和促炎因子(TNF-α和IL-1β)、促纤维化因子(TGF-β和collagen Ⅰ)均降低,差异有统计学意义(P<0.05)。见表5。
表2 各组大鼠组织miR-146a mRNA及细胞因子表达情况比较
Table 2 miR-146a mRNA and cytokine expression in rat tissues of each group ![]()
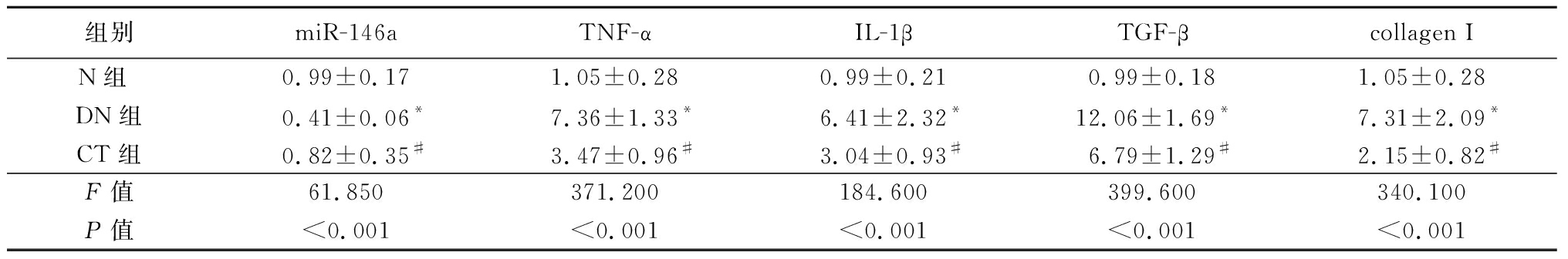
组别miR-146aTNF-αIL-1βTGF-βcollagen IN组 0.99±0.171.05±0.280.99±0.210.99±0.181.05±0.28DN组0.41±0.06*7.36±1.33*6.41±2.32*12.06±1.69*7.31±2.09*CT组0.82±0.35#3.47±0.96#3.04±0.93#6.79±1.29#2.15±0.82#F值61.850371.200184.600399.600340.100P值<0.001<0.001<0.001<0.001<0.001
*P值<0.05与N组比较 #P<0.05与DN组比较(SNK-q检验)
表3 不同姜黄素培养条件下miR-146a mRNA
表达情况比较
Table 3 miR-146a mRNA expression under different
curcumin culture ![]()

组别 miR-146a姜黄素0 μmol/L组 1.06±0.32 姜黄素5 μmol/L组 1.91±0.48*姜黄素15 μmol/L组4.01±1.09*姜黄素20 μmol/L组7.17±1.32*F值 389.300P值 <0.001
*P值<0.05与姜黄素0 μmol/L组比较(SNK-q检验)
表4 不同葡萄糖培养条件下miR-146a mRNA
表达情况比较
Table 4 miR-146a mRNA expression under different
glucose culture ![]()

组别 miR-146a葡萄糖4.5 mmol/L组1.03±0.11 葡萄糖15 mmol/L组 0.54±0.16*葡萄糖25 mmol/L组 0.35±0.09*F值 95.870P值 <0.001
*P<0.05与葡萄糖4.5 mmol/L组比较(SNK-q检验)
表5 转染后各组细胞中mRNA表达情况比较
Table 5 After transfection,mRNA expression in cells of each group ![]()
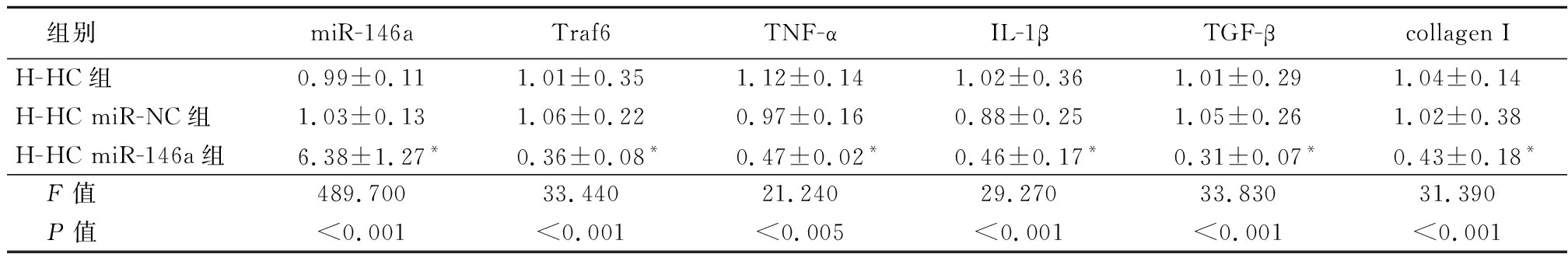
组别miR-146aTraf6TNF-αIL-1βTGF-βcollagen IH-HC组0.99±0.111.01±0.351.12±0.141.02±0.361.01±0.291.04±0.14H-HC miR-NC组1.03±0.131.06±0.220.97±0.160.88±0.251.05±0.261.02±0.38H-HC miR-146a组6.38±1.27*0.36±0.08*0.47±0.02*0.46±0.17*0.31±0.07*0.43±0.18* F值489.70033.44021.24029.27033.83031.390 P值<0.001<0.001<0.005<0.001<0.001<0.001
*P值<0.05 与H-HC miR-NC组比较(SNK-q检验)
2.6 miR146a对NF-κB p65活化的影响 在高糖条件培养下的HBZY-1转染miR-146a minics和negative control后,H-HC miR-146a组中p65蛋白表达水平明显低于H-HC miR-NC组和H-HC组,差异有统计学意义(P<0.05)。见图3 。
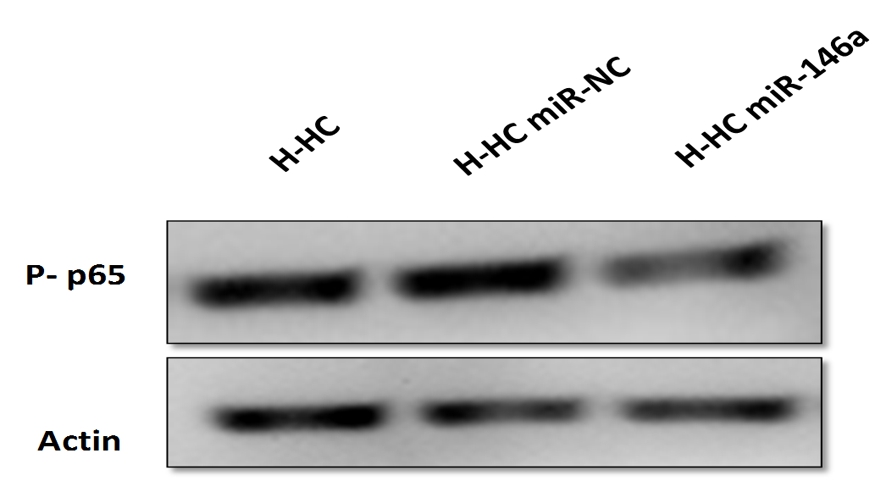
图3 各组细胞中p65表达水平情况
Figure 3 p65 protein expression in cells of each group
3 讨 论
DN是机体代谢紊乱损伤微血管的一种内分泌疾病。在高糖内环境下,DN患者的肾小球系膜细胞发生增殖、坏死,间质纤维化,导致肾功能损伤,最终发展为肾衰竭[8-9]。炎症因子在DN发展中起到至关重要的作用,是DN主要发病机制之一[10-12]。尿液中出现含有微量白蛋白标志着肾脏出现损伤,肾功能下降。因此,蛋白尿可作为DN进展的主要指证之一[13]。临床上主要以降低血糖及控制炎症为主的治疗方案,减少蛋白尿改善DN患者的临床症状。姜黄素属于植物姜黄的主要成分之一,具有抑制促炎因子[4]、清除氧自由基[5]和控制血糖[6]等功能。本研究课题利用STZ诱导构建DN大鼠模型[7],发现DN组BG、BUN、SCr和UACR含量明显高于N组,同时肾脏组织病理切片和Western blot检测Nephrin蛋白水平,提示肾脏组织损伤。而当利用姜黄素悬液干预治疗DN大鼠,大鼠的BG、BUN、SCr和UACR含量明显降低,肾脏损伤减轻或缓解,这表明姜黄素能够缓解DN的肾脏损伤,从而肾功能得到改善。
微小RNA即MicroRNA,是广泛分布在真核生物中的一类非编码小RNA[14]。通过与靶基因信使RNA碱基配对实现降解信使RNA 或抑制信使RNA的翻译表达,从而对靶基因表达进行调控[15]。人体内大约有3/5的编码蛋白质可以通过MicroRNA进行调节,人类疾病的发生与MicroRNA表达的异常有着十分关键的联系。miRNA-146a与炎症性、纤维化性疾病具有一定相关性[16-17]。体外研究发现,miR-146a mRNA表达与姜黄素、葡萄糖浓度呈剂量依赖性关系,姜黄素浓度越高,miR-146a相对表达量越高;而葡萄糖浓度越高,miR-146a 相对表达量越低。
miR-146a靶基因有Traf6和Irak1两种基因,其可以通过调控靶基因表达来影响下游基因的表达[18]。在体外高糖培养大鼠肾小球系膜细胞,利用转染技术将miR-146a mimics转染进细胞中,人为上调miR-146a表达,检测靶基因Traf6及其下游的NF-κB信号通路情况。发现,miR-146a mimics可以抑制靶基因Traf6 mRNA表达,同时其下游的NF-κB p65蛋白活性被抑制。NF-κB参与众多炎症信号通路,负责调控炎症基因表达。炎症因子异常表达在DN的发生发展中发挥了关键性作用。TNF-α和IL-1β可以导致肾脏系膜增生,肾脏纤维化[19]。在DN炎症反应中,NF-κB信号通路对其下游炎症因子是否具有调控呢?结果显示,随着人为上调miR-146a基因表达,NF-κB p65蛋白表达降低,活性被抑制,有效的抑制其下游因子TNF-α和IL-1β等基因mRNA表达。
综上所述,在DN发展过程中,姜黄素可以通过上调miRNA-146a mRNA表达,靶向调控Traf6抑制NF-κB 介导的促炎因子mRNA表达,一定程度上缓解DN大鼠肾脏损伤,改善肾脏功能,为临床治疗糖尿病肾病提供一定的基础理论。
[1] 中华医学会糖尿病学分会微血管并发症学组.中国糖尿病肾病疾病防治临床指南[J].中华糖尿病杂志,2019,11(1):15-28.
[2] Wang T,Gao Y,Wang X,et al. Calpain-10 drives podocyte apoptosis and renal injury in diabetic nephropathy[J]. Diabetes Metab Syndr Obes,2019,12:1811-1820.
[3] Sankrityayan H,Oza MJ,Kulkarni YA,et al. ER stress response mediates diabetic microvascular complications[J]. Drug Discov Today,2019,24(12):2247-2257.
[4] Hanai H,Sugimoto K. Curcumin has bright prospects for the treatment of inflammatory bowel disease[J]. Curr Pharm Des,2019,15(18):2087-2094.
[5] 王宁.Notch1通路介导姜黄素拮抗血管内皮细胞氧化应激损伤的机制研究[D].西安:第四军医大学,2014.
[6] 张楠.姜黄素对糖尿病大鼠肝脏糖异生及 Egr-1/C/EBPα途径的影响[D].石家庄:河北医科大学,2017.
[7] Aakruti K,Divya D,Suraj M,et al. Standardization of type 1 and type 2 diabetic nephropathy models in rats:assessment and characterization of metabolic features and renal injury[J]. J Pharmary Bio Sci,2020,12(3):295-307.
[8] 沈义兰,丁涛,梅小斌.糖尿病肾病的生物治疗机研究进展[J].药学服务与研究,2018,18(6):401-405.
[9] Wang J,Duan L,Guo T,et al. Downregulation of miR-30c promotes renal fibrosis by target CTGF in diabetic nephropathy[J]. J Diabetes Complications,2016,30(3):406-414.
[10] Matoba K,Takeda Y,Nagai Y,et al. Unraveling the role of inflammation in the pathogenesis of diabetic kidney disease[J]. Int J Mol Sci,2019,20(14).pii:E3393.
[11] Gu J,Huang W,Zhang W,et al. Sodium butyrate alleviates high-glucose-induced renal glomerular endothelial cells damage via inhibiting pyroptosis[J]. Int Immunopharmacol,2019,75:105832.
[12] 李香茶,余瑾,姚国明,等.微炎症因子对终末期糖尿病肾病患者血液透析前后中医证候变化的影响[J]. 浙江中医杂志,2019,54(6):402-403.
[13] Lu X,Chen M,Shen J,et al. IL-1β functionally attenuates ABCG2 and PDZK1 expression in HK-2 cells partially through NF-κB activation [J]. Cell Biol Int,2019,43(3):279-289.
[14] Lee R,Feinbaum R,Ambros V. The C elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-4[J]. Cell,1993,75(5): 843-854.
[15] Mashreghi M,Azarpara H,Bazaz M,et al. Angiogenesis biomarkers and their targeting ligands as potential targets for tumor angiogensis[J]. J Cell Physiol,2018,233(4):2949-2965.
[16] 郝存勖,苏彦君,王青菊,等.姜黄素对糖尿病大鼠肾组织NF-κB的DNA结合活性升高的抑制作用[J].医学动物防制,2011,27(4):321-322,325.
[17] 钟凌,冯韵霖,杨鸿玲,等.miR-451a 在糖尿病肾病纤维化中的临床应用研究[J].现代预防医学,2017,44(5):941-946.
[18] 刘学,王亚君,杜红梅,等.miR-146a下调小鼠TRAF-6并减少胸腺基质细胞凋亡率的实验研究[J].国际免疫学杂志,2019,42(2):121-126.
[19] 安仲武,冯小娟,蒋玲,等.糖尿病肾病患者血清Vaspin水平变化及其炎症因子的关系[J]. 山东医药,2017,57(45):76-78.