经相关临床研究发现,经肿瘤坏死因子样弱凋亡诱导因子(tumor necrosis factor-like weak inducer of apoptosis,TWEAK)作用后,巨噬细胞源性外泌体可以有效产生抑制功效,但其所存在着作用机制尚不明确。经另一项调查观察到,在卵巢癌细胞内对miRNA-7进行转染,可以有效对表皮生长因子受体以及受体下游信号通路的表达水平进行抑制,并可以对卵巢癌细胞迁移与侵袭作用进行抑制[1-12]。所以,本研究旨在探究经TWEAK作用后是否借助于对巨噬细胞与其外泌体内miRNA-7表达水平进行调控,抑制EOC细胞迁徙与迁移作用,现报告如下。
1 资料与方法
1.1 一般资料 实验中所使用的人单核细胞株THP-1购买自中国科学院上海生命科学研究院中细胞库内,使用市级内妇科肿瘤重点研究室长期保存着的人上皮性卵巢癌细胞株HO8910-PM。RPMI-1640培养基与胎牛血清来自于Hyclone公司;重组人TWEAK细胞因子来自于Sigma公司;佛波酯来自于PeproTech公司;总外泌体分离试剂盒与TRIzol试剂来自于Invitrogen公司;TaqMan microRNA反转录试剂盒来自于Applied Biosystems公司;U6的特殊性探针与miRNA-7来自于Applied Biosystems公司。Transwell小室属于Corning公司,此类型号为3422;0.22 μm滤器具来自于Millipore公司;Matrigel基质胶来自于BD公司);在整个实验过程中主要使用CST公司的的蛋白检测抗体。本研究经医院伦理委员会批准。
1.2 方法
1.2.1 细胞培养 人单核细胞THP-1与人上皮性卵巢癌细胞HO8910-PM培养在包含有纯度10%的胎牛血清的0% RPIM-1640培养基中,在37 ℃ 5%CO2条件下经培养箱中培养间进行传代。细胞通过1 500×g离心2 min后传代或是换液。THP-1细胞注意保持形态相同、透亮、圆形的悬浮状况有所发生。
1.2.2 对诱导THP-1巨噬细胞作用 悬浮着的THP-1细胞根据5×105个/mL的密度在10 cm的培养皿当中进行接种,与此同时添加100 ng/mL的佛波酯进行诱导24 h。
1.2.3 经TWEAK作用对巨噬细胞进行刺激 所悬浮着的THP-1细胞经过一定的诱导过程使得细胞变为所贴壁着的巨噬细胞后,使用PBS洗2次,并将培养基转换为不含有血清的RPIM-1640培养基,200 ng/mL的对其进行添加TWEAK并持续刺激24 h。对照组添加同等体积量的PBS,其他的处理形式与上述几近相似。
1.2.4 细胞上清液中外泌体的分离 选择400×g取细胞上清液进行离心处理15 min,选择上清。选择5 000×g,在温度为4 ℃下离心处理15 min,选择0.22 μm滤器进行过滤。按照2∶1的比例将上清与抽提试剂混合添加至外泌体抽提试剂当中,快速混匀并放置在4 ℃过夜,次日拿走,10 000×g,在4 ℃温度下离心1 h,将上清抽离出来。沉淀为抽提的外泌体,使用PBS重悬处理后使用BCA手段定量蛋白。然后将其放置在-80 ℃摄氏度的冰箱进行长时间的封存,尽可能防止反复冻融。
1.2.5 Western blotting手段对细胞内蛋白的表达进行检测 去除细胞培养基,利用温度为4 ℃预冷后的PBS洗2次,添加含蛋白酶抑制剂的RIPA裂解液在冰上对其裂解30 min。使用裂解溶液以1 200×g,在温度为4 ℃进行离心处理10 min,去除沉淀后对裂解溶液使用BCA手段对其进行定量。含量10%的十二烷基硫酸钠-聚丙烯酰胺凝胶(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)电泳对蛋白样品进行相应的分离,最初的电压保持在80 V,将蛋白marker进行分开后,将使用电压调节至120 V,完成整个电泳实验。经聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)膜转膜90 min后,保持恒电流为200 mA。浓度为5%的BSA在室温条件下摇床封闭2 h,根据抗体说明书所表示,添加稀释一抗并在温度为4 ℃条件下孵育过夜,在实验中使用TBS-T缓冲溶液洗膜后二抗在常温条件下进行1 h的孵育,使用荧光扫描设备对显影进行扫描。
1.2.6 使用Real-time PCR技术对miRNA-7的表达进行检测 按照TRIzol试剂说明书内容选取巨噬细胞与外泌体内的RNA。使用特殊的TaqMan反转录探针对miRNA-7进行反转录,经反转录可以转录成为cDNA,使用TaqMan miRNA反转录试剂盒对整个反转录体系结果进行调试,配置反应体系中所需要的所有处理都是在冰的条件下进行处理。反应条件为时间30 min,温度为16 ℃,30 min 42 ℃,5 min 85 ℃。而后按照后TaqMan miRNA Assay操作手册所要求的操作步骤对相关试剂进行配置并完成PCR反应。确保反应顺利进行,应当控制精准的反应条件:10 min 95 ℃,15 s 95 ℃,1 min 60 ℃,之后的两个步骤共分为40个循环。使用U6作为内参照,以2-△△CT值对微小RNA即miRNA的相对表达量进行评估,在进行试验后,保证每组试验设定为3个复孔。
1.2.7 Transwell侵袭和迁移实验 使用无血清RPMI-1640培养基对HO8910-PM细胞进行重悬,对细胞数密度进行相应的调整。按照4×104个细胞在迁移实验中种于上室;在进行侵袭实验过程中,首先使用无血清先将RPMI-1640培养基按照1∶6的比例对Matrigel基质胶进行稀释,选择容量为50 μL稀释溶液包被置于Transwell小室的最下位置处,将8×104个细胞种于上室。在下室添加浓度为10%的750 μL胎牛血清RPMI-1640培养基后,放置在细胞培养箱中培养24 h。之后使用浓度为4%的多聚甲醛固定30 min,结晶紫染色时间大约为30 min,使用PBS清洗3次后使用棉签对上室残留细胞进行擦去,放置在倒置显微镜下拍照并进行相应的计量。每个样品随机计数5个视野穿过的细胞数并在数据中选取平均数值。
1.3 观察指标 对TWEAK在刺激作用前后的巨噬细胞源性外泌体进行收集,同H08910-PM一起进行培养,通过使用real-time PCR对巨噬细胞源性外泌体、巨噬细胞以及共同培养后的HO8910-PM细胞中miRNA-7的表达进行检测,通过Western blotting技术对共培养后的HO8910-PM细胞中EGFR/AKT/ERK1/2信号通路的表达进行检测,观察与比较2组巨噬细胞内及其外泌体中miRNA-7表达水平、2组巨噬细胞源性外泌体对HO8910-PM细胞中miRNA-7的表达。
1.4 统计学方法 应用SPSS 17.0统计软件处理数据。计量资料比较采用t检验,计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 2组巨噬细胞内及其外泌体中miRNA-7表达水平比较 在TWEAK作用后,观察组巨噬细胞内及其外泌体中miRNA-7表达水平明显高于对照组,差异有统计学意义(P<0.05)。见表1。
表1 2组巨噬细胞内及其外泌体中miRNA-7表达水平比较
Table 1 Comparison of expression levels of miRNA-7
in macrophages and their exosomes in two groups ![]()
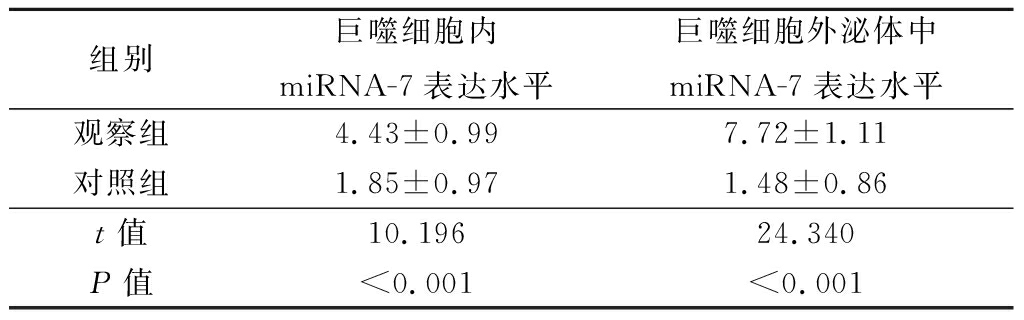
组别巨噬细胞内miRNA-7表达水平巨噬细胞外泌体中miRNA-7表达水平观察组4.43±0.997.72±1.11对照组1.85±0.971.48±0.86t值10.19624.340P值<0.001<0.001
2.2 2组巨噬细胞源性外泌体对HO8910-PM细胞中miRNA-7的表达比较 在TWEAK作用后,观察组经TWEAK刺激后的巨噬细胞源性外泌体对HO8910-PM细胞中miRNA-7的表达明显高于对照组,差异有统计学意义(P<0.05)。见表2。
表2 2组巨噬细胞源性外泌体对HO8910-PM
细胞中miRNA-7 的表达比较
Table 2 Comparison of expression of miRNA-7 in
HO8910-PM cells by macrophage derived exosomes
in two groups ![]()

组别HO8910-PM细胞中miRNA-7观察组3.85±0.97对照组1.44±0.39t值12.626P值<0.001
3 讨 论
TWEAK蛋白最初是1997年被相关学者所发现,它是由249个氨基酸所组成的Ⅱ型跨膜蛋白,包含有TNF的同源结构范围。现今探究表明,经TWEAK作用后可直接对自然杀伤细胞、巨噬细胞与树突状细胞等固有免疫细胞的功效进行调节。经相关学者探究表明,TWEAK可以对肿瘤浸润巨噬细胞的抗肿瘤作用有着重要的影响,但现如今对其抗肿瘤作用机制还探究的甚少[13-15]。经前期探究表明,在TWEAK作用下,巨噬细胞上所存在着的清液可以对人卵巢癌细胞HO8910-PM的侵袭作用进行有效抑制。之后在TWEAK刺激作用后的从巨噬细胞上清液之中分离并提取出外泌体,观察到其外泌体具有可以对HO8910-PM细胞侵袭和迁移的作用进行抑制的因子。但是外泌体包含有脂质、蛋白质等多类的生物活性物质,它可以具备抑制癌症的功效[16-17]。
本研究主要探究巨噬细胞源性外泌体在TWEAK作用后抑制上皮性卵巢癌细胞侵袭与迁移的作用机制,经研究表明,在TWEAK作用后,观察组巨噬细胞内及其外泌体中miRNA-7表达水平提高。在进行不同处理后,巨噬细胞源性外泌体同HO8910-PM细胞共培养24 h,之后对HO8910-PM细胞中的miRNA-7进行检测。观察组经TWEAK刺激后的巨噬细胞源性外泌体对HO8910-PM细胞中miRNA-7的表达明显高于对照组,差异有统计学意义(P<0.05)。该数据提示在TWEAK对巨噬细胞介导中,miRNA-7可以发挥其抑制癌症的功效。其中外泌体中的miRNA可以稳定地保存着,通过细胞间的传递并调节下游基因的表达过程。对乳腺癌、脑胶质瘤等的癌症的探究,其中通过miRNA-7可以有效抑制贴壁于肿瘤细胞内的斑激酶并可以抑制EGFR等分子及其下游信号通路,帮助调节抑制癌症。大概约有70%的卵巢癌细胞内高表达水平,所被激活的EGFR信号通路可以调节细胞侵袭、迁移等过程,并极大提高产生肿瘤血管的量。因此有效抑制其相关的信号通路就可以做到治疗患者的卵巢癌。经观察发现巨噬细胞在分泌过程中会分泌外泌体,调节患者HO8910-PM细胞中miRNA-7的表达水平,对其EGFR/AKT/ERK1/2信号通路的活化进行抑制,并使得卵巢癌细胞的在整个侵袭和迁移阶段中得到较好的抑制作用。通过作相关的对体外实验观察到,有一类miRNA-7可以有效地抑制卵巢癌细胞整个迁移过程。本探究还需要开展后期对动物的临床实验进一步证实。现阶段,已有许多有关于体内研究的文献。相关学者利用注射相关所研究的细胞液体直至小鼠腹腔内部,对肿瘤组织中巨噬细胞的CD206的表达能力进行检测。观察结果为卵巢癌细胞外泌体可以对整个分化成为M2型巨噬细胞产生抑制作用,帮助外泌体内的miRNA-223发挥巨大作用。
综上所述,TWEAK对癌细胞中miRNA-7的表达能力进行上调,并抑制EGFR表达活化相关信息通路从而抑制癌细胞的扩散转移[18]。
[1] Wang X,Ivan M,Hawkins SM. The role of microrna molecules and microrna-regulating machinery in the pathogenesis and progression of epithelial ovarian cancer[J]. Gynecol Oncol,2017,147(2):481-487.
[2] Haga CL,Velagapudi SP,Childs-Disney JL,et al.Rapid generation of mi RNA inhibitor leads by bioinformatics and efficient high-throughput screening methods[J]. Methods Mol Biol,2017,1517(2):179-198.
[3] Fareh M,Yeom KH,Haagsma AC,et al. TRBP ensures efficient Dicer processing of precursor micro RNA in RNA-crowded environments[J]. Nat Commun,2016,7(2):13694-13705.
[4] Song MS,Rossi JJ. Molecular mechanisms of Dicer: endonuclease and enzymatic activity[J]. Biochem J,2017,474(10):1603-1618.
[5] Devasthanam AS,Tomasi TB. Dicer in immune cell development and function[J]. Immunol Invest,2014,43(2):182-195.
[6] Baer C,Squadrito ML,Laoui D,et al. Suppression of micro RNA activity amplifies IFN-γ-induced macrophage activation and promotes anti-tumour immunity[J]. Nat Cell Biol,2016,18(7):790-802.
[7] Lee Y,Biswas SK. Rewiring macrophages for anti-tumour immunity[J]. Nat Cell Biol,2016,18(7):718-720.
[8] Melo SA,Sugimoto H,O′connell JT,et al. Cancer exosomes perform cell-independent micro RNA biogenesis and promote tumorigenesis[J]. Cancer Cell,2014,26(5):707-721.
[9] Park MH,Hong JT. Roles of NF-κB in cancer and in ammatory diseases and their therapeutic approaches[J]. Cells,2016,5(2):15-21.
[10] Wang Y,Sun L,Song Z,et al. Maspin inhibits macrophage phagocytosis and enhances inflammatory cytokine production via activation of NF-κB signaling[J]. Mol Immunol,2017,82:94-103.
[11] Richmond A,Yang J. The role of NF-κB in modulating antitumor immunity[J]. Oncoimmunology,2016,5(1): e1005522.
[12] 邱兴堤,吴安玥,李栋,等.TWEAK 调控Dicer促使巨噬细胞源性外泌体分选miR-7至卵巢癌细胞的机制[J].上海交通大学学报(医学版),2018,38(7):740-744.
[13] Siegel RL,Miller KD,Jemal A. Cancer statistics,2017[J]. CA Cancer J Clin,2017,67(1):7-30.
[14] Chen W,Zheng R,Baade PD,et al. Cancer statistics in China,2015[J]. CA Cancer J Clin,2016,66(2):115-132.
[15] Dreyer F,Baur A. Biogenesis and functions of exosomes and extracellular vesicles[J]. Methods Mol Biol,2016,1448:201-216.
[16] Becker A,Thakur BK,Weiss JM,et al. Extracellular vesicles in cancer:cell-to-cell mediators of metastasis[J]. Cancer Cell,2016,30(6):836-848.
[17] 胡媛,邱丽华.TWEAK 通过外泌体途径介导巨噬细胞抑制上皮性卵巢癌细胞转移的研究[J]. 现代妇产科进展,2015,24(7):512-515.
[18] 李栋,胡 媛,吴安玥,等.TWEAK 调控巨噬细胞外泌体中 mi RNA-7的表达抑制卵巢癌细胞侵袭和迁移的研究[J].上海交通大学学报(医学版),2017,37(6):727-731.