急性白血病(acute leukemia,AL)是儿童时期最常见的恶性肿瘤,其中急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)发病率最高,约占70%。随着联合化疗方案的优化以及造血干细胞移植、免疫治疗等方法应用,儿童ALL的无事件生存率(event-free survival,EFS)有了明显的提高,但是治疗相关的问题比如铁超载等越来越受到关注。我们团队在前期研究中发现急性白血病患儿血清铁调素(Hepcidin)水平高于健康对照,但Hepcidin水平的高低对儿童ALL预后影响的研究国内外罕见报道。Hepcidin作为铁代谢的负性调节因素,在铁代谢及慢性病性贫血中起重要作用,但是关于Hepcidin在儿童急性淋巴细胞白血病中的作用的研究相对较少。本研究通过对ALL患儿外周血中Hepcidin表达水平及其对预后的影响,以及Hepcidin与贫血、铁代谢指标的相关分析,探讨ALL患儿血清Hepcidin水平及其临床意义。
1 资料与方法
1.1 一般资料 选择2013年6月—2015年1月于我院小儿内科确诊的ALL患儿30例,诊断及治疗参照儿童急性淋巴细胞白血病诊疗建议(第四次修订草案)。按Hepcidin表达水平中位数进行分组,高于中位数的定义为高水平组,低于中位数的为低水平组,每组15例。2组一般情况差异无统计学意义(P<0.05)。具有可比性。见表1。排除标准:①入院前已经接受治疗的;②治疗未满一个疗程;③合并引起贫血的其他疾病。本研究经河北医科大学第二医院伦理委员会批准(2020-R095)。设计随访表,以Hepcidin表达高低对患者进行分组,收集统计纳入组患儿的生存情况并计算无事件生存时间(event-free survival,EFS),随访截止时间为2020年1月。数据包括年龄、性别、危险度分级、初诊时血红蛋白(hemoglobin,HGB)、C反应蛋白(C-reactive protein,CRP)、血清铁蛋白(Ferritin)、转铁蛋白(Transferrin)。EFS为从诱导缓解治疗开始的第1天到出现复发、死亡或继发第二肿瘤的时间。
表1 30例急性淋巴细胞白血病患者基本资料
Table 1 Basic information of 30 patients with ALL (n=15,例数,%)
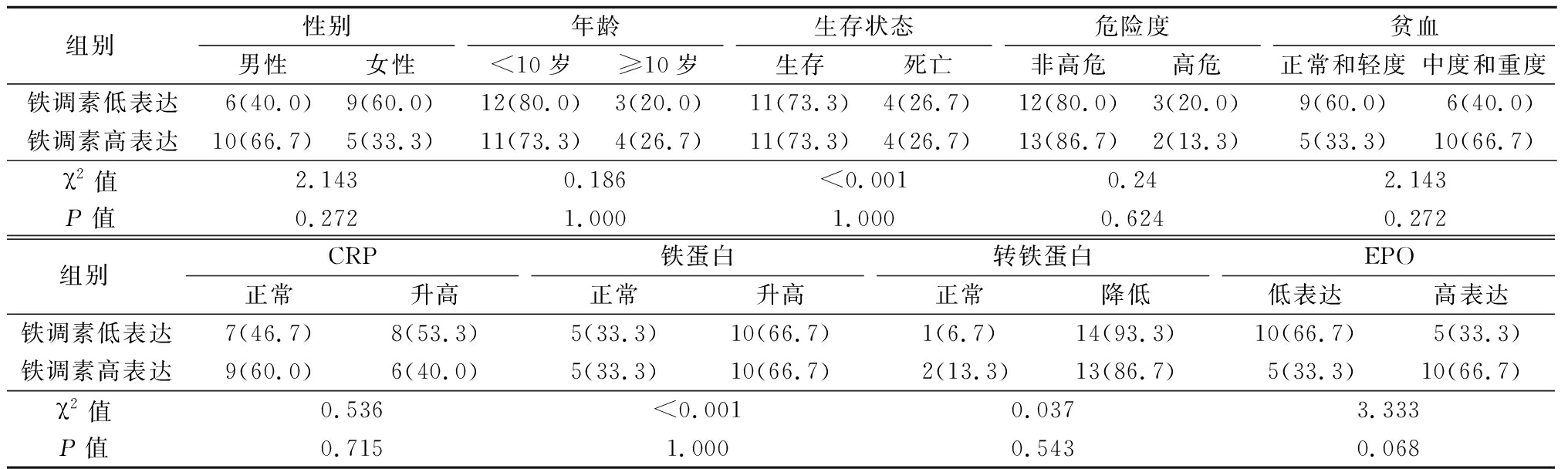
组别 性别男性女性年龄<10岁≥10岁生存状态生存死亡危险度非高危高危贫血正常和轻度中度和重度铁调素低表达6(40.0)9(60.0)12(80.0)3(20.0)11(73.3)4(26.7)12(80.0)3(20.0)9(60.0)6(40.0)铁调素高表达10(66.7)5(33.3)11(73.3)4(26.7)11(73.3)4(26.7)13(86.7)2(13.3)5(33.3)10(66.7)χ2值 2.1430.186<0.0010.242.143P值 0.2721.0001.0000.6240.272组别 CRP正常升高铁蛋白正常升高转铁蛋白正常降低EPO低表达高表达铁调素低表达7(46.7)8(53.3)5(33.3)10(66.7)1(6.7)14(93.3)10(66.7)5(33.3)铁调素高表达9(60.0)6(40.0)5(33.3)10(66.7)2(13.3)13(86.7)5(33.3)10(66.7)χ2值 0.536<0.0010.0373.333P值 0.7151.0000.5430.068
1.2 方法
1.2.1 标本的收集 研究对象采清晨空腹静脉血5 mL,将其中2 mL进行血常规及血红蛋白浓度检测,另外的3 mL放促凝管中室温凝固,凝固后低速离心3 000 r/min,20 min。取上清液1~2 mL,检测Transferrin、Ferritin及CRP,将其余血清收集好后于-80 ℃超低温冰箱中进行保存。
1.2.2 试剂与方法 血常规检测采用CELL-DYN3700血常规分析仪,Transferrin、Ferritin及CRP检使用IMMAGE800特种蛋白免疫分析仪,EPO及Hepcidin检测使用人铁调素酶联免疫吸附试验试剂盒(德国R&G公司)、EPO酶联免疫吸附试验试剂盒(苏州卡尔文生物有限公司)。所有操作均严格按照试剂盒说明书进行。
1.3 统计学方法 应用Graphpad 7.0统计软件处理数据。计量资料比较采用独立样本t检验。计数资料比较采用χ2检验,小样本数据采用Fisher精确检验校正。生存分析采用Kaplan-Meier法,生存曲线比较采用Log-Rank检验。单因素及多因素生存分析采用COX风险比例模型。双变量正态分布资料相关分析使用Pearson相关分析。 P<0.05为差异有统计学意义。
2 结 果
2.1 患者生存 分析30例ALL患者按Hepcidin表达水平分成2组,高于中位表达水平的为高表达组(15例),低于中位表达水平的为低表达组(15例)。2组Hepcidin表达量分别为(114.4±48.63)μg/L和(21.98±15.94) μg/L,组间比较差异有统计学意义(t=6.997,P<0.05)。30例ALL患者随访至2020年1月,死亡及复发8例,无失访病例,5年总体EFS为77.586%,按Hepcidin水平分组后2组生存曲线比较无统计学差异(P>0.05),结果见图1。
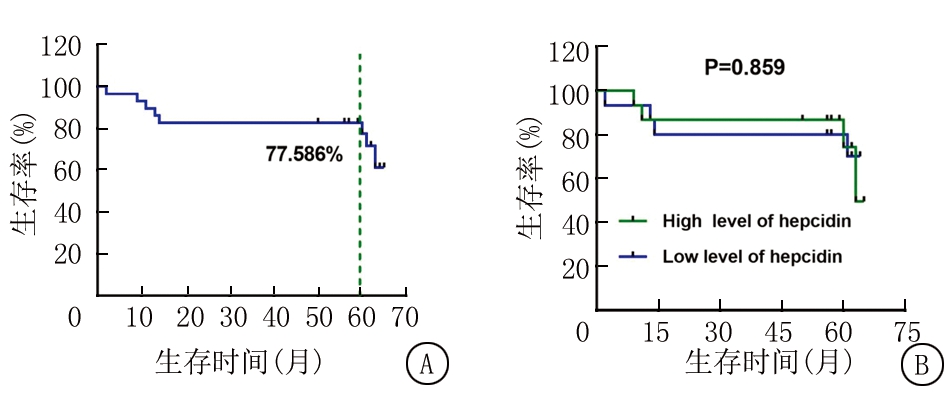
图1 30例ALL患者生存分析
A.30例ALL患者5年EFS;B.Hepcidin高水平和低水平组生存曲线比较
Figure 2 Survival analysis of 30 ALL patients
2.2 ALL患者生存影响因素分析 年龄是影响预后的因素,其中高年龄是影响预后的危险因素(OR=4.458,P=0.036)。而Hepcidin水平无论是单因素还是多因素分析都不是影响预后的危险因素(OR=1.135,P=0.859;OR=0.587,P=0.637),见表2。
表2 30例ALL患者生存因素分析
Table 2 Analysis of survival factors in 30 patients with ALL
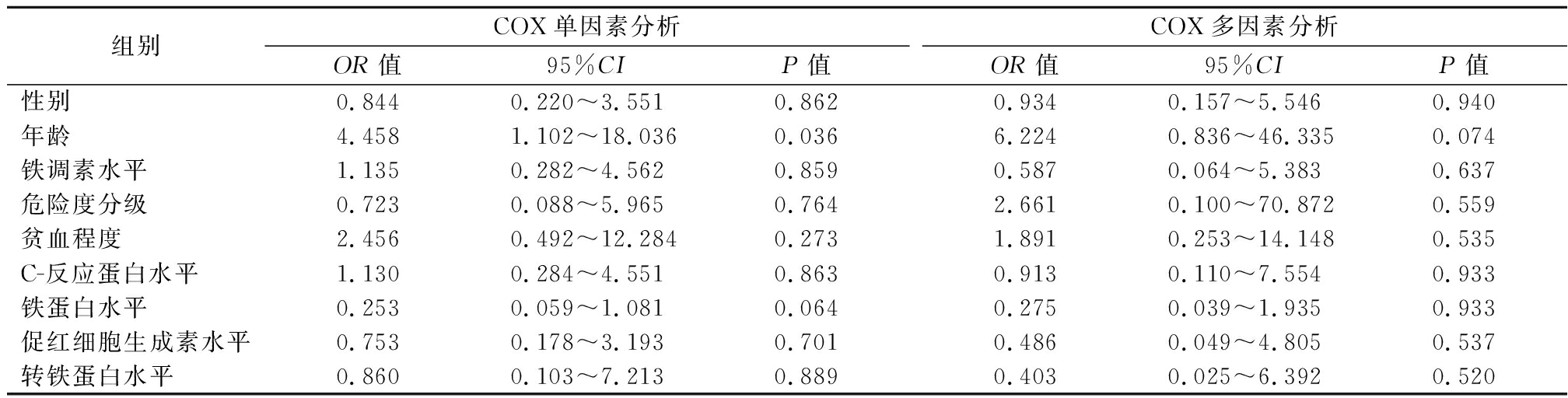
组别COX单因素分析OR值95%CIP值COX多因素分析OR值95%CIP值性别0.8440.220~3.5510.8620.9340.157~5.5460.940年龄4.4581.102~18.0360.0366.2240.836~46.3350.074铁调素水平1.1350.282~4.5620.8590.5870.064~5.3830.637危险度分级0.7230.088~5.9650.7642.6610.100~70.8720.559贫血程度2.4560.492~12.2840.2731.8910.253~14.1480.535C-反应蛋白水平1.1300.284~4.5510.8630.9130.110~7.5540.933铁蛋白水平0.2530.059~1.0810.0640.2750.039~1.9350.933促红细胞生成素水平0.7530.178~3.1930.7010.4860.049~4.8050.537转铁蛋白水平0.8600.103~7.2130.8890.4030.025~6.3920.520
2.3 Hepcidin与HGB、CRP、Ferritin、Transferrin、EPO之间相关分析 Hepcidin水平与Ferritin水平呈正相关(r=0.466,P=0.010),Hepcidin水平与HGB水平呈负相关(r=-0.407,P=0.026),Hepcidin水平与EPO水平、CRP水平和Transferrin水平无相关性(P=0.442、0.293、0.699)
3 讨 论
白血病是最常见的儿童恶性肿瘤,占发病率的30%,而其中最常见的为ALL[1]。ALL因其高发病率成为威胁儿童健康的重要疾病。随着治疗方案的优化及新药的研发,儿童ALL的生存率逐渐提高[2],生存质量越来越受到关注[3]。贫血是ALL常见的临床表现,不仅影响了患者的生存质量,也是导致疾病预后不良的因素。而贫血的机制除了肿瘤浸润之外还与铁稳态紊乱有关。
Hepcidin是肝脏合成的一种抗菌多肽,其编码基因是位于人类19号染色体长臂的HAMP(hepcidin antimicrobial peptide)基因,是机体铁代谢负调节的重要蛋白,通过与小肠黏膜细胞表面的膜铁转运蛋白结合,促膜铁转运蛋白使降解,减少铁的吸收,使血浆内铁缺乏[4]。Hepcidin水平在某些疾病中被证实是影响治疗及预后的因素[5],而我们前期的研究也证实儿童AL患者血清铁Hepcidin水平高于健康对照[6],但是Hepcidin水平是否影响儿童ALL的预后目前罕见报道,因此我们对30例ALL患者,按初诊时Hepcidin水平分为高水平和低水平2组,进行了长达5年的随访,结果显示虽然2组患者初诊血清Hepcidin水平存在显著差异,但是从长期随访结果来看,2组患者的生存曲线并没有差异。为进一步探讨Hepcidin对ALL儿童预后的影响,我们应用COX风险比例模型进行了单因素及多因素分析,单因素的结果显示Hepcidin水平并不是影响预后的独立因素,而年龄则有统计学意义,高年龄是影响预后的危险因素,这与我们临床观察到的结果一致。在临床实践中我们发现大于10岁患者的预后较小年龄患者预后相对较差[7],但是对于我们研究的病例,年龄因素并没有导致最终生存曲线的差异,因此又进行了多因素的分析,结果显示在考虑了危险度分级,感染等情况之后,年龄并没有成为影响预后的危险因素。而Hepcidin水平无论是单因素分析还是多因素分析都不能成为影响预后的危险因素,这与生存分析的结果一致。目前关于Hepcidin在AL中预后的研究较少,我国学者在2019年发表的文章中指出Hepcidin水平在AL缓解和未缓解组之间存在差异,但结果仅通过组间差异比较和相关分析得出,未进行长期随访,因此不能推断远期预后[8]。儿童ALL的远期预后受多因素的共同影响,比如化疗方案的选择,患者依从性,甚至患者的营养状态等都可能成为影响预后的因素,本研究显示在综合其他研究因素以后Hepcidin水平并没有成为影响患者预后的因素,这可能与我们后期治疗中严格控制患者输血次数有关,虽然没有在ALL患者中统计输血次数与Hepcidin水平的相关性,但是再生障碍性贫血患者的研究结果显示Hepcidin水平确实与输血量相关[9]。
铁超载是慢性病贫血的主要因素[10-11],最新研究发现在AL患者中同样存在铁超载的问题,由于反复接受红细胞输注,约1/4的患者存在铁超载的问题[12]。研究证实Hepcidin生成不足是形成铁超载的的根本原因[4]。为了分析Hepcidin在儿童ALL中的临床意义我们进行了相关性分析,结果证实Hepcidin与Ferritin水平呈正相关。Ferritin是机体内贮存铁的主要形式。Hepcidin可以抑制胞内铁转出,造成细胞内大量铁堆积,引起Ferritin的表达增加,造成铁超载的状态。我们同样观察到在ALL患者中血清Ferritin普遍高于正常水平,这提示在ALL患者中可能存在铁超载的问题。而Hepcidin与Ferritin同向升高在一定程度上解释了ALL初诊患者Hepcidin升高的问题。理论上,Hepcidin的升高造成血清循环铁的减少,从而继发引起转铁蛋白水平升高,但是在本研究结果显示30例患者中有27例转铁蛋白水平降低,这一反常现象可能是肿瘤性贫血发生的机制之一。
已知白细胞介素6和EPO可以调节Hepcidin的表达[13],其中EPO可能通过JAK/STAT通路来实现调节。ALL患者普遍存在贫血,而本研究也发现Hepcidin与HGB水平呈反比。理论上慢性贫血会造成机体EPO表达水平的升高,而EPO会负性调节Hepcidin的表达[14]。但是本研究并没有发现HGB水平和EPO水平的具有相关性,分析原因可能是由于ALL患者的贫血多为急性贫血,机体代偿反应不完善。而相关性分析显示Hepcidin与EPO水平无相关性,这一结果说明EPO对Hepcidin负反馈调节的失败可能是儿童ALL患者贫血的另一个机制。
IL-6除能调节Hepcidin的合成并造成铁稳态的紊乱外,还能通过影响EPO轴导致贫血的发生[15],我们的前期研究也发现IL-6与Hepcidin表达呈正相关。IL-6是炎症反应中重要的促炎因子[16],而炎症所引发的贫血也是儿童白血病贫血最常见的原因之一。ALL患者在疾病初期常合并感染,尤其是细菌感染,为了探讨ALL患者高Hepcidin水平是否与感染有关,本研究分析了CRP与Hepcidin的相关性,结果显示CRP与Hepcidin无相关关系,这就提示ALL患儿Hepcidin和IL-6高表达并不是感染的结果,而是疾病本身引起的。
综上所述,在儿童ALL患者中血清Hepcidin水平并不能作为影响预后的独立因素,而Ferritin的表达水平与血清Ferritin呈正相关,与HGB水平呈负相关,提示儿童ALL中铁代谢异常可能是导致患者贫血的一个重要原因。当然我们所有结果都是基于入组病例的统计学分析得出的,由于病例数的限制,可能存在一定的局限性,但是以Hepcidin为代表的的铁代谢指标的异常确实在儿童ALL中起到重要作用,需要引起大家重视。
[1] Kaplan JA. Leukemia in children[J]. Pediatrics in Review,2019,40(7):319-331.
[2] Advani A. Acute lymphoblastic leukemia (ALL)[J]. Best Pract Res Clin Haemato,2017,30(3):173-174.
[3] Vnu VK,Onta M,Joshi S. Health-related quality of life of nepalese children with leukemia using pediatric quality of life inventory 4.0 generic core scale[J]. J Pediatr Oncol Nurs,2017,34(5):322-330.
[4] Camaschella C,Nai A,Silvestri L. Iron metabolism and iron disorders revisited in the hepcidin era[J]. Haematologica,2020,105(2):260-272.
[5] Park S,Kosmider O,Maloisel F,et al. Dyserythropoiesis evaluated by the RED score and hepcidin:ferritin ratio predicts response to erythropoietin in lower-risk myelodysplastic syndromes[J]. Haematologica,2019,104(3):497-504.
[6] 刘娜,梁钰珩,张宝玺,等. 急性白血病患儿血清铁调素和炎性因子白介素6的表达及临床意义[J]. 中华医院感染学杂志,2017,27(06):1394-1397.
[7] Boissel N,Baruchel A. Acute lymphoblastic leukemia in adolescent and young adults: treat as adults or as children?[J]. Blood,2018,132(4):351-361.
[8] 陈雅彬,张江. AL患者血清铁调素、Treg细胞及NK细胞水平的变化与其预后的关系分析[J]. 贵州医药,2019,43(8):1231-1233.
[9] 刘娜,张宝玺,马夫天,等. 再生障碍性贫血患儿血清铁调素水平与输血量的关系[J]. 新医学,2017,48(10):719-721.
[10] Gupta R,Musallam KM,Taher AT,et al. Ineffective erythropoiesis:anemia and iron overload[J]. Hematol Oncol Clin North Am,2018,32(2):213-221.
[11] Moukalled NM,El RF,Temraz SN,et al. Iron overload in patients with myelodysplastic syndromes:an updated overview[J]. Cancer,2018,124(20):3979-3989.
[12] Nair M,Kuttath V,Nair A R,et al. Iron overload in children with leukemia receiving multiple blood transfusions[J]. Indian Pediatr,2018,55(11):962-965.
[13] Ginzburg YZ,Feola M,Zimran E,et al. Dysregulated iron metabolism in polycythemia vera: etiology and consequences[J]. Leukemia,2018,32(10):2105-2116.
[14] Li Z,Tu Y,Liu B. Treatment of renal anemia with roxadustat: advantages and achievement[J]. Kidney Diseases,2020,6(2):65-73.
[15] Akchurin O,Patino E,Dalal V,et al. Interleukin-6 contributes to the development of anemia in juvenile CKD[J]. Kidney Int Rep,2019,4(3):470-483.
[16] Ghasemi H. Roles of IL-6 in ocular inflammation: a review[J]. Ocul Immunol Inflamm,2018,26(1):37-50.