中心性浆液性脉络膜视网膜病变(central serous chorizoretinopathy,CSC)是一种病因不明的眼底病变,主要特征表现为黄斑部及其附近局限性浆液性神经上皮脱离,常伴有月牙状或环状出血[1],主要表现为视网膜神经上皮下有透明液体积聚,视物变暗、变小或变形,其患病率较高,多见于青年及中年男性,可单眼或双眼发病,具有自愈和复发倾向[2]。其中60%以上CSC患者不进行治疗干预3个月内可自愈,10%左右患者3~6个月内可自行痊愈,自愈后视力可达到正常[3],但部分CSC患者病情存在迁延、反复,使得病程延长,则会对患者视力功能造成永久性视力缺陷等不可逆性损害[4]。另外,目前尚无有效药物可用于CSC治疗,临床常以眼底荧光血管造影检查(fundus fluorescence angiography,FFA)为金标准对视网膜病变等疾病进行鉴别、诊断、辅助激光治疗及预后评价[5],并且临床研究发现FFA图像特征与CSC预后复发情况具有密切关联,因此进一步探讨影响CSC患者复发的相关因素具有重要的临床价值[6]。目前国内外对于视网膜病变的研究,大多集中于糖尿病引起的视网膜病变的危险因素、治疗方法以及肿瘤引起眼部病变等方面,很少有研究影响CSC预后复发的危险因素[7-10]。因此,本研究对我院收治的诊断为CSC的90例患者进行研究,旨在探讨影响CSC患者复发的相关因素,为临床改善CSC治疗方式,提高治疗质量,降低CSC复发风险,改善患者预后提供理论依据。现报告如下。
1 资料与方法
1.1 一般资料 选取2018年1月—2019年1月我院收治的CSC患者90例。其中男性77例,女性13例。年龄24~50岁,平均(37.25±3.92)岁;患病类型:累及单眼69例,累及双眼21例;患眼视力0.1~1.5,平均(0.82±0.21)。根据随访复发情况,将其分为复发组(n=30)和非复发组(n=60)。
1.2 纳入标准与排除标准 纳入标准:①患者均经过光学相干断层扫描(optical coherence tomography,OCT)诊断为CSC,OCT表现为黄斑或黄斑区外卵圆形或圆形视网膜神经上皮层有明确浆液性脱离;经FFA检查确诊为CSC复发;②依从性好;③18周岁以上;④无其他眼部疾病。排除标准:①合并严重心脑疾病,包括心脏病、脑中风、脑梗死等;②合并高血压;③肝肾功能障碍;④存在研究药物过敏史。
1.3 研究方法 所有患者入院均进行FFA和视力检查,采用Zeiss-Humphrey OCT 诊断仪,仪器组成包括眼底照相机、低相干干涉仪、监视器、计算机等。采用托吡卡胺滴眼液(江苏朗欧药业有限公司,国药准字H20067216)对患者进行扩瞳,然后进行无赤光眼底摄片,将1:2000荧光素钠稀释液(山东博士伦福瑞达制药有限公司,国药准字H20093096)通过肘前静脉缓慢注入,患者若未出现不适以及过敏症状,则快速静脉推注20%荧光素钠原液,同时间进行计时,进行眼底摄像机FFA检查。相关参数:扫描深度2 mm,长度4 mm,入射光线最大强度750 μm。记录患者FFA图像中的渗漏位置、渗漏面积、渗漏类型、渗漏分布情况及病灶大小。根据病变类型选择相应的治疗方式,包括激光光凝治疗和光动力疗法。治疗后随访6个月,对患者的视力功能进行复查及眼底造影复查,对复发和未复发患者的FFA图像结果及临床资料进行比较。
1.4 复发标准 治疗后6个月患者视力检查提示视力提高50%及以上或完全恢复正常,并且经过FFA复查,图像未见明确的视网膜色素上皮渗漏点,则判定为CSC未复发;患者视力未见明显提高甚至降低,FFA复查图像提示可见明确的视网膜色素上皮渗漏点,则为CSC复发。
1.5 观察指标 ①单因素分析2组患者个体临床特征及FFA检查结果。②多因素Logistic 回归分析:将单因素分析结果中可能是影响CSC复发的影响因素纳入Logistic 回归分析中。③危险因素与CSC复发的相关性。④危险因素对CSC复发的评估价值。
1.6 统计学方法 应用SPSS 22.0统计软件处理数据。符合正态分布的计量资料比较采用t检验;计数资料比较采用χ2检验。用单因素和多因素 Logistic 回归分析对可能影响CSC患者复发的相关因素进行比较。采用Spearman 相关分析法分析危险因素与CSC复发的相关性。运用受试者工作特征(receiver operating characteristics,ROC)曲线下面积(area under curve,AUC)分析危险因素对CSC患者复发的评估价值。P<0.05为差异有统计学意义。
2 结 果
2.1 2组患者的个体临床特征及FFA检查结果 对2组患者性别、年龄、体质量指数(body mass index,BMI)、合并色素上皮脱离、患病类型、治疗方式进行比较,差异无统计学意义(P>0.05)。2组患者病程、渗漏类型、渗漏点距离、渗漏面积比较差异有统计学意义(P<0.05)。见表1。
表1 2组临床特征及FFA结果单因素分析
Table 1 Univariate analysis of clinical characteristics and FFA results of two groups (例数)
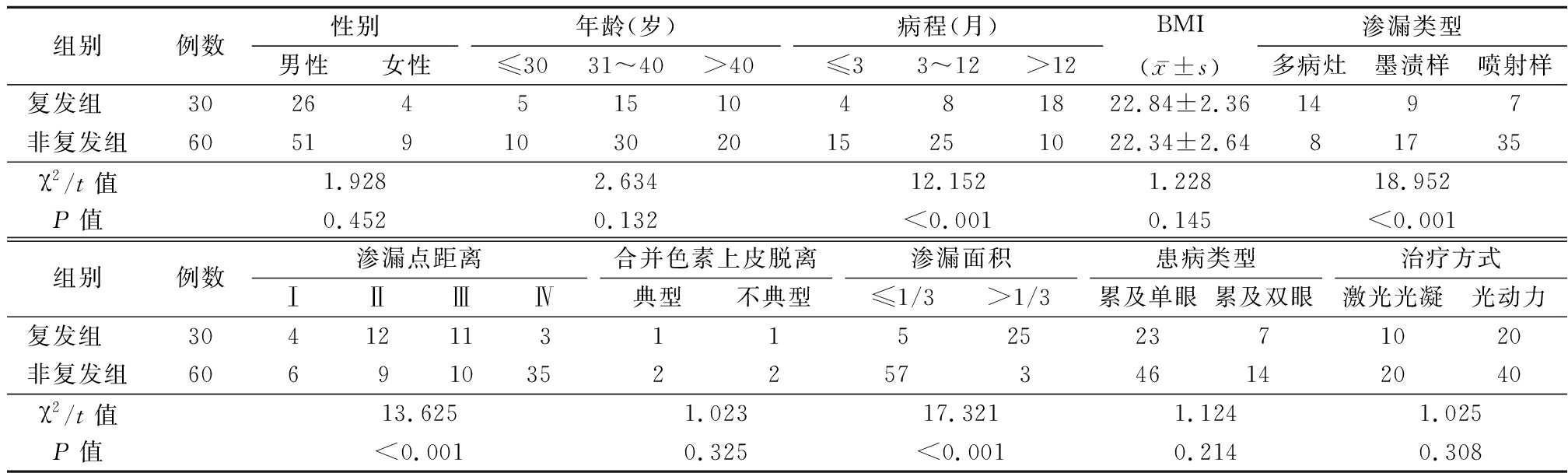
组别例数性别男性女性年龄(岁)≤3031~40>40病程(月)≤33~12>12BMI(x-±s)渗漏类型多病灶墨渍样喷射样复发组 3026451510481822.84±2.361497非复发组6051910302015251022.34±2.6481735χ2/t值1.9282.63412.1521.22818.952P值0.4520.132<0.0010.145<0.001组别例数渗漏点距离ⅠⅡⅢⅣ合并色素上皮脱离典型不典型渗漏面积≤1/3>1/3患病类型累及单眼累及双眼治疗方式激光光凝光动力复发组 30412113115252371020非复发组606910352257346142040χ2/t值13.6251.02317.3211.1241.025P值<0.0010.325<0.0010.2140.308
2.2 CSC患者复发的多因素Logistic回归分析 以CSC是否复发作为因变量,将单因素方差分析中病程(≤3岁=1、3~12岁=2、>12岁=3)、渗流类型(多病灶=1、墨渍样=2、喷射样=3)、渗漏面积(≤1/3=1、>1/3=2)、渗漏点距离(Ⅰ=1、Ⅱ=2、Ⅲ=3、Ⅳ=4)作为自变量,纳入多因素Logistic回归分析,结果显示,病程、渗漏类型、渗漏面积、渗漏点距离是影响CSC患者复发的独立危险因素(P<0.05)。见表2。
表2 多因素Logistic 回归分析
Table 2 Multivariate Logistic regression analysis
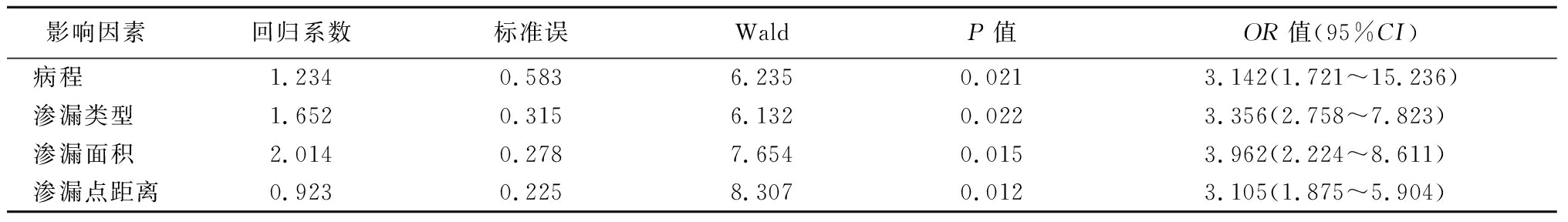
影响因素回归系数标准误WaldP值OR值(95%CI)病程 1.2340.5836.2350.0213.142(1.721~15.236)渗漏类型 1.6520.3156.1320.0223.356(2.758~7.823)渗漏面积 2.0140.2787.6540.0153.962(2.224~8.611)渗漏点距离0.9230.2258.3070.0123.105(1.875~5.904)
2.3 危险因素与CSC复发的相关性 Spearman相关分析结果显示,影响CSC复发的危险因素中,病程、渗漏类型、渗漏面积、渗漏点距离与CSC复发呈线性正相关关系(P<0.05)。见表3。
2.4 危险因素对CSC复发的评估价值 病程、渗漏类型、渗漏面积、渗漏点距离联合指标评估CSC患者复发的特异度(89.87%)、敏感度(87.91%)、AUC(0.895)均显著高于单一指标,差异有统计学意义(P<0.05)。见表4。
表3 危险因素与CSC复发的Spearman相关分析
Table 3 Spearman correlation analysis of risk
factors and CSC recurrence
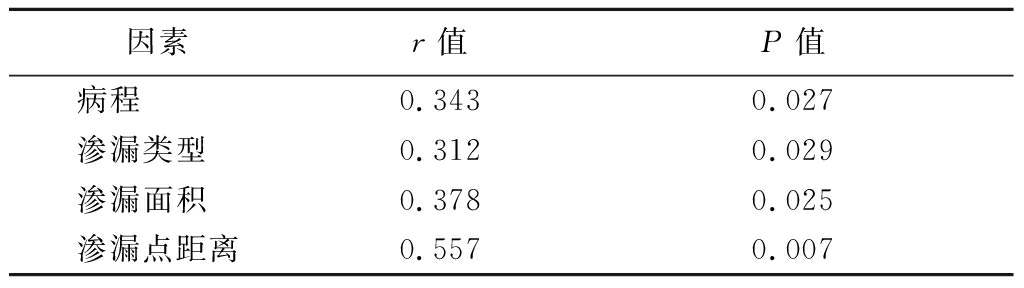
因素r值P值病程 0.3430.027渗漏类型 0.3120.029渗漏面积 0.3780.025渗漏点距离0.5570.007
表4 评估患者6个月CSC复发情况准确性AUC比较
Table 4 AUC comparison of the accuracy of CSC recurrence in patients at 6 months
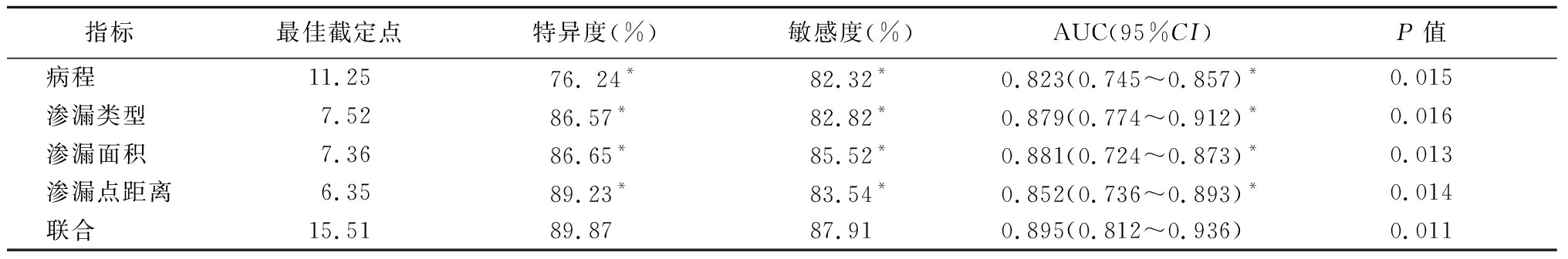
指标最佳截定点特异度(%)敏感度(%)AUC(95%CI)P值病程 11.2576. 24*82.32*0.823(0.745~0.857)*0.015渗漏类型 7.5286.57*82.82*0.879(0.774~0.912)*0.016渗漏面积 7.3686.65*85.52*0.881(0.724~0.873)*0.013渗漏点距离6.3589.23*83.54*0.852(0.736~0.893)*0.014联合 15.5189.8787.910.895(0.812~0.936)0.011
注:联合指标是指病程、渗漏类型、渗漏面积、渗漏点距离联合 * P值<0.05与联合指标比较
3 讨 论
CSC是指由于视网膜色素上皮屏障功能受损,液体进入黄斑区或者后极部的神经上皮造成的神经上皮脱离,常伴随视网膜色素上皮层的脱离[11],中年男性CSC发病率显著高于女性[12]。其病因主要是由于黄斑区脉络膜产生了异常的新生血管,该血管引起反复出血及渗出[13],加上视网膜色素上皮细胞的屏障功能降低,脉络膜毛细血管的渗漏液经过此损伤处区进入视网膜神经上皮下堆积,从而引起视网膜神经上皮浆液性脱离,最终导致黄斑区不可逆的结构性破坏[14]。临床研究发现,A型性格(脾气急躁、喜欢竞争等)、精神紧张且压力大、采用糖皮质激素类治疗药物等是导致CSC发病的危险因素,主要可能与应激状态下肾上腺素水平上升有关[15]。而CSC大多具有自限性,大多数患者在3~6个月内可自然恢复[16],但部分患者存在病情频繁复发、迁延,延长了CSC病程,对患者视力功能造成永久性损伤[17]。因此,探讨影响CSC患者复发的危险因素有利于临床采取有效干预措施,提高治疗效果,从而准确预测患者预后,降低患者视力功能不可逆性损害的发生风险。
FFA是临床诊断CSC以及评估CSC预后的一种最常用的检查方式[18],其通过将具有荧光作用的染料迅速注入血管,同时采用加有滤色片的眼底照相机、眼底镜等进行眼底观察或图像采集,从而明确患者眼底病变状况[19]。单纯的视网膜色素上皮脱离在早期的眼底血管造影中表现为高荧光并且伴随脱离范围,随着时间增加其荧光亮度逐渐增加,一直维持到眼底血管造影后期,但其神经上皮脱离形态、大小、类型大多维持稳定[20]。
龚玉静等[21]学者研究发现,在FFA检查中,脉络膜新生血管中无源性渗漏和经典型渗漏占比分别为58.6%和41.4%,无源性渗漏中合并出血占50%、渗出占38.2%、色素紊乱占35.3%。曹端荣等[22]学者研究发现,多种因素可影响CSC患者预后,FFA诊断类型与CSC预后有显著的相关性,其中渗漏类型、面积和位置与CSC预后不良呈线性相关关系,在临床上可作为预测CSC预后的指标。陈兰[23]学者研究发现,病程、渗漏类型、渗漏位置、渗漏面积均与CSC预后不良呈正相关关系(r=0.367、0.269、0.518、0.325)。本研究结果显示,通过单因素分析、多因素Logistic回归分析结果提示病程、渗漏类型、渗漏面积、渗漏点距离是影响CSC患者复发的独立危险因素,Spearman 相关分析结果提示病程、渗漏类型、渗漏面积、渗漏点距离与CSC复发呈线性正相关关系,并且病程、渗漏类型、渗漏面积、渗漏点距离评估CSC患者复发的准确性较高,表明FFA检查图像特征与CSC复发存在密切关联,病程、渗漏类型、渗漏面积、渗漏点距离是影响CSC患者复发的相关因素,能准确预测CSC复发情况,且均与CSC复发存在正相关性,即病程越长,墨渍样、多病灶渗漏越多,渗漏面积越广,渗漏点位置距离中心凹越近,CSC患者复发的风险越高,视力功能恢复效果越差。原因可能在于在CSC初期及急性发病期,这个时期患者病程大多在3个月左右,并且大多数患者FFA图像大多呈喷射样渗漏,此时期对患者进行相应对症治疗能够最大程度恢复患者视力功能,且恢复效果较好。而出现迁延发作、反复不愈患者的FFA图像大多呈现黄斑区墨渍样渗漏或多病灶渗漏,此类经常复发的患者患病时长大多在6个月以上,受病程影响,患者视力明显下降,此时期患者治疗的视力恢复效果显著差于患病3个月时期。另外,渗漏点位置距离中心凹近,就会增加患者黄斑区存在色素脱落或硬性渗漏残留等发生风险,进而引起患者中央区视力和视野反复受损,最终导致CSC复发及预后不良。而视网膜损伤程度通常能够通过渗漏面积较为直观的反映,并且随着渗漏面积的扩大,上皮分离脱落累及患者黄斑区中心的风险也会随之上升,对视力功能造成的损伤程度也会增加,从而对患者视力功能的恢复产生严重不利影响,最终造成CSC复发。这与龚玉静等[21]、曹端荣等[22]、陈兰[23]学者研究结论相似。
综上所述,影响CSC患者复发的相关因素复杂多样,其中病程长短、渗漏类型、渗漏面积、渗漏点距离是影响CSC患者复发的独立危险因素,且均与CSC复发呈正相关性,对评估CSC复发具有较高的敏感度和准确性,其联合指标评估价值更高,对临床早期诊断具有较高的临床价值。临床表示患者在病程初期就需要及时就诊,早期干预治疗效果更好,能够最大程度恢复患者视力功能,降低CSC复发的风险。另外,本研究仅调查了我院收治的CSC患者,样本含量较小,代表性可能存在不足,会对本研究结果的外推性产生局限性。因此,在未来研究中可扩大样本含量,比较不同检查方式下影响CSC患者复发的相关因素,从而提高研究结果的外推性。
[1] Cennamo G,Montorio D,Comune C,et al. Study of vessel density by optical coherence tomography angiography in patients with central serous chorioretinopathy after low-fluence photodynamic therapy[J]. Photodiagnosis Photodyn Ther,2020,30(12):1230-1235.
[2] Lupidi M,Fruttini D,Eandi CM, et al. Chronic neovascular central serous chorioretinopathy:a stress/rest optical coherence tomography angiography study[J]. Am J Ophthalmol,2020,211(25):63-75.
[3] van Rijssen TJ,van Dijk EHC,Scholz P,et al. Crossover to photodynamic therapy or micropulse laser after failure of primary treatment of chronic central serous chorioretinopathy:the REPLACE trial[J]. Am J Ophthalmol,2020,216(22):80-89.
[4] Shiihara H,Sonoda S,Terasaki H,et al. Quantitative analyses of diameter and running pattern of choroidal vessels in central serous chorioretinopathy by en face images[J]. Sci Rep,2020,10(1):1236-1240.
[5] 李婧,王光彬.糖尿病眼部病变的影像学诊断研究进展[J].医学影像学杂志,2018,28(5):852-854.
[6] Venkatesh R,Agarwal SK,Bavaharan B,et al. Multicolour imaging in central serous chorioretinopathy[J]. Clin Exp Optom,2020,103(3): 324-331.
[7] 王金瑞,杨莹.2型糖尿病视网膜病变相关因素研究进展[J].昆明医科大学学报,2019,40(4):131-135.
[8] Xie QW,Liu YF,Huang H,et al. An innovative method for screening and evaluating the degree of diabetic retinopathy and drug treatment based on artificial intelligence algorithms[J]. Pharmacol Res,2020,12(11):563-567.
[9] Sorour OA,Liu K,Mehta N,et al. Visual and anatomic outcomes of sustained single agent anti-VEGF treatment versus double anti-VEGF switching in the treatment of persistent diabetic macular edema[J]. Int J Retina Vitreous,2020,6(3):17-18.
[10] 李向玉,潘徐彪,魏楠,等.以眼部为首发症状的小细胞肺癌一例并文献复习[J].郑州大学学报(医学版),2019,54(1):141-143.
[11] van Rijssen TJ,Singh SR,van Dijk EHC,et al. Prospective evaluation of changes in choroidal vascularity index after half-dose photodynamic therapy versus micropulse laser treatment in chronic central serous chorioretinopathy[J].Graefes Arch Clin Exp Ophthalmol,2020,258(6):1191-1197.
[12] Tang AA,Lin AL. Purtscher-like retinopathy in adult-onset Still's disease,complicated by treatment-related central serous chorioretinopathy[J]. Am J Ophthalmol Case Rep ,2020,18(22):568-572.
[13] Wiryasaputra S,Wong JG. Focal choroidal excavation and central serous chorioretinopathy following choroidal neovascularization:a longitudinal case study[J]. Int J Retina Vitreous,2020,4(2):423-427.
[14] Linghu DD,Xu H,Liang ZQ,et al. Association between CFH single nucleotide polymorphisms and response to photodynamic therapy in patients with central serous chorioretinopathy[J].Int Ophthalmol,2020,40(4):951-956.
[15] Kaye R,Chandra S,Sheth J,et al. Central serous chorioretinopathy:an update on risk factors,pathophysiology and imaging modalities[J]. Prog Retin Eye Res,2020,11(15):836-840.
[16] Takayama K,Obata H,Takeuchi M. Efficacy of adalimumab for chronic vogt-koyanagi-harada disease refractory to conventional corticosteroids and immunosuppressive therapy and complicated by central serous chorioretinopathy[J]. Ocul Immunol Inflamm,2020,28(3):509-512.
[17] Saito W,Hashimoto Y,Hirooka K,et al. Changes in choroidal blood flow velocity in patients diagnosed with central serous chorioretinopathy during follow-up for pachychoroid pigment epitheliopathy[J]. Am J Ophthalmol Case Rep,2020,5(18):1458-1463.
[18] Komuku Y,Ide A,Fukuyama H,et al. Choroidal thickness estimation from colour fundus photographs by adaptive binarisation and deep learning,according to central serous chorioretinopathy status[J]. Sci Rep,2020,10(1):5640-5641.
[19] Mamdouh S,Youssef M,a El-Fayoumi D,et al. Fundus fluorescein angiography and optical coherence tomography findings in ocular and non-ocular Behcet′s disease[J]. Egypt J Biol Pest Co,2020,23(17):823-828.
[20] Littlewood R,Mollan SP,Pepper IM,et al. The utility of fundus fluorescein angiography in neuro-ophthalmology[J]. Neuroophthalmology,2019,43(4):217-234.
[21] 龚玉静,武炳慧,索琰,等.脉络膜新生血管的光学相干断层扫描血管成像和荧光素血管造影的特征分析[J].实用临床医药杂志,2019,23(22):14-16.
[22] 曹端荣,龚静青,金玲,等.中心性浆液性脉络膜视网膜病变患者荧光素眼底血管造影及预后特征相关性分析[J].临床眼科杂志,2018,26(1):18-21.
[23] 陈兰.影响中心性浆液性脉络膜视网膜病变预后的相关因素[J].国际眼科杂志,2017,17(1):145-147.