非ST段抬高型急性冠状动脉综合征(non-ST segment elevation acute coronary syndrome,NSTE-ACS)作为一种严重的急性冠状动脉综合征(acute coronary syndrome,ACS)类型,多数患者年龄较大,合并较其他ACS患者更多的并发症,给社会造成了巨大的医疗负担[1]。研究显示,纤维蛋白原水平升高与ACS患者严重心脏不良事件(major adverse cardiac events,MACEs)的发生密切相关,而白蛋白可广泛用作冠状动脉疾病患者预后的独立预测因子被深入研究[2-5]。提示血清纤维蛋白原和白蛋白水平与冠状动脉粥样硬化性心脏病(coronary atherosclerotic heart disease,CHD)的发生发展具有一定的相关性,因此近年来有人将纤维蛋白原/白蛋白比值(fibrinogen to albumin ratio,FAR)与CHD进行了相关研究,提出FAR可作为反映外周循环炎症介质水平的指标之一。FAR是心血管事件的潜在且可预测的生物标志物,并与冠状动脉病变严重程度及冠状动脉介入后慢血流密切相关[6-7]。FAR可以预测ACS患者的临床预后[8-12]。NSTE-ACS患者院内影响MACEs的因素众多,FAR值和NSTE-ACS患者院内MACEs之间的相关性研究仍然较少。本研究旨在探讨NSTE-ACS患者院内FAR和MACEs之间的相关性,为NSTE-ACS患者提供了新的早期预测指标。
1 资 料 与 方 法
1.1 一般资料 回顾性分析2016年12月—2018年12月在甘肃省人民医院心内二科就诊的NSTE-ACS患者284例,男性189例,女性95例,年龄29~85岁,平均(61.22±8.54)岁。纳入标准:①NSTE-ACS患者诊断标准参照美国心脏协会/美国心脏病学会/欧洲心脏病学会指南[13];②胸痛时间在12 h内;③病案信息完整。排除标准:①在过去的1个月中患有活动性感染和炎性疾病,肝和肾功能慢性恶化并伴有衰竭,恶性肿瘤,营养不良、结核、血液系统疾病;②既往的经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)病史或冠状动脉旁路移植术病史。
本研究经过医院伦理委员会审查通过,所有患者均签署知情同意书。
1.2 资料收集 收集NSTE-ACS患者的一般资料,包括性别、年龄、静息心率、糖尿病、高血压病史、体重指数(body mass index,BMI)等,所有患者均于入院后12 h抽静脉血,应用血凝仪(STAGO-COMPACT,STAGO公司)检测纤维蛋白原;应用生化分析仪(AU5400,OLYMPUS公司)检测白蛋白、血肌酐、空腹血糖、肌钙蛋白(troponin I,TnI)、天冬氨酸转氨酶(aspartate aminotransferase,AST)、谷氨酸转氨酶(alanine aminotransferase,ALT)、三酰甘油(triglyceride,TG)、总胆固醇(total cholesterol,TC)、高密度脂蛋白胆固醇(high density liptein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low density liptein cholesterol,HDL-C);24 h内心脏超声(CX50,PHILIPS公司)行床旁检查,记录左心室射血分数(left ventricular ejection fractions,LVEF)。Gensini评分标准:冠状动脉病变程度<25%为1分,25%~50%为2分,51%~75%为4分,76%~90%为8分,91%~99%为16分,100%闭塞为32分;系数计算:左主干为5;回旋支病变:近侧为2.5,远侧为1;后侧支为0.5;后降支为1;前降支病变:近侧为2.5,中为1.5;对角支病变:D1为1,D2为0.5;右冠状动脉病变为1。Gensini评分=各支冠状动脉狭窄程度积分×对应系数之和。依据年龄、静息心率、心肌梗死史、心电图ST-T改变、血肌酐、心肌酶、是否接受再灌注治疗等计算Grace评分。记录NSTE-ACS患者院内MACEs(再发心肌梗死、心脏破裂、心源性休克、恶性心律失常、全因死亡等)发生情况。
1.3 分组 FAR值=纤维蛋白原/白蛋白,入院患者均采用Judkins法行冠状动脉造影,由2位心血管专家独立阅读冠状动脉造影光盘并计算Gensini评分,根据FAR比值三分位数法分为FAR低分组(FAR≤8.0)94例,FAR中分组(FAR>8.0~9.6)101例,FAR高分组(FAR>9.6)89例。FAR低分组男性50例,女性44例,平均(61.51±9.65)岁;FAR中分组男性69例,女性32例,平均(61.37±10.35)岁;FAR高分组男性70例,女性19例,平均(63.52±10.15)岁。
1.4 统计学方法 应用SPSS 24.0统计软件分析数据。计量资料比较采用单因素方差分析和SNK-q检验,计数资料比较采用χ2检验,影响因素确定采用多因素Logistic回归分析,ROC曲线分析FAR对NSTE-ACS患者院内发生MACEs的预测价值。P<0.05为差异有统计学意义。
2 结 果
2.1 3组患者临床基线资料比较 FAR高分组男性比例、BMI、TnI、AST、Gensini评分均显著高于FAR中分组和FAR低分组,LVEF低于FAR中分组和FAR低分组;而FAR中分组男性比例、BMI、TnI、AST、Gensini评分均显著高于FAR低分组,LVEF低于FAR低分组,差异有统计学意义(P<0.05)。3组年龄、静息心率、糖尿病、高血压、肌酐、空腹血糖、ALT、TG、TC、HDL-C、LDL-C、Grace评分差异无统计学意义(P>0.05)。见表1。
表1 3组患者临床基线资料比较
Table 1 Comparison of clinical baseline data of patients in three groups ![]()
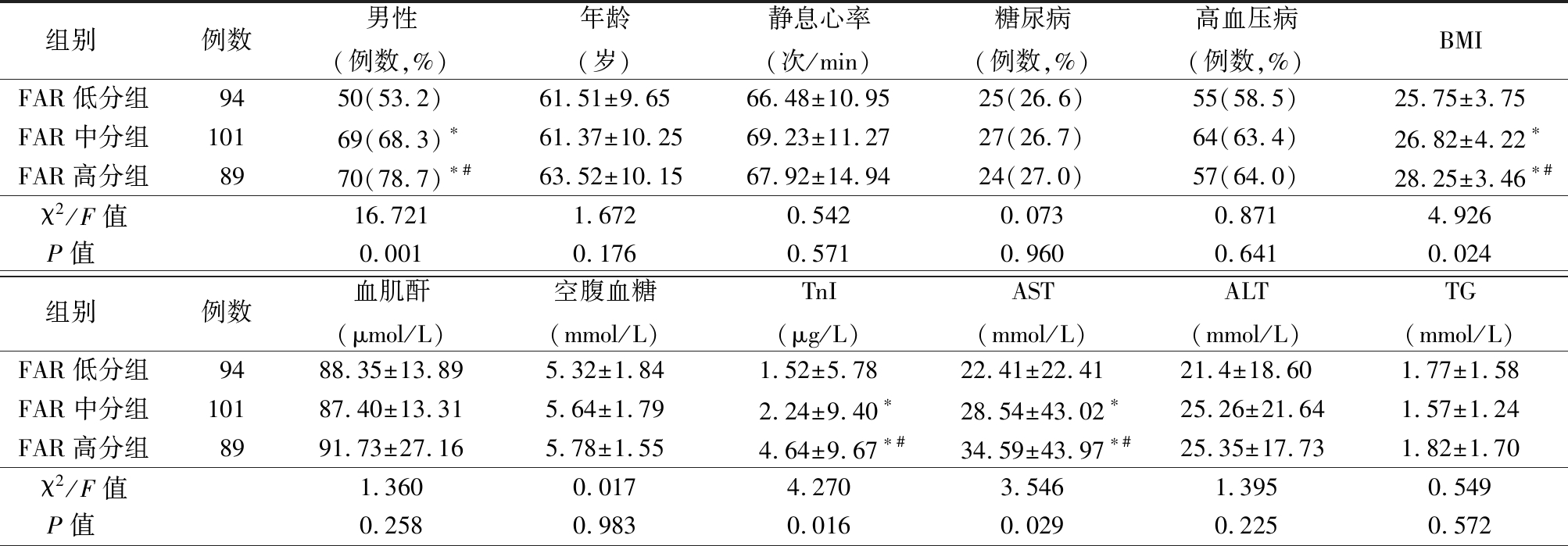
组别 例数男性(例数,%)年龄(岁)静息心率(次/min)糖尿病(例数,%)高血压病(例数,%)BMIFAR低分组9450(53.2)61.51±9.6566.48±10.9525(26.6)55(58.5)25.75±3.75FAR中分组10169(68.3)∗61.37±10.2569.23±11.2727(26.7)64(63.4)26.82±4.22∗FAR高分组8970(78.7)∗#63.52±10.1567.92±14.9424(27.0)57(64.0)28.25±3.46∗#χ2/F值16.7211.6720.5420.0730.8714.926P值 0.0010.1760.5710.9600.6410.024组别 例数血肌酐(μmol/L)空腹血糖(mmol/L)TnI(μg/L)AST(mmol/L)ALT(mmol/L)TG(mmol/L)FAR低分组9488.35±13.895.32±1.841.52±5.7822.41±22.4121.4±18.601.77±1.58FAR中分组10187.40±13.315.64±1.792.24±9.40∗28.54±43.02∗25.26±21.641.57±1.24FAR高分组8991.73±27.165.78±1.554.64±9.67∗#34.59±43.97∗#25.35±17.731.82±1.70χ2/F值1.3600.0174.2703.5461.3950.549P值 0.2580.9830.0160.0290.2250.572
表1 (续)
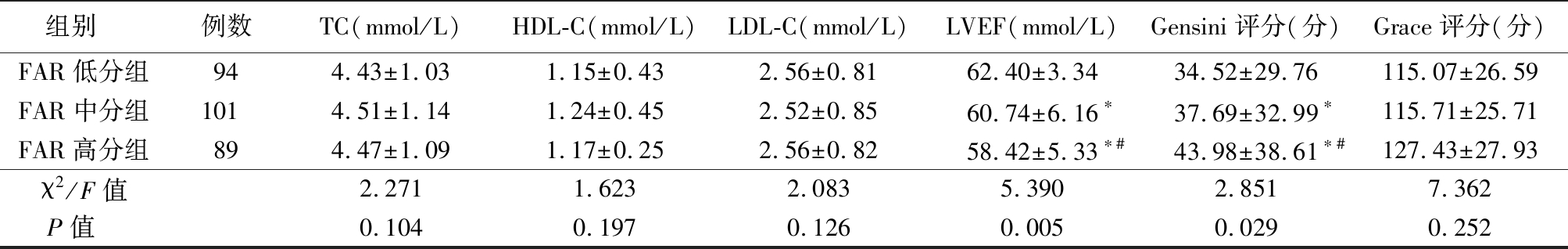
组别 例数TC(mmol/L)HDL-C(mmol/L)LDL-C(mmol/L)LVEF(mmol/L)Gensini评分(分)Grace评分(分)FAR低分组944.43±1.031.15±0.432.56±0.8162.40±3.3434.52±29.76115.07±26.59FAR中分组1014.51±1.141.24±0.452.52±0.8560.74±6.16∗37.69±32.99∗115.71±25.71FAR高分组894.47±1.091.17±0.252.56±0.8258.42±5.33∗#43.98±38.61∗#127.43±27.93χ2/F值2.2711.6232.0835.3902.8517.362P值 0.1040.1970.1260.0050.0290.252
*P值<0.05与FAR低分组比较 #P值<0.05与FAR中分组比较(χ2检验或SNK-q检验)
2.2 3组患者院内MACE事件发生率比较 FAR高分组院内MACEs总发生率著高于FAR中分组和FAR低分组,FAR中分组院内MACEs总发生率著高于FAR低分组,差异有统计学意义(P<0.05)。见表2。
表2 3组患者院内MACE事件发生率比较
Table 2 Comparison of MACEs during hospitalization in patients in three groups (例数,%)
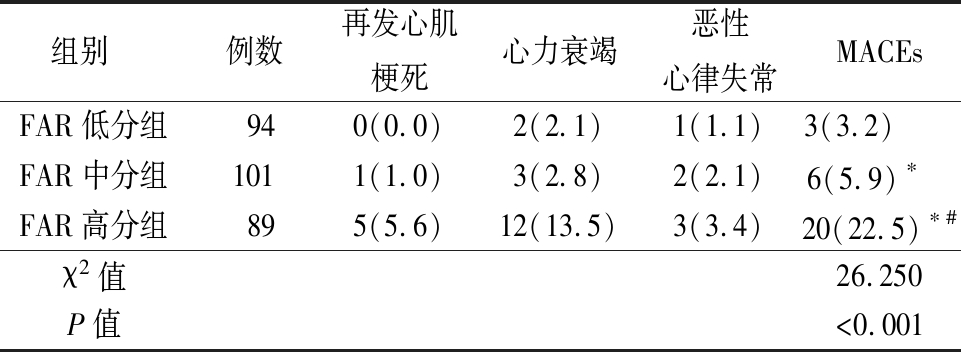
组别 例数再发心肌梗死心力衰竭恶性心律失常MACEsFAR低分组940(0.0)2(2.1)1(1.1)3(3.2) FAR中分组1011(1.0)3(2.8)2(2.1)6(5.9)∗ FAR高分组895(5.6)12(13.5)3(3.4)20(22.5)∗#χ2值26.250P值<0.001
*P值<0.05与FAR低分组比较 #P值<0.05与FAR中分组比较(χ2检验)
2.3 NSTE-ACS患者院内发生MACEs的危险因素分析 以NSTE-ACS患者是否发生院内MACEs(否=0,是=1)为因变量,以性别(男=0,女=1)、BMI(连续性变量)、TnI(连续性变量)、AST(连续性变量)、LVEF(连续性变量)、Gensini评分(连续性变量)、FAR(连续性变量)为自变量进行多因素Logstic回归模型分析,结果显示,Gensin评分、FAR是NSTE-ACS患者院内发生MACEs的独立危险因素(P<0.05)。见表3。
表3 NSTE-ACS患者院内发生 MACEs的多因素 Logistic回归分析
Table 3 Multivariate Logistic regression analysis of MACEs during hospitalization in NSTE-ACS patients
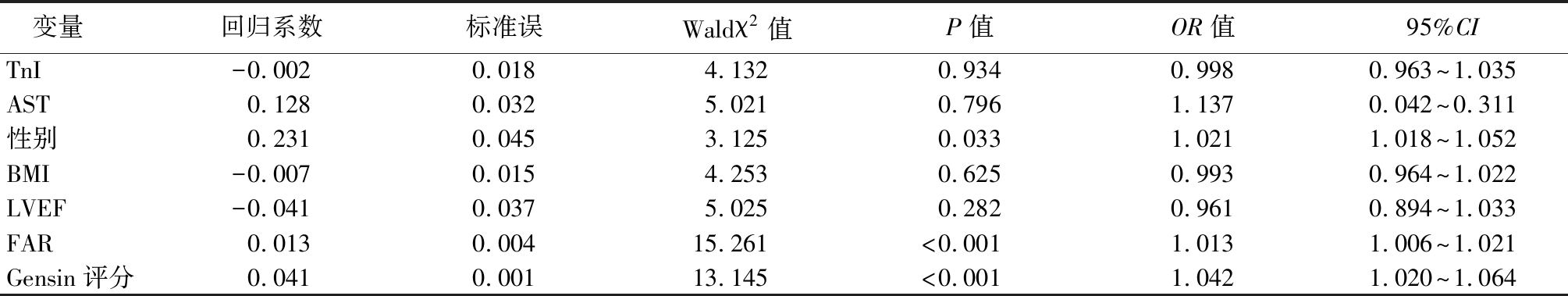
变量回归系数标准误Waldχ2值P值OR值95%CITnI-0.0020.0184.1320.9340.9980.963~1.035AST0.1280.0325.0210.7961.1370.042~0.311性别0.2310.0453.1250.0331.0211.018~1.052BMI-0.0070.0154.2530.6250.9930.964~1.022LVEF-0.0410.0375.0250.2820.9610.894~1.033FAR0.0130.00415.261<0.0011.0131.006~1.021Gensin评分0.0410.00113.145<0.0011.0421.020~1.064
2.4 FAR对NSTE-ACS患者院内发生MACEs的预测价值 以MACEs为测试变量,FAR为因变量,做ROC曲线分析显示:FAR对NSTE-ACS患者院内发生MACEs的AUC为0.725,敏感度为64.3%,特异度为83.1%。见图1。
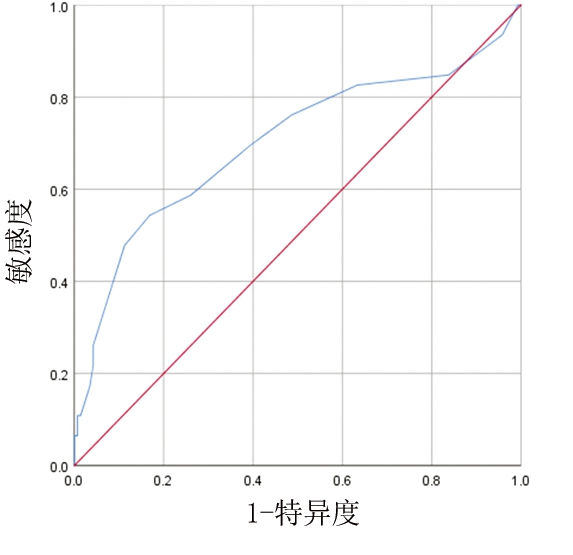
图1 FAR预测NSTE-ACS患者院内发生MACEs的ROC曲线
Figure 1 ROC curve of FAR predicting MACES during hospitalization in NSTE-ACS patients
3 讨 论
越来越多的研究证实,FAR与ACS患者的预后密切相关,并且FAR水平与冠状动脉疾病的严重程度呈正相关,随着FAR值增加,ACS患者的住院率和病死率均升高[6-10,12-13]。尽管NSTE-ACS患者住院期间病情比较复杂,且MACEs发生率相对较高,FAR可能是反映多种心血管疾病(如心律失常、心力衰竭、ACS等)进展的重要且检测便捷的炎症指标,可作为预测NSTE-ACS患者院内MACEs的独立预测因子。本研究结果显示,FAR是NSTE-ACS患者院内发生MACEs的影响因素,尽管FAR与NSTE-ACS患者院内发生MACEs的机制尚不清楚,大胆假设可能是由于NSTE-ACS患者的FAR增加以及各种机制(例如炎症、氧化应激、局部缺血和缺氧以及神经体液系统的激活)共同作用的结果。
研究表明,纤维蛋白原及其分解产物引起平滑肌细胞的黏附和迁移而引起内膜增生,可能促进冠状动脉病变进展,揭示其与冠状动脉疾病严重程度和复杂性的关系,并可能与CHD患者的糖代谢和心血管结局密切相关[14-16]。Gao等[17]研究表明,血浆纤维蛋白原水平与冠状动脉Gensini评分呈正相关,并与男性发生心血管不良事件密切相关。白蛋白是血清中的主要蛋白质,除了调节细胞外液的渗透压外,还具有抗氧化、抗血小板聚集、抗炎等多种特性,与炎症呈负相关[18]。Wada等[19]纳入1 316例PCI术后CHD患者,平均随访7.5年,发现其中发生MACEs 181例,Kaplan-Meier曲线显示血清白蛋白浓度降低患者MACEs发生率较高(Log-rank,P<0.001),以最高四分位数 (>43 g/L)为参考,一、二、三分位数校正后的危险比(HR)分别为1.97(95%CI:1.12~3.55)、1.77(95%CI:0.99~3.25)和1.19(95%CI:0.68~2.15),提示低白蛋白水平与CHD预后密切相关。
本研究结果显示,FAR高分组男性比例、BMI、TnI、AST、Gensin评分高于FAR低分组和FAR中分组(P<0.05),FAR中分组男性比例、BMI、TnI、AST、Gensin评分高于FAR低分组(P<0.05);FAR高分组MACEs发生率高于FAR中分组和FAR低分组,FAR中分组MACEs发生率高于FAR低分组,差异有统计学意义(P<0.05);多因素Logistic回归分析显示,Gensin评分、FAR是NSTE-ACS患者院内发生MACEs的影响因素,与He等[10]的研究结果相一致。Xiao等[11]回顾性分析了PCI的急性ST段抬高型心肌梗死(ST-segment elevation myocardial infarction,STEMI)患者475例,死亡59例(12.4%),高FAR组病死率高于低FAR组(20.5% vs 8.6%,P<0.001),多因素Logstic回归分析结果显示,FAR是STEMI患者PCI后发生MACEs的危险因素。Zhao等[12]纳入510例PCI术后STEMI患者,多变量Cox回归分析模型结果显示,FAR是PCI后30 d病死率的的危险因素。 etin等[9]对362例PCI术后ACS患者随访了(23.2±1.8)个月,发现MACEs(+)组FAR值更高(109±34 vs 91±23,P<0.001),ROC曲线分析表明,FAR=95.64是预测MACEs的最佳截断值(敏感度为61.8%,特异度为62.7%),FAR在MACEs预测中的AUC优于白蛋白、纤维蛋白原(0.668 vs 0.647 vs 0.637,P<0.05),证实了FAR是PCI治疗ACS患者长期MACEs的预测因子。可以发现,随着FAR水平升高NSTE-ACS患者院内MACEs发生率升高,因此推断FAR可能是NSTE-ACS患者院内发生MACEs的预测因子。FAR参与冠状动脉病变可能的机制:纤维蛋白原、白蛋白参与动脉内皮的损伤和脂质在动脉内膜层的集聚,导致动脉壁的慢性炎症,逐渐形成动脉粥样硬化,而纤维蛋白原及其降解产物促进血液维持高凝状态、诱导红细胞可逆性聚集,进而限制了血液的流动性是最终导致动脉粥样硬化血栓形成的重要原因之一,正常浓度范围的血清白蛋白可以抑制血小板活化和聚集、抑制血管内皮凋亡,血清白蛋白浓度减低时促进粥样硬化斑块的形成和破裂,导致急性心血管事件发生。
etin等[9]对362例PCI术后ACS患者随访了(23.2±1.8)个月,发现MACEs(+)组FAR值更高(109±34 vs 91±23,P<0.001),ROC曲线分析表明,FAR=95.64是预测MACEs的最佳截断值(敏感度为61.8%,特异度为62.7%),FAR在MACEs预测中的AUC优于白蛋白、纤维蛋白原(0.668 vs 0.647 vs 0.637,P<0.05),证实了FAR是PCI治疗ACS患者长期MACEs的预测因子。可以发现,随着FAR水平升高NSTE-ACS患者院内MACEs发生率升高,因此推断FAR可能是NSTE-ACS患者院内发生MACEs的预测因子。FAR参与冠状动脉病变可能的机制:纤维蛋白原、白蛋白参与动脉内皮的损伤和脂质在动脉内膜层的集聚,导致动脉壁的慢性炎症,逐渐形成动脉粥样硬化,而纤维蛋白原及其降解产物促进血液维持高凝状态、诱导红细胞可逆性聚集,进而限制了血液的流动性是最终导致动脉粥样硬化血栓形成的重要原因之一,正常浓度范围的血清白蛋白可以抑制血小板活化和聚集、抑制血管内皮凋亡,血清白蛋白浓度减低时促进粥样硬化斑块的形成和破裂,导致急性心血管事件发生。
然而,本研究也具有一定的局限性。第一,收集病例数较少;第二,临床资料尤其是一些检验指标(包括纤维蛋白原、白蛋白等)收集的时间点具有差异,可能影响判断FAR与MACEs之间的关系;第三,本研究是一项回顾性、单中心、小样本队列研究,需要进一步验证NSTE-ACS患者住院期间FAR值和MACEs之间的关系及其在前瞻性、多中心、大样本队列研究中的预测价值。
[1] Rupprecht HJ,Geeren M,Weilemann S,et al. Acute coronary syndrome without ST-elevation(NSTE-ACS)[J]. Herz,2019,44(1):10-15.
[2] Peng Y,Xia TL,Li YM,et al. Fibrinogen is related to long-term mortality in Chinese patients with acute coronary syndrome but failed to enhance the prognostic value of the GRACE score[J]. Oncotarget,2017,8(13):20622.
[3] Gu H,Yang X. Predictive value of plasma D-dimer and fibrinogen degradation products on prognosis of acute coronary syndrome[J]. Int J Clin Exp Med,2016,9(7):14548-14553.
[4] Zhu L,Chen M,Lin X. Serum albumin level for prediction of all-cause mortality in acute coronary syndrome patients:a meta-analysis[J]. Biosci Rep,2020,40(1):BSR20190881.
[5] Gonz lez-Pacheco H,Amezcua-Guerra LM,Sandoval J,et al. Prognostic implications of serum albumin levels in patients with acute coronary syndromes[J]. Am J Cardiol,2017,119(7):951-958.
lez-Pacheco H,Amezcua-Guerra LM,Sandoval J,et al. Prognostic implications of serum albumin levels in patients with acute coronary syndromes[J]. Am J Cardiol,2017,119(7):951-958.
[6] 赵一品,汤建民,季莹莹,等.非ST段抬高型急性冠脉综合征患者血清纤维蛋白原/白蛋白与冠脉病变程度的关系[J].山东医药,2018,58(33):9-12.
[7] Kayapinar O,Ozde C,Kaya A. Relationship between the reciprocal change in inflammation-related biomarkers(Fibrinogen-to-albumin and hsCRP-to-albumin ratios) and the presence and severity of coronary slow flow[J]. Clin Appl Thromb Hemost,2019,25:1076029619835383.
[8] Karahan O,Acet H,Ertas F,et al. The relationship between fibrinogen to albumin ratio and severity of coronary artery disease in patients with STEMI[J]. Am J Emerg Med,2016,34(6):1037-1042.
[9]  etin M,Erdo
etin M,Erdo an T,Kiriš T,et al. Predictive value of fibrinogen-to-albumin ratio in acute coronary syndrome[J]. Herz,2019,44(3):1-7.
an T,Kiriš T,et al. Predictive value of fibrinogen-to-albumin ratio in acute coronary syndrome[J]. Herz,2019,44(3):1-7.
[10] He D,Jiao Y,Yu T,et al. Prognostic value of fibrinogen to albumin ratio in predicting 1 year clinical progression in patients with non ST elevation acute coronary syndrome undergoing percutaneous coronary intervention[J]. Exp Ther Med,2019,18(4):2972-2978.
[11] Xiao L,Jia Y,Wang X,et al. The impact of preoperative fibrinogen-albumin ratio on mortality in patients with acute ST-segment elevation myocardial infarction undergoing primary percutaneous coronary intervention.[J]. Clin Chim Acta,2019,493:8-13.
[12] Zhao Y,Yang J,Ji Y,et al. Usefulness of fibrinogen-to-albumin ratio to predict no-reflow and short-term prognosis in patients with ST-segment elevation myocardial infarction undergoing primary percutaneous coronary intervention[J]. Heart Vessels,2019,34(10):1600-1607.
[13] Rodriguez F,Mahaffey KW. Management of patients with NSTE-ACS:a comparison of the recent AHA/ACC and ESC guidelines[J]. J Am Coll Cardiol,2016,68(3):313-321.
[14] Tabakc MM,Gerin F,Sunbul M,et al. Relation of plasma fibrinogen level with the presence,severity,and complexity of coronary artery disease[J]. Clin Appl Thromb Hemost,2017,23(6):638-644.
[15] Liu SL,Wu NQ,Shi HW,et al. Fibrinogen is associated with glucose metabolism and cardiovascular outcomes in patients with coronary artery disease[J]. Cardiovasc Diabetol,2020,19(1):36.
[16] Jang JY,Bae JS,Kang MG,et al. P6462 The impact of serial measurement of plasma fibrinogen and cardiovascular outcomes after percutaneous coronary intervention in patients with coronary artery disease[J]. Eur Heart J,2018,39(suppl_1):566.
[17] Gao XY,Zhou BY,Zhang MZ,et al. Association between fibrinogen level and the severity of coronary stenosis in 418 male patients with myocardial infarction younger than 35 years old[J]. Oncotarget,2017,8(46):81361-81368.
[18] Arques S. Human serum albumin in cardiovascular diseases[J]. Eur J Intern Med,2018,52:8-12.
[19] Wada H,Dohi T,Miyauchi K,et al. Long-term clinical impact of serum albumin in coronary artery disease patients with preserved renal function[J]. Nutr Metab Cardiovasc Dis,2018,28(3):285-290.